摘 要: 为探明喷施赤霉素影响汉麻生长发育的分子机理,本研究对赤霉素处理组(CL)与未处理组(CK)进行代谢组学与蛋白质组学分析。代谢组分析结果表明,共鉴定到509个显著差异表达代谢物,其中显著上调及下调差异代谢物分别为230、279个,并对其进行化合物分类、相关性、VIP分析及KEGG代谢通路富集分析,获得9条显著富集通路。通过蛋白质组分析得到757个显著差异蛋白,其中显著上调蛋白615个,显著下调蛋白142个,并对GO功能及KEGG代谢通路等进行分析,获得12条显著富集通路。组学联合分析发现,显著性差异蛋白与差异代谢物主要集中在苯丙烷生物合成和各种植物次生代谢产物的生物合成途径,通过喷施赤霉素调节汉麻抗逆性并调控汉麻木质素过程,该研究为赤霉素调控汉麻生长发育的分子机理提供依据。
关键词:汉麻;赤霉素;蛋白质组;代谢组;差异代谢通路
汉麻(Cannabis sativa L.)又称“工业大麻”,为大麻科(Cannabaceae)大麻属(Cannabis)的一年生草本植物。根据汉麻不同的应用方向可分为纤用型、籽用型、籽纤兼用型及花叶用型(Gabarin et al.,2023)。汉麻是一种具有可持续性和高产能的工业用途作物(苏芳芳等,2022),其种植方法简单、环境适应性强、生长迅速等特性以及低碳环保等优点,使其成为全球公认的关键特种经济作物之一(Adesina et al.,2020)。
赤霉素(gibberellic acid,GA)参与种子休眠萌发、调控茎叶果实生长等生理过程(Rizza and Jones,2019),利用赤霉素处理汉麻种子,能够提高汉麻种子在干旱条件下的萌发率(Du et al.,2022),适宜的赤霉素处理对作物生长发育及纤维产量起到促进作用。针对汉麻种植企业寻求高纤维汉麻品种需求,常规育种手段培育高纤维汉麻品种受制因素较多,难度较大,结合化学调控方法及分子育种手段扩大汉麻的经济效益也是一种科学有效的方法。随着生物技术的发展,赤霉素的生物合成调控在众多模式作物上被逐步揭示(Tang et al.,2021),其信号传递途径的分子机制(Jing et al.,2024)及通路研究也取得进展(Bao et al.,2020),应对汉麻产业发展趋势,开展赤霉素调控汉麻生长发育的分子机制研究尤为重要。
多组学技术分析在植物中已被广泛应用,涉及多个层面。Deng等(2022)应用代谢组与蛋白质组分析白茶加工过程中类黄酮苷的变化机制,为白茶味道形成提供新的表征。也有学者通过代谢组与蛋白质组分析不同浸泡温度下大豆种子的分子变化(Min et al.,2020)。在生长激素调节植物生长发育方向,综合蛋白质组和代谢组揭示了生长素(IAA)在烟草打顶后腋芽发育中的核心作用,揭示了IAA在调节腋芽生长中的关键作用(Zou et al.,2024)。在逆境胁迫育种工作中,也可以运用多组学联合分析筛选及验证关键基因(李洁和姚晓华,2019)。Jie等(2023)通过转录组与代谢组联合分析发现苎麻的木质素合成受外源赤霉素调控。本研究以喷施赤霉素为处理组,喷施水溶液为对照组,通过对代谢组、蛋白质组进行分析,明确赤霉素处理汉麻后其差异代谢物、差异蛋白及相关代谢通路的变化,并通过组学联合分析获得响应赤霉素处理的共有差异代谢通路,并分析其代谢物及基因,明确赤霉素处理后相关重要的代谢途径,为解析赤霉素对汉麻生长发育的调控机制提供参考。
1 结果与分析
1.1 赤霉素处理下汉麻叶片的代谢组分析
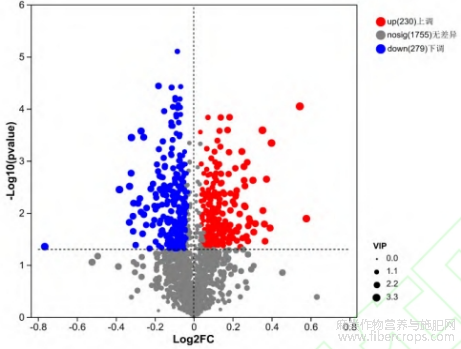
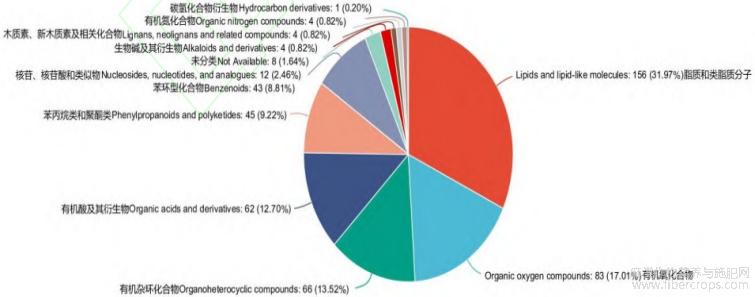
通过对赤霉素处理组(CL)与未处理组(CK)汉麻叶片样品进行代谢组测试,共获得阳离子代谢物1138个,阴离子代谢物839个。根据VIP>1,Pvalue<0.05条件筛选差异代谢物,赤霉素处理组(CL)和未处理组(CK)中筛选获得显著性差异代谢物509个,其中上调显著性差异代谢物230个,下调显著性差异代谢物279个(图1),下调代谢物显著差异性较大。使用HMDB数据库的化合物分类功能,对赤霉素处理组(CL)与未处理组(CK)的差异代谢物进行化合物分类,两组间的差异代谢物主要为脂质和类脂质分子(156个)、有机氧化合物(83个)、有机杂环化合物(66个)、有机酸及其衍生物(62个)等,脂质分子及有机氧代谢物对汉麻喷施赤霉素响应较大(图2)。
图1 赤霉素处理组(CL)与未处理组(CK)差异火山图
注:横坐标为表达量倍数变化值,纵坐标为差异变化显著性,纵轴越上,显著性越大;图中点的大小及颜色代表VIP值及差异代谢物的变化形式
图2 赤霉素处理组(CL)与未处理组(CK)差异代谢物分类
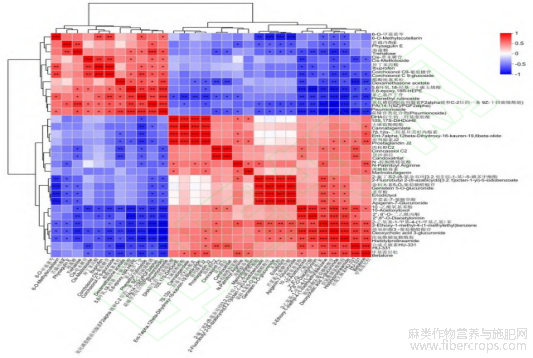
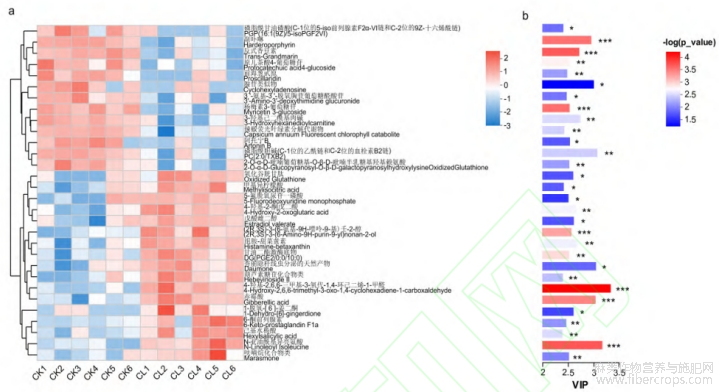
对差异代谢物丰度前30的代谢物进行相关性分析,结果显示不同代谢物之间正(负)相关系数的绝对值在0.1922~1,相关性幅度较大,并根据P value评价代谢物间相关性的显著程度,且部分代谢物间相关差异较为显著(图3)。根据OPLS-DA分析得到的VIP值,选取VIP值排名前30的差异代谢物进行代谢物的表达量及VIP值分析,不同处理组间代谢物表达量较为一致,赤霉素处理组(CL)17个差异代谢物的表达量高于未处理组(CK),13个差异代谢物的表达量低于未处理组(CK)(图4a),上调代谢物PC(2:0/TXB2)、Cyclohexyladenosine、Harderoporphyrin处理后组间差异较大,下调代谢物4-Hydroxy-2,6,6-trimethyl-3-oxo-1,4-cyclohexadiene-1-carboxaldehyde、Gibberellic acid、N-Linoleoyl Isoleucine处理后组间差异较大(图4b)。
图3 赤霉素处理组(CL)与未处理组(CK)代谢物相关性热图
注:图中所示标注均为代谢物名称及代谢物聚类信息图,红色代表正相关,蓝色代表负相关,绝对值越趋近于1,代表其相关性越高,*代表P<0.05,**代表P<0.01,***代表p<0.001
图4 赤霉素处理组(CL)与未处理组(CK)代谢物的表达谱与VIP值
注:a图为代谢物表达量聚类图,b图为VIP值条形图,值的大小代表组间差异程度,P value越小,颜色越深,差异越显著,*代表P<0.05,**代表P<0.01,***代表p<0.001
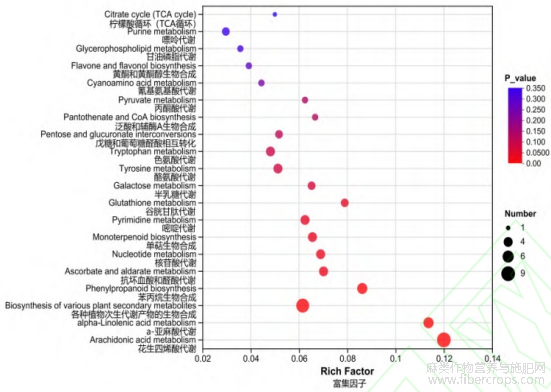
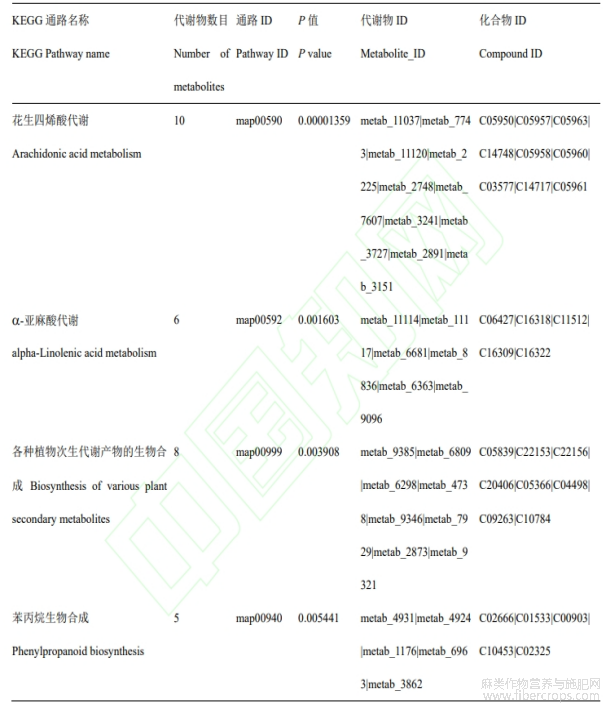
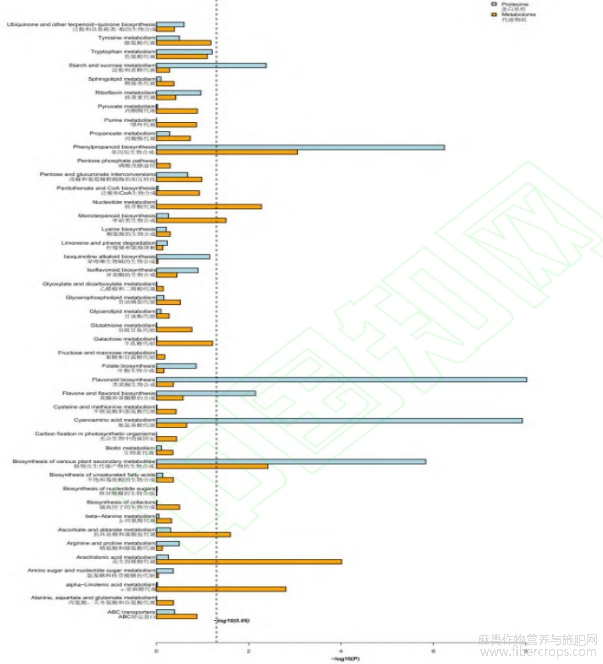
对显著性差异代谢物进行KEGG通路注释和富集分析,赤霉素处理组(CL)与未处理组(CK)汉麻的差异代谢物分布到53条代谢通路中。根据结果可知,在P<0.05的条件下,发现9条显著的富集通路,分别为花生四烯酸代谢、a-亚麻酸代谢、各种植物次生代谢产物的生物合成、苯丙烷生物合成、抗坏血酸和醛酸代谢、核苷酸代谢、单萜生物合成、嘧啶代谢、谷胱甘肽代谢。并且其中一些代谢物能够同时影响多个代谢途径(图5)。在P<0.01的条件下,发现4条具有极显著性富集的通路,有花生四烯酸代谢、a-亚麻酸代谢、各种植物次生代谢产物的生物合成、苯丙烷生物合成,分别富集到9、5、8、5个差异代谢物(表1)。
图5 赤霉素处理组(CL)与未处理组(CK)差异代谢物的KEGG富集分析
注:横纵坐标分别为富集因子和KEGG通路;气泡的大小及颜色代表代谢物数量及显著性
表1 KEGG通路富集详情表
1.2 赤霉素处理下汉麻叶片的蛋白质组学分析
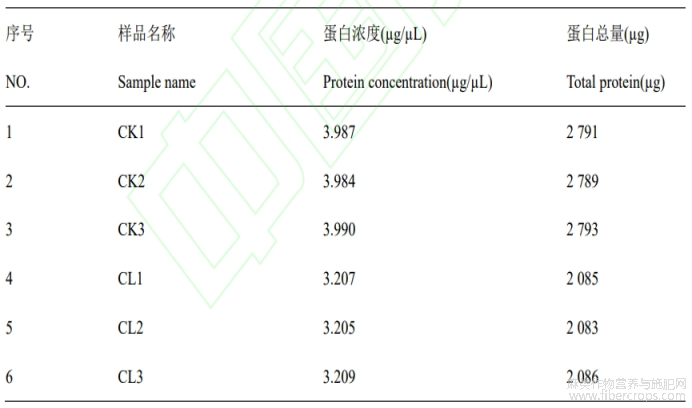
对进行蛋白质组学测序的样品进行SDS-PAGE电泳分析及BCA定量结果分析,发现电泳条带清晰丰富,均一性良好(图6),BCA定量结果显示蛋白总量大于50µg,满足4D Labelfree蛋白组学测序要求(表2)。
图6 赤霉素处理组(CL)与未处理组(CK)的SDS-PAGE电泳
注:Marker包含10种彩色预染的已知分子量标准蛋白,分子量范围为10kD~180kD
表2 赤霉素处理组(CL)与未处理组(CK)样品的蛋白质量
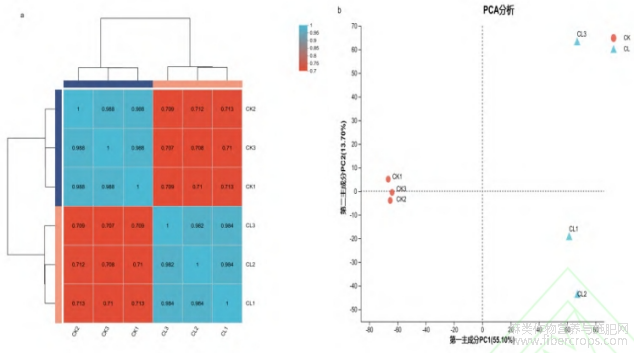
对赤霉素处理组(CL)与未处理组(CK)汉麻样品进行相关性热图分析及PCA分析,同组处理间样品相关性结果良好,相关系数在0.98以上(图7a)。蛋白定量PCA分析结果表明,赤霉素处理组(CL)与未处理组(CK)样本分离显著,说明经过赤霉素喷施后处理效果较好(图7b)。
图7 样本的相关性图(a)及PCA得分图(b)
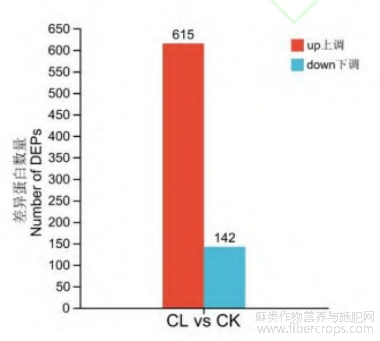
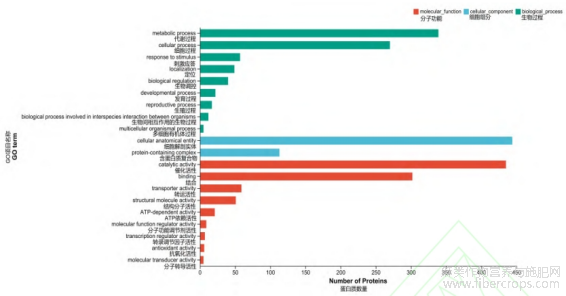
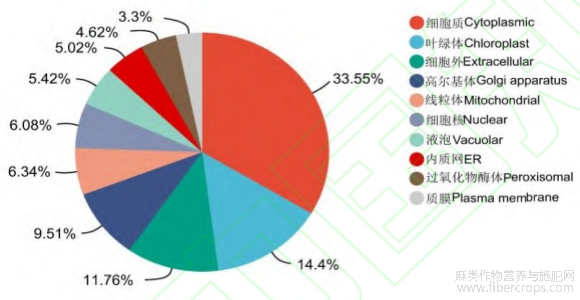
利用4D-Label Free技术对CL和CK样品进行蛋白定量分析,通过UniProt数据库搜索鉴定共鉴定到肽段数量为565290个,鉴定到的蛋白数量为62001个,鉴定到的蛋白group数量为9261个。以P value<0.05为参考,不同处理组间蛋白表达上调2倍以上(FC>2)为上调蛋白,蛋白表达下调0.5倍以上为下调蛋白(FC<0.5),共共筛选到757个差异蛋白,其中上调和下调蛋白个数分别为615和142个(图8)。对两组中的差异表达蛋白进行GO功能聚类分析,其中涉及生物过程的GO富集条目主要位于代谢过程、细胞过程,涉及细胞组分的GO富集条目主要位于细胞解剖实体、含蛋白质复合物,涉及分子功能的GO富集条目主要位于结合、催化活性结合(图9)。对两处理组所鉴定到的差异表达蛋白进行亚细胞定位预测,其主要定位于细胞质和叶绿体(图10)。
图8 赤霉素处理组(CL)与未处理组(CK)的差异蛋白图
图9 赤霉素处理组(CL)与未处理组(CK)的差异蛋白GO注释分析
图10 赤霉素处理组(CL)与未处理组(CK)的差异蛋白的亚细胞定位预测
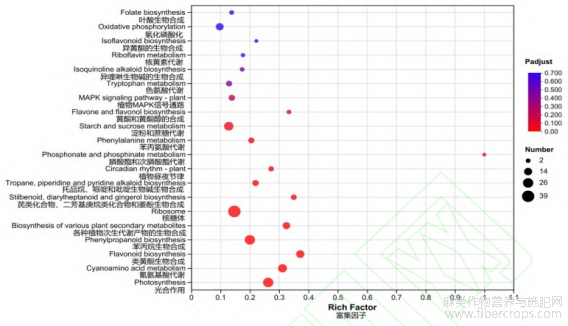
为了进一步了解汉麻喷施赤霉素的差异蛋白在代谢途径中的变化,将筛选出的差异蛋白映射到KEGG代谢通路上,进行通路注释和富集分类分析,总计富集到96个代谢通路。根据KEGG富集分析,在P<0.05的条件下,富集到12个显著性差异的KEGG途径,分别为光合作用、氰氨基酸代谢、类黄酮生物合成、苯丙烷生物合成、各种植物次生代谢产物的生物合成、核糖体、芪类化合物、二芳基庚烷类化合物和姜酚生物合成、托品烷、哌啶和吡啶生物碱生物合成、植物昼夜节律、膦酸盐和次膦酸盐代谢、苯丙氨酸代谢、淀粉和蔗糖代谢通路(图11)。在P<0.01的条件下,发现7条具有极显著性富集的通路,有光合作用、氰氨基酸代谢、类黄酮生物合成、苯丙烷生物合成、各种植物次生代谢产物的生物合成、核糖体、芪类化合物、二芳基庚烷类化合物和姜酚生物合成代谢通路,分别富集到26、19、16、26、13、39、7个差异蛋白(表3),其中光合作用代谢途径差异蛋白表达量24个上调,2个下调,其余代谢途径差异蛋白均显著上调。
图11 赤霉素处理组(CL)与未处理组(CK)差异蛋白的KEGG富集分析
注:横纵坐标分别为富集因子和KEGG通路,气泡的大小及颜色代表代谢物数量及显著性
表3 KEGG通路富集详情表
1.3 赤霉素处理下汉麻叶片的代谢组与蛋白质组联合分析
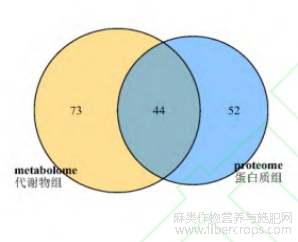
对赤霉素处理组(CL)与未处理组(CK)的代谢组及蛋白质组分析的KEGG通路可视化分析,蛋白质组有96条KEGG代谢通路,代谢组有117条KEGG代谢通路,共有KEGG代谢通路44条(图12)。
对蛋白组和代谢组共有的KEGG代谢通路进行分析,分析其在各通路富集的显著性水平,根据各差异蛋白及代谢物KEGG通路显著性富集结果,其中差异代谢物和差异蛋白的苯丙烷生物合成和各种植物次生代谢产物的生物合成通路在P<0.05水平下均显著富集,木质素合成相关蛋白表达发生改变,其代谢通路推测与赤霉素调控汉麻木质素合成有重要关系(图13)。
图12 蛋白质组与代谢组KEGG代谢通路韦恩图
图13差异蛋白/代谢物KEGG富集柱状图
注:横轴为显著性,值越大,通路富集越显著,纵轴为通路名称
为确定差异蛋白与差异代谢物的相关性,对二者基于皮尔森相关系数进行相关性分析,相关系数小于0时,为负相关;大于0时,为正相关。
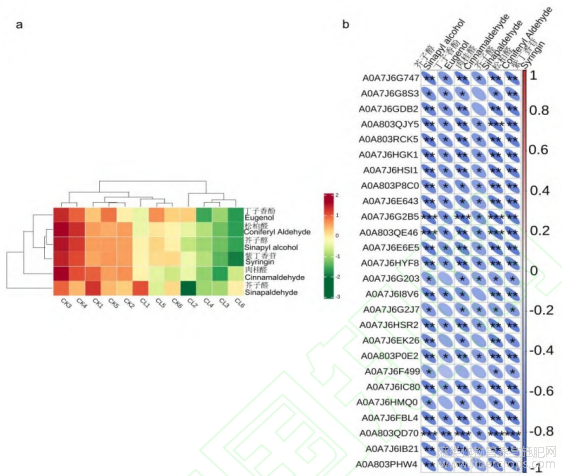
苯丙烷生物合成途径富集到26个差异蛋白,共编码8种酶,分别为caffeoyl-CoA O-methyltransferase(EC:2.1.1.104)、cinnamyl-alcohol dehydrogenase(EC:1.1.1.195)、phenylalanine ammonia-lyase(EC:4.3.1.24)、peroxidase(EC:1.11.1.7)、caffeic acid3-O-methyltransferase(EC:2.1.1.68)、4-coumarate-CoAligase(EC:6.2.1.12)、cinnamyl-alcohol dehydrogenase(EC:1.1.1.195)、shikimate O-hydroxycinnamoyltransferase(EC:2.3.1.133)、coniferyl-aldehydede hydrogenase(EC:1.2.1.68),差异蛋白表达量相对未处理组均上调。该途径共检测到6个差异代谢物,代谢物均在赤霉素处理下表达量降低(图14a),差异蛋白与差异代谢物间的相关性均为负相关,且大部分均达到了显著差异水平(图14b)。
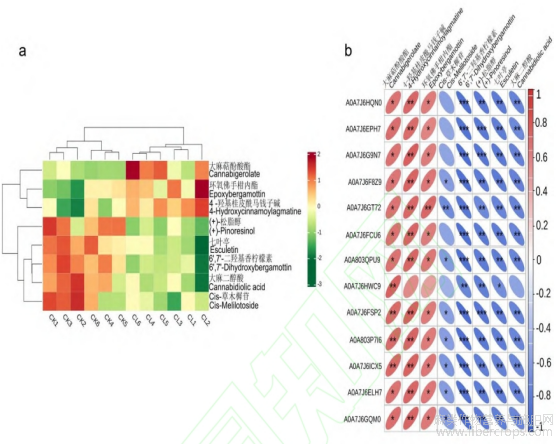
各种植物次生代谢产物的生物合成途径富集到13个差异蛋白,共编码2种酶,为beta-glucosidase(EC:3.2.1.21)、3''-deamino-3''-oxonicotianaminereductase(EC:1.1.1.285),相对未处理组差异蛋白表达量均上调。该途径共检测到8个差异代谢物,在赤霉素处理下,Cannabigerolate、4-Hydroxycinnamoylagmatine、Epoxybergamottin三个代谢物的表达量上升(图15a)且与差异蛋白呈正相关,其余5个代谢物表达量降低并与差异蛋白呈负相关,且大部分均达到了显著差异水平(图15b)。分析结果说明赤霉素处理后苯丙烷生物合成、各种植物次生代谢产物的生物合成代谢途径的相关代谢物及蛋白均受到调控,可能为汉麻响应赤霉素调控的关键代谢物及蛋白。
图14 苯丙烷生物合成途径差异代谢物的含量热图(a)以及差异代谢物和差异蛋白之间的相关性热图(b)
注:*代表P<0.05,**代表P<0.01,***代表p<0.001
图15 各种植物次生代谢产物的生物合成途径差异代谢物的含量热图(a)以及差异代谢物和差异蛋白之间的相关性热图(b)
注:*代表P<0.05,**代表P<0.01,***代表p<0.001
2 讨论
植物生长调节剂在农业生长中发挥着重要的功效,赤霉素促进种子萌发、打破休眠,刺激植物细胞生长、提高作物株高,改善果实品质,提高作物抗逆性等。针对不同作物,喷施适宜浓度的赤霉素增加经济作物产量,提高经济效益。赤霉素对株高具有促进作用,适宜赤霉素浓度喷施芦苇导致其株高增高,植株生物量增加,喷施后还增加芦苇的纤维素含量,降低木质素含量,提高纤维利用率,提高经济效益(邹小智等,2024)。喷施外源赤霉素有效缓解盐碱胁迫下园林小菊的生长状态,提高株高及叶片大小,增强园林小菊抗氧化及光合能力,提高产量(虎淘淘等,2024)。对生长期烟草喷施赤霉素溶液,处理后促进烟苗生长及加强病虫害抵御能力、提高烟叶产量及质量,较未处理组增产增收(张晓英等,2018)。赤霉素在分子层面调控水稻株高通常与赤霉素合成代谢相关基因、赤霉素信号转导与传递、其他激素协同调控相关(范兆宇和张蕾,2024)。
在本研究中,在汉麻快速生长时期对植株进行赤霉素喷施,对赤霉素处理组(CL)与未处理组(CK)收集叶片样品,进行汉麻的代谢组和蛋白组研究。
赤霉素处理后的代谢组分析显示花生四烯酸代谢与a-亚麻酸代谢途径代谢物表达量均得到改变,并均属于脂质和类脂质分子,证明赤霉素处理后与脂肪代谢相关。在高山被孢霉菌中,通过植物激素诱导后,可以改善其花生四烯酸的生物合成,提高脂肪酸和脂质的生物合成(Zhang et al.,2019)。a-亚麻酸作为茉莉酸类物质合成的起点,影响茉莉酸合成基因合成,在植物抗逆性调控方向发挥作用。
蛋白质组分析中,检测到显著上调差异蛋白占总数量的80%,说明赤霉素处理后汉麻蛋白表达有显著的差异,KEGG富集通路与代谢组富集通路差异较大。光合作用为作物生长发育重要的影响因素,有学者揭示光与赤霉素协同调控植物发育的新机制(Li et al.,2016),在本研究中光合作用通路蛋白含量变化较大,26个差异蛋白表达量仅有2个下调,其余均为上调蛋白,下调蛋白参与编码了光系统Ⅰ中PsaH、PsaK基因,上调蛋白参与编码光系统Ⅰ中PsaA、PsaB及光系统Ⅱ中PsbA、PsbB、PsbC、PsbD、PsbS基因,证明在喷施赤霉素后,光合系统的相关基因可能对汉麻的生长发育起到一定调控作用。植物类黄酮生物合成途径差异蛋白表达量在赤霉素处理后均上调,分别参与编码花青素还原酶(ANR)、香豆素合成酶(CHS)、类黄酮醇合成酶(FLS)等,赤霉素处理后有可能诱导这些变化基因的表达,也有学者通过鉴别银杏类黄酮生物合成代谢途径的基因家族,发现该途径的基因家族的相关基因受激素、胁迫等方面诱导(Liu et al.,2022)。对两组学KEGG富集通路比较分析,赤霉素处理组(CL)与未处理组(CK)中显著性差异蛋白与差异代谢物主要集中在苯丙烷生物合成和各种植物次生代谢产物的生物合成等途径,可能为赤霉素对汉麻木质素合成调控的关键代谢途径。在苎麻上已证明外源赤霉素调控苎麻的木质素合成(Jie et al.,2023),外源赤霉素还在玉米上调控玉米的木质素合成,从而介导玉米叶片的节律生长(Yao et al.,2024)。
苯丙烷生物合成代谢途径是植物生长发育的基础,在适应环境变化及抵御外界胁迫中有重要作用,木质素途径和类黄酮途径为该代谢途径中最重要的两个分支途径(Dong and Lin,2021)。在赤霉素处理后,通过蛋白质组学发现汉麻苯丙烷生物合成代谢途径上游底物酶被依次催活,代谢组发现相关植物木质素组成相关代谢物发生变化,促进汉麻木质素途径,参与汉麻细胞木质化,提高抗逆性。
各种植物次生代谢产物的生物合成途径在植物中尤为重要,β-葡萄糖苷酶为该代谢途径中重要的酶,其在植物细胞壁的木质化,植物激素激活等方面发挥着重要作用(Xu et al.,2024),喷施赤霉素处理后,汉麻植株中编码β-葡萄糖苷酶的蛋白表达提高,响应赤霉素诱导,但具体关键基因还需进一步探究。
本研究通过组学分析得到了赤霉素处理后的差异蛋白质及差异代谢物,并通过组学联合分析获得共有代谢通路,获得响应赤霉素处理的汉麻差异表达蛋白及差异代谢物,但差异数量较多,还需进一步筛选验证,下一步通过过表达技术验证关键基因,该研究在组学层面为赤霉素调控汉麻生长发育的分子机制提供了理论参考及数据支撑,为赤霉素应用奠定基础。
3 材料与方法
3.1 试验材料与处理
采取盆栽方式在黑龙江省科学院大庆分院户外棚室内进行试验,供试材料品种为‘火麻一号’,适宜东北地区播种,纤用型汉麻品种,由黑龙江省科学院大庆分院选育并提供种质资源。挑选整齐饱满的汉麻种子至于装有混合基质(草炭:蛭石:珍珠岩=3:1:1)的塑料育苗盒(7cm×7cm×7cm)中,置于透明育苗盒中培养,常规栽培管理。出苗后选取长势一致的健壮植株,移入室外盆栽中进行培养。
盆栽中汉麻生长至快速生长期进行赤霉素喷施,均匀喷施于汉麻叶片,喷施汉麻植株的赤霉素采自上海麦克林生化科技有限公司,赤霉素喷施浓度设置为50mg/L,喷施赤霉素为处理组(CL),喷施水溶液为对照组(CK),喷施溶液100mL直至叶片完全湿润,每组各15个盆栽,每盆8株长势一致的汉麻植株,各3次生物学重复,正常田间栽培管理措施。待喷施赤霉素7d后,选取叶片部位,取材后用无菌水将叶片表面的灰尘及泥土冲洗干净,用吸水纸吸干表面液体,收集后立即储存于离心管中,置于液氮中速冻,并存于-80℃超低温冰箱中,整齐样品进行组学分析。
3.2 代谢物提取与分析
3.2.1 样品的制备
代谢物提取所需提取液为含0.02mg/mL内标的80%甲醇水溶液,内标采用L-2-氯苯丙氨酸。取冷冻干燥样品60mg与500μL提取液混合后在冷冻条件下研磨充分(6min,-10℃,50Hz),研磨结束后对混合液进行超声提取,提取时间为30min,频率为40kHz,温度为5℃。提取后在冷冻条件下静置30min,随后4℃条件下13000g转速离心15min,取上清液上级分析。质控样本(quality control, QC)通过选取赤霉素处理组(CL)与未处理组(CK)样本混合物,在分析进程中,质控样本与分析样品以10:1进行插入分析,通过质控样本检验分析过程的准确性。
3.2.2 样品的色谱质谱分析
分析所用仪器为超高效液相色谱串联傅里叶变换质谱仪。色谱柱采用直径1.8µm,100mm×2.1mm规格的HSST3色谱柱。流动相A为5%乙腈水溶液(含0.1%甲酸),流动相B为乙腈和异丙醇水溶液(含0.1%甲酸)。液相流速及柱温条件为0.4mL/min,40℃。
采用正负离子扫描获取质谱信号,以70~1050m/z范围进行质谱扫描,喷雾电压分别设置为正负3500V,鞘气、辅助气流速分别为50psi、13psi,辅助气加热温度、离子传输温度分别为425℃、325℃,循环碰撞能为20-40-60V。一级、二级质谱分辨率为60000、7500,DDA模式采集数据,质谱仪示值误差、重复性和稳定性选择四种国家有证标准物质(大豆苷元或槲皮素,利血平和人参皂苷Rb1或人参皂苷Rg1,氯霉素)进行校准。
3.2.3 代谢物定量分析
仪器分析结束后,利用Progenesis QI软件对原始数据进行分析,以获得数据矩阵,该矩阵包含保留时间、质荷比及峰强度,利用代谢公共数据库(HMDB)、METLIN数据库及美吉生物公司自建数据库进行匹配MS和MSMS质谱信息,代谢物信息上传美吉云平台进行分析(Ren et al.,2022)。两处理间的代谢物显著差异评判基于OPLS-DA模型,显著差异代谢物评判标准为变量权重值(VIP)>1及P<0.05。差异代谢物的代谢通路通过KEGG数据库进行注释,获得差异代谢通路,并通过R语言及美吉云平台进行筛选分析等。
3.3 蛋白提取及分析
3.3.1 蛋白提取
在样品中加入蛋白提取液进行蛋白提取,处理组与对照组各3次重复,蛋白含量通过BCA法确定,并通过SDS-PAGE进行电泳检测分析,检测6个样品的蛋白浓度是否满足蛋白组学分析(梁文轩等,2023)。
3.3.2 蛋白酶解及肽段脱盐定量
将提取后的蛋白样品通过TEAB法(三乙基碳酸氢铵缓冲液)进行充分溶解,在37℃条件下加入Trypsin酶解过夜,酶解后对肽段进行复溶、脱盐及定量。
3.3.3 样品的色谱质谱分析
液相分析所用仪器为EASY-nLC 1200系统,色谱柱采用75µm×25cm规格的C18色谱柱。流动相A为含0.1%甲酸的2%乙腈溶液,流动相B为含0.1%甲酸的80%乙腈溶液,酶解后的肽以300nL/min的流速进行分离。液相色谱分离后的样品用仪器为timsTOF Pro2质谱仪进行质谱分析,电喷雾电压设置为1.5kV。质谱结束后将原始数据通过MaxQuant version 2.0.3.1软件进行搜库分析,将FDR≤0.01(错误发现率)为肽段鉴定标准。
3.3.4 生物信息学分析
通过美吉云平台对原始数据进行分析,通过R语言确定显著性P值和差异倍数(fold change,FC),差异倍数(fold change>2或<0.5)且P<0.05,分别定义为差异显著上调蛋白及差异显著下调蛋白。差异蛋白的GO注释通过GO数据库进行分析。通过KEGG数据库进行差异蛋白的代谢通路注释,获得差异代谢通路,并通过R语言及美吉云平台进行筛选分析等。
3.4 组学联合分析
代谢组与蛋白组的关联分析是通过基于上海美吉生物医药科技有限公司自建应用程序进行的,将相同分组的差异蛋白及差异代谢物基于R语言整合到KEGG代谢通路上,获得共同参与通路数及进行可视化分析。
作者贡献
高宇、边境、李学海是本研究的实验设计者和实验研究的执行人;李学海、边境、曹焜参与数据整理及论文初稿的写作;李学海、边境、高宇、王晓楠参与部分实验;高宇是项目的负责人,指导实验设计、数据统计、论文写作与修改。全体作者都同意最终的文本。
致谢
本研究由黑龙江省省属科研院所科研业务费项目(CZKYF2023-1-B018)资助。
参考文献
Adesina I., Bhowmik A., Sharma H., and Shahbazi A., 2020, A review onthe current state of knowledge of growing conditions, agronomic soil health practices and utilities of hemp in the United States, Agriculture, 10(4): 129-144.
Bao S.J., Hua C.M., Shen L.S., and Yu H., 2020, New insights into gibberellin signaling in regulating flowering in Arabidopsis, J. Integr.Plant Biol., 62(1): 118-131.
Deng X.M., Shang H., Chen J.J., Wu J., Wang T., Wang Y.Q., Zhu C.S., and Sun W.J., 2022, Metabolomics combined with proteomics provide a novel interpretation of the changes in flavonoid glycosides during white tea processing, Foods., 11(9): 1226-1242.
Dong N.Q, and Lin H.X., 2021, Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions, J. Integr. Plant Biol., 63(1): 180-209.
Du G.H., Zhang H.X., Yang Y., Zhao Y.H., Tang K.L., and Liu F.H., 2022, Effects of gibberellin pre-treatment on seed germination and seedling physiology characteristics in industrial hemp under drought stress condition, Life(Basel), 12(11): 1907-1917.
Gabarin A., Yarmolinsky L., Budovsky A., Khalfin B., and Ben-Shabat S., 2023, Cannabis as a source of approved drugs: a new look at an old problem, Molecules., 28(23): 7686-7707.
Jie H.D., Zhao L., Ma Y.S., Rasheed A., and Jie Y.C., 2023, Integrated transcriptome and metabolome analysis reveal that exogenous gibberellin application regulates lignin synthesis in ramie, Agronomy., 13(6): 1450-1467.
Jing T.T., Xiang Q., Shi Y.F., Liu X.M., and Müller-Xing R., 2024, Depletion of gibberellin signaling up-regulates LBD16 transcription and promotes adventitious root formation in Arabidopsis leaf explants, Int. J. Mol. Sci., 25(24): 13340-13362.
Li K.L., Yu R.B., Fan L.M., Wei N., Chen H.D., and Deng X.W., 2016, DELLA-mediated PIF degradation contributes to coordination of light and gibberellin signalling in Arabidopsis, Nat. Commun., 7: 11868-11879.
Liu S.A., Meng Z.L., Zhang H.Y., Chu Y.X., Qiu Y.Y., Jin B., and WangL., 2022, Identification and characterization of thirteen gene families involved in flavonoid biosynthesis in Ginkgo biloba, Ind. Crops Prod., 188(1):115576-115591.
Min C.W., Hyeon H., Gupta R., Park J., Cheon Y.E., Lee G.H., Jang J.W., Ryu H.W., Lee B.W., Park S.U., Kim Y., Kim J.K., and Kim S.T., 2020, Integrated proteomics and metabolomics analysis highlights correlative metabolite-protein networks in soybean seeds subjected to warm-water soaking, J. Agric. Food Chem., 68(30): 8057-8067.
Ren Y., Yu G., Shi C.P., Liu L.M., Guo Q., Han C., Zhang D., Zhang L., Liu B.X., Gao H., Zeng J., Zhou Y., Qiu Y.H., Wei J., Luo Y.C., Zhu F.J., Li X.J., Wu Q., Li B., Fu W.Y., Tong Y.L., Meng J., Fang Y.H., Dong J., Feng Y.T., Xie S.C., Yang Q.Q., Yang H., Wang Y., Zhang J.B., Gu H.D., Xuan H.D., Zou G.Q., Luo C., Huang L., Yang B., Dong Y.C., Zhao J.H., Han J.C., Zhang X.L., and Huang H.S., 2022, Majorbio cloud: a one-stop, comprehensive bioinformatic platform for multiomics analyses, iMeta., 1(2): e12- e19.
Rizza A., and Jones A.M., 2019, The makings of a gradient: spatiotemporal distribution of gibberellins in plant development, Curr. Opin. Plant Biol., 47: 9-15.
Tang L.Q., Xu H.Y., Liu Y.X., Wang Y.F., Wang H.M., Li Z.Y., Liu X.X., Shu Y.Z., Li G., Liu W.N., Ying J.Z., Tong X H., Yao J.L., Xiao W.F., Tang S.Q., Ni S., and Zhang J., 2021, OsABF1 represses gibberellin biosynthesis to regulate plant height and seed germination in rice (Oryza sativa L.), Int. J. Mol. Sci., 22(22): 12220-12235.
Xu M.W., Li H.W., Luo H.Y., Liu J.Y., Li K.Q., Li Q.Q., Yang N., and Xu D.L., 2024, Unveiling the role of β-glucosidase genes in Bletillastriata's secondary metabolism: a genome-wide analysis. Int. J. Mol. Sci., 25(23):.13191-13942.
Yao Q.Q., Feng Y., Wang J.J., Zhang Y.S., Yi F., Li Z.H., and Zhang M.C. 2024, Integrated metabolome and transcriptome analysis of gibberellins mediated the circadian rhythm of leaf elongation by regulatinglignin synthesis in maize, Int. J. Mol. Sci., 25(5): 2705- 2726.
Zhang H.D., Wang Z.J., Feng Y.A., Cui Q., and Song X.J., 2019, Phytohormones as stimulators to improve arachidonic acid biosynthesis in Mortierella alpina, Enzyme Microb Technol., 131: 109381-109388.
Zou M.M., Zhang D.D., Liu Y.X., Chen Z.P., Xu T.Y., Ma Z.W., Li J.Q.,Zhang W.J., Huang Z.R., and Pan X.Y., 2024, Integrative proteome and metabolome unveil the central role of IAA alteration in axillary bud development following topping in tobacco, Sci Rep., 14(1): 15309-15323.
范兆宇,张蕾,2024,赤霉素调节水稻株高分子机制的研究进展,生命科学研究,1-11.虎淘淘,王玲玲,张黎,唐燕,严瑞,2024,外源赤霉素对盐碱胁迫下园林小菊生长?生理及光合特性的影响,江苏农业科学,52(18):169-176.李洁,姚晓华,2019,多组学关联分析作物耐逆境胁迫研究进展,广东农业科学,46(8):22-28.
梁文轩,王月萍,陈升杰,李敏诗,韩儒,周玉亮,2023,基于4Dlabel-free技术的水稻成熟种子蛋白质组学研究,华南农业大学学报,44(5):742-749.
苏芳芳,杨光,郑玉光,2022,工业大麻种植及育种现状研究,中国中药杂志,47(5):1190-1195.
张晓英,禚照卿,李秀艳,高玉平,刘涛,刘春菊,2018,赤霉素在烤烟上的应用效果研究,现代农业科技,(23):150-151.
邹小智,蒲苗艳,罗佳,郑孟雨,何禹滔,胡尚连,龙治坚,2024,赤霉素对芦苇生长发育和茎杆理化特性的影响,分子植物育种,1-10.
文章摘自:李学海,边境,曹焜,王晓楠,张晓艳,高宇.赤霉素处理下汉麻的代谢组学与蛋白质组学研究[J/OL].分子植物育种.https://link.cnki.net/urlid/46.1068.S.20250331.1526.004。