摘 要: 木葡聚糖内转糖苷酶/水解酶(Xyloglucan endotransglycosylases/hydrolases,XTH)参与纤维素/木葡聚糖交联构建和重塑,在植物细胞壁的可伸展性方面有非常重要的作用。但在工业大麻(Cannabis sativa)中还未有关于该酶的报道。为系统鉴定工业大麻XTH家族成员,本研究通过生物信息学手段,鉴定出10个工业大麻XTH基因(CsXTH),分别命名为CsXTH1~CsXTH10,分析了其理化性质、系统进化和不同生长时期表达模式等。结果表明,XTH家族成员相对分子量在31.14~63.64kD之间。亚细胞定位预测结果显示,10个家族成员均定位在细胞壁上,CsXTH3和CsXTH8也能定位在细胞质中,均属于亲水性蛋白。CsXTH启动子区存在较多光响应、激素响应和逆境响应相关的顺式作用元件,表明CsXTH可能参与植物生长发育及逆境胁迫防御等多种生物学过程。CsXTH基因的表达在不同生长时期存在特异性,CsXTH3,CsXTH5在幼苗期表达量最高,CsXTH7在工艺成熟期表达量最高。上述结果为研究CsXTH家族基因在工业大麻纤维发育中的功能提供了参考依据。
关键词: 工业大麻;XTH基因家族;纤维发育;生物信息学分析
木葡聚糖(Xyloglucan,XYG)是大多数植物初生细胞壁中含量最多的半纤维素,其合成需要一个糖苷键合酶与多种糖基转移酶,木葡聚糖内转糖苷酶/水解酶(Xyloglucan endotransglycosylases/hydrolases,XTH)作为糖苷水解酶16(GH16)家族中的一种关键修饰酶,它可以催化XYG分子的裂解和聚合从而修饰细胞壁的交联构建复合结构[1-2]。XTH具有两种催化功能:一是通过木葡聚糖内转水解酶(Xyloglucan endo-transglycosylase,XEH)催化XYG水解,二是通过木葡聚糖内转葡萄糖苷酶(Xyloglucan endo-transglycosylase,XET)催化XYG链的切割与重新连接[3]。根据系统进化关系,一般XTH基因家族成员被分成3个主要类群,分别为I类、II类和III类,其中III类成员进一步又可划分成IIIA和IIIB,除3个主要类群外在物种中还存在一个小祖先类群(Ancestral group)[4]。研究表明,IIIA组的XTH基因主要有XEH活性,而I、II和IIIB组的XTH基因则有XET活性[5]。XTH基因家族成员已在许多物种中被发现,例如拟南芥(Arabidopsis thaliana)中有33个成员[6],烟草(Nicotiana tabacum)中有56个成员[7],水稻(Oryza sativa)中有29个成员[8],苎麻(Boehmeria nivea)中有19个成员[9],陆地棉(Gossypium hirsutum)中有72个成员[10],杨树(Populus trichocarpa)中有43个成员[11],鹅掌楸(Liriodendron chinense)中有27个成员[12],桂花(Osmanthus fragrans)中有38个成员[13],龙眼(Dimocarpus longan)中有25个成员[14],花生(Arachis hypogaea)中有58个成员[15],大豆(Glycine max)中有61个成员[16],桑树(Morus alba)中有22个成员[17],甘薯(Ipomoea batatas)中有36个成员[18]。在植物生长发育过程中XTH基因同样发挥重要作用。例如,在拟南芥中至少有10个基因促进细胞伸长、扩增和细胞壁形成[6]。有研究表明棉花细胞伸长阶段XTH活性越高,纤维越长[19]。此外该基因在抵御非生物胁迫方面同样发挥作用。例如,在滇水金凤(Impatiens uliginosa)中IuXTH2基因主要在铜胁迫前期发挥作用[20]。金鱼草(Antirrhinum majus)AmXTH23和AmXTH33可能同时在抗核盘菌(Sclerotinia sclerotiorum)中发挥作用[21]。
工业大麻(Cannabis sativa)又称线麻、火麻,是原产于中亚地区的一年生草本植物,在我国具有悠久的栽培历史[22-23],自古以来就有使用工业大麻纤维造纸、纺织等的记载[24]。大麻富含植物纤维,其韧皮纤维是制造高品质纺织品的优质原料,由大麻纤维纺织的物品具有较好的吸湿排汗性、透气性,具有重要的经济价值[25-26]。然而目前还未有人对工业大麻中XTH基因(CsXTH)家族进行研究。本研究通过生物信息学手段对CsXTH家族成员进行鉴定,构建系统发育树,并进行结构特征、蛋白亚细胞定位及顺式作用元件等预测分析,以期为研究CsXTH的功能提供新的认识,为进一步探索工业大麻纤维发育奠定基础。
1 材料与方法
1.1 工业大麻 XTH 家族成员基因获取
通过NCBI网站(http://www.ncbi.nlm.nih.gov/)下载工业大麻(Cannabis sativa,BioProject:PRJEB29284;Assemblynumber:GCA_900626175.2)、拟南芥(Arabidopsis thaliana,Assemblynumber:GCA_000001735.1)、棉花(Gossypium hirsutum,Assemblynumber:GCA_000327365.1)的全基因组、蛋白组以及注释文件。以拟南芥AtXTH蛋白作为参考,在NCBI网站进行BLAST比对,进而获得CsXTH家族候选基因蛋白序列。从Pfam数据库(http://pfam.xfam.org/)[27]下载XTH基因XET_C(PF06955)和Glyco_hydro_16(PF00722)两个保守结构域HMM文件[28],通过Hmmersearch软件做二次比对(E-value<1E5)。利用CD Search结构域工具对两次获得的CsXTH家族候选基因进行验证,筛选比对检索结果留下同时包含XET_C和Glyco_hydro_16保守结构域的蛋白序列,手动去冗余后得到10个工业大麻CsXTH家族成员并命名。
1.2 工业大麻 XTH 基因家族生物信息学分析
利用在线网站及软件进行基因家族预测:利用ExPASy在线网站进行蛋白理化性质预测(https://web.expasy.org/protparam/)[29]、利用Plant-mPLoc在线网站进行蛋白亚细胞定位预测(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)[30]、利用MEME在线网站进行蛋白保守基序分析(http://meme-suite.org/tools/meme)[31];使用TBtools软件对每条基因序列的外显子及内含子、保守结构域、motif进行分析和可视化呈现[32];通过MEGA 11.0软件中的邻接法构建拟南芥、棉花和工业大麻系统发育进化树[33];利用TBtools软件分析工业大麻、拟南芥及棉花3种作物的共线性关系并进行可视化呈现;通过Plant Care网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测基因启动子区的顺式作用元件,将结果进行可视化构图,利用在线软件SWISSMODEL(https://swissmodel.expasy.org/interactive)、SOPMA(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html#opennewwindow)、TMHMMServerv2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)进行蛋白预测[34]。
1.3 CsXTH 基因表达模式分析
工业大麻不同发育时期的转录组数据由本研究室测序获得(PRJNA1191537)。实验材料为本单位自主选育品种‘龙大麻3号’,选取幼苗期(I)、快速生长期(II)、现蕾期(III)、工艺成熟期(IV,包含IV♀和IV♂)4个工业大麻纤维发育主要时期为取样节点,每个时期取植株地上部主茎中间上下2cm部位,共收集15个样本包含3个生物学重复进行RNA-seq测序,根据转录组数据计算基因表达量并绘制热图。
2 结果与分析
2.1 工业大麻 XTH 基因家族成员蛋白理化性质及亚细胞定位分析
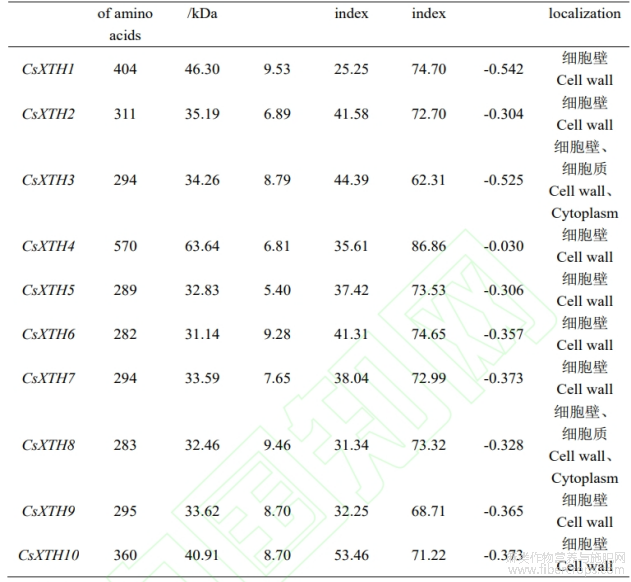
全基因组筛选鉴定后共得到10条工业大麻基因序列作为CsXTH家族成员进行研究,分别命名为CsXTH1~CsXTH10。CsXTH家族成员氨基酸数量在282~570之间,分子量在31.14~63.64kDa之间,不稳定系数在25.25~53.46之间,CsXTH基因家族中大多数为稳定蛋白。除CsXTH2、CsXTH4、CsXTH5这3个蛋白(33.3%)理论等电点(pI)在7以下,大多数CsXTH蛋白(66.7%)pI均在7以上,因此CsXTH基因家族为碱性蛋白。CsXTH家族成员疏水性指数在—0.030~—0.542之间,该家族成员为亲水性蛋白。工业大麻中所有XTH均定位在细胞壁上,其中CsXTH3和CsXTH8也能定位在细胞质中(表1)。
表1 工业大麻XTH家族蛋白理化特性
2.2 工业大麻 XTH 基因家族系统进化分析
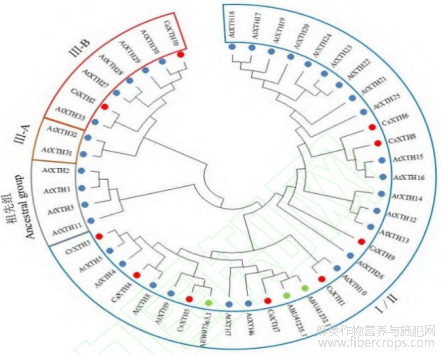
为进一步了解工业大麻与拟南芥和棉花在XTH基因上的进化关系,将10个工业大麻CsXTH蛋白、33个拟南芥AtXTH蛋白(AtXTH1~AtXTH33)和3个棉花XTH蛋白(AEW07363.1、ABU41235.1、ABU41232.1)导入MEGA11软件构建系统发育进化树。结果如图1所示,构建的系统发育树聚为3个明显分支,包含4个亚家族(Ancestral group, Ⅰ/Ⅱ, Ⅲ-A, Ⅲ-B),其中工业大麻10个CsXTH成员分布在Ⅲ-B亚家族2个(CsXTH2、CsXTH10),以及Ⅰ/Ⅱ亚家族8个。3个物种同源性较高且存在较近的亲缘关系,表明CsXTH基因在进化上相对保守。
图1 CsXTH基因家族系统发育分析
注:红色-工业大麻,蓝色-拟南芥,绿色-棉花
2.3 工业大麻 XTH 基因结构及 Motif 分析
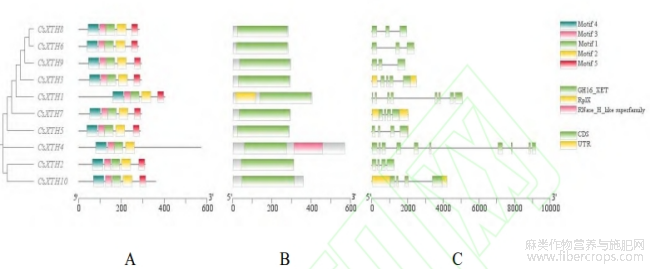
通过TBtools软件呈现CsXTH基因家族成员的Motif、结构域及基因结构(图2),结果显示,除CsXTH4(无Motif5)外,其余基因均包含Motif1,Motif2,Motif3及Motif4,表明这4个基序在CsXTH蛋白序列中分布最广、保守程度最高,每个CsXTH蛋白均含有4~5个保守基序,Motif分布的位置与数量基本相同(图2A),表明CsXTH家族成员功能单位和结构域基本相似。所有CsXTH蛋白均包含GH16_XET保守结构域(图2B),其中CsXTH1特异含有RplX结构域,CsXTH4特异含有RNase_H_like superfamily结构域。
为了进一步解析CsXTH基因的结构多样性,对CsXTH中的内含子、外显子进行了研究(图2C),结果显示CsXTH中至少有2个以上内含子,3个以上外显子,其中CsXTH6,CsXTH8,CsXTH9有最少的外显子和内含子数量,其余CsXTH基因外显子及内含子数量均高于3个,且内含子和外显子分布结构紧密相连,高度保守。
图2 CsXTH 家族功能结构域
注:A-保守基序,B-保守结构域,C-基因结构
2.4 工业大麻 XTH 基因家族染色体定位与共线性分析
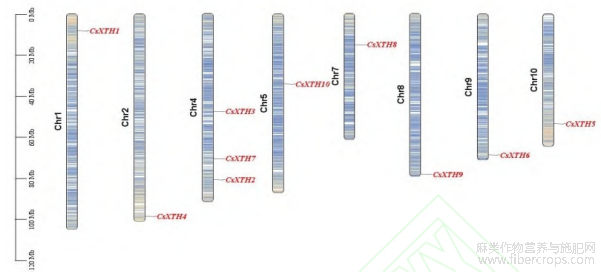
根据工业大麻基因组数据对CsXTH染色体定位分析,结果如图3所示,10个家族成员共在8条染色体上有分布,其中Chr4染色体上的成员最多(3个),其余染色体上各有1个基因分布。
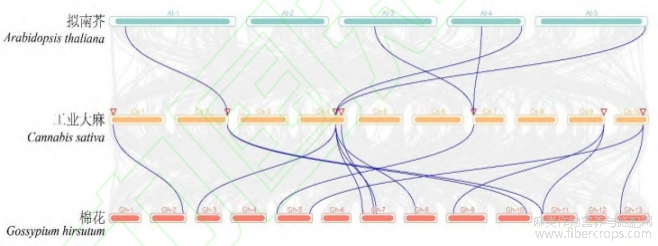
为了阐明不同物种之间的进化关系,以及更深入的探究CsXTH基因的结构和功能之间的相关性,对工业大麻、拟南芥及棉花进行共线性分析(图4)。彩色线代表CsXTH基因与其他物种中的基因具有共线性,其中工业大麻与拟南芥存在5个直系同源基因对,工业大麻与棉花存在13个直系同源基因对,表明工业大麻和棉花的XTH基因家族具有更近的同源进化关系。
图3 CsXTH 基因染色体分布情况
图4 CsXTH 共线性分析
2.5 蛋白二级结构及信号肽分析
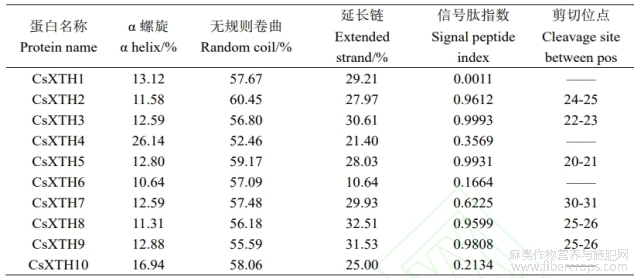
CsXTH家族成员蛋白二级结构预测结果表明,10个CsXTH蛋白二级结构中无规则卷曲(Random coil)占比为52.46%~60.45%,除CsXTH4、CsXTH6外,α螺旋占比均少于延长链占比。CsXTH1,CsXTH4,CsXTH6,CsXTH10共4个蛋白无剪切位点。信号肽预测结果显示(图5B)共6个(CsXTH2,CsXTH3,CsXTH5,CsXTH7,CsXTH8,CsXTH9)成员有信号肽,信号肽指数均大于0.5,其余4个成员无信号肽(表2)。
表2 CsXTH 蛋白的二级结构和信号肽预测
图5 CsXTH 蛋白的二级结构(A)和信号肽预测(B)
2.6 蛋白跨膜结构域与蛋白三级结构预测
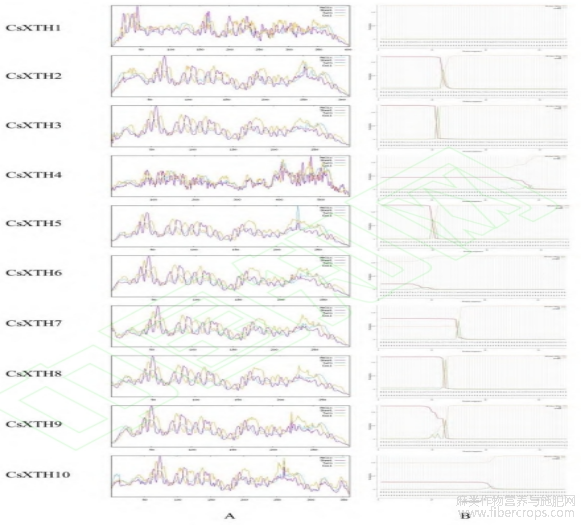
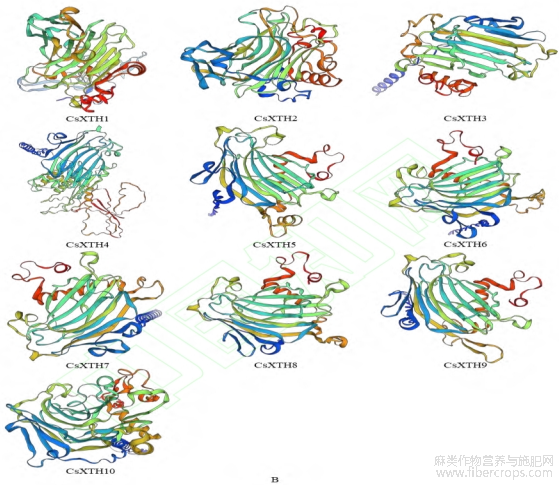
利用TMHMM2.0预测CsXTH蛋白的跨膜结构域,结果如图6A所示,CsXTH7,CsXTH8,CsXTH9和CsXTH10含1个完整的跨膜结构域,且含有相同数目的氨基酸。该家族10个成员结构主要包含螺旋和无规则卷曲(图6B),与二级结构结果相一致,这可进一步说明CsXTH基因家族具有高度保守性。
图6 CsXTH蛋白跨膜结构预测(A)和三级结构预测(B)
2.7 工业大麻 XTH 基因启动子顺式作用元件预测
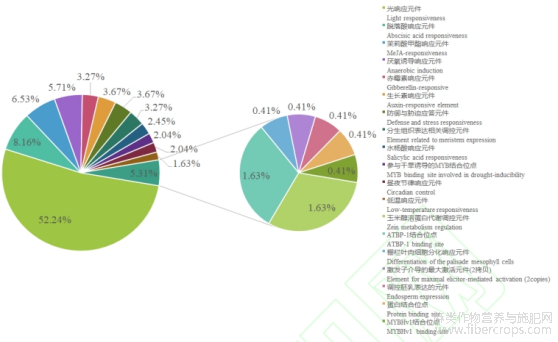
在植物响应胁迫方面转录因子有非常重要的作用,其中的各种作用元件可以调节基因表达。为了探索10个CsXTH基因在工业大麻中的功能,对CsXTH基因转录起始上游2000bp的作用元件分析预测,结果如图7所示,CsXTH1,CsXTH4,CsXTH6,CsXTH7及CsXTH10启动子含有干旱诱导的MYB结合位点,CsXTH1,CsXTH5,CsXTH6,CsXTH8及CsXTH9启动子均含有分生组织表达调控顺式作用元件,CsXTH4启动子特异含有栅栏叶肉细胞分化作用元件与蛋白结合位点,CsXTH1启动子特异含有调控胚乳表达的元件,CsXTH10启动子特异含有MYBHv1结合位点。
所有CsXTH总共包括245个顺式元件(图8)。它们参与了19个非生物胁迫,包括光响应、生长素响应、防御和胁迫响应性和低温响应等。其中光响应元件占所有顺式元件的52.24%,其数量远远超过其他元件,其次是脱落酸响应元件,占所有顺式元件的8.16%。这些结果可以作为未来预测基因响应胁迫方面功能的理论基础。
图7 CsXTH 顺式作用元件分析
图8 CsXTH 顺式作用元件数量分析
2.8 CsXTH 基因表达模式分析
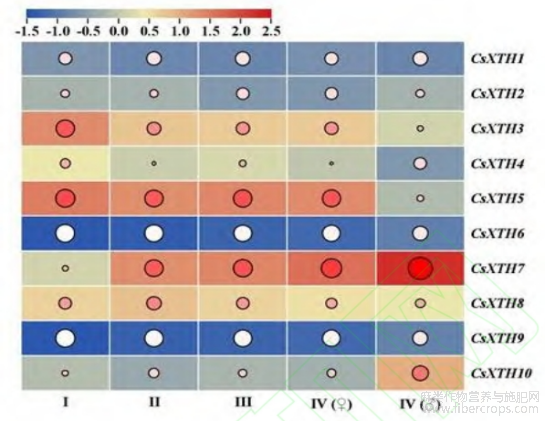
为了探究CsXTH基因在工业大麻不同发育时期的表达模式,对工业大麻幼苗期(I)、快速生长期(II)、现蕾期(III)、工艺成熟期雌(IV♀)和工艺成熟期雄(IV♂)的转录组数据分析。结果表明同一时期不同基因表达存在特异性,同时存在雌雄差异表达。在幼苗期CsXTH3和CsXTH5表达量最高;在快速生长期、现蕾期及工艺成熟期(IV♀)CsXTH5和CsXTH7表达量最高;在工艺成熟期(IV♂)CsXTH7和CsXTH10表达量最高。同一基因不同发育时期表达模式也存在不同,CsXTH3和CsXTH5在发育前期表达量较高,随发育时期推进,表达量逐渐降低;而CsXTH7表达模式相反,在发育前期表达量较低,随发育时期推进,表达量逐渐升高。
图 9 CsXTH 基因表达模式分析
注:I表示幼苗期、II表示快速生长期、III表示现蕾期、IV(♀)表示工艺成熟期(雌)、IV(♂)表示工艺成熟期(雄)
3 讨论
XTH作为重要的细胞壁修饰酶,通过木葡聚糖的交联、构建和重组在细胞壁重塑中发挥重要作用。本研究在工业大麻全基因组中共筛选鉴定出10个CsXTH基因家族成员,与其他植物相比,从工业大麻中鉴定出的XTH基因数量少于拟南芥(33个AtXTH)[6]等,基因复制事件是基因功能多样化的来源,有利于基因家族成员数量的扩大,CsXTH基因数量与其他植物的差异可能与工业大麻的重复事件较少有关[14]。10个成员蛋白Motif位置和Motif数目基本一致,各成员之间蛋白长度及分子量方面差异较小,蛋白亚细胞定位分析显示均定位于细胞壁,与在荔枝(Litchi chinensis)[35]、桃(Prunus persica)[36]等中的研究结果一致。同时XTH参与调控XYG的水解和转移,与已有研究结果中XTHs的功能一致[4]。在有保守基序保障的前提下进一步说明CsXTH蛋白是高度保守蛋白。
保守结构域验证是基因家族研究的重要内容,通过CD Search比对和Motif分析,10个成员均含有Glyco_hydro_16和XET_C结构,结合进化分析结果发现,XTH基因家族包含4个亚家族(Ancestral group, Ⅰ/Ⅱ, Ⅲ-A, Ⅲ-B),CsXTH在Ⅰ/Ⅱ亚家族成员最多,与前人研究结果类似[36]。结合与拟南芥构建的系统发育进化树分析,聚类关系越近,说明基因越可能具有相似功能[37]。因此CsXTH基因可能与各亚家族内拟南芥已知的XTH基因功能相似。CsXTH1与拟南芥的AtXTH10聚在一起,AtXTH10基因过量表达可以促进根细胞生长,CsXTH1在基因功能上可能影响植株根生长发育[38]。CsXTH6和CsXTH8与AtXTH15聚在一起,XET活性显著下降的同时伴随拟南芥根部AtXTH15基因表达下调,CsXTH6和CsXTH8在半纤维素合成及其调控中可能起重要作用[39]。
本研究在CsXTH的启动子序列中鉴定出多个核心启动子元件,这些元件分别参与胁迫响应(干旱、低温、防御和胁迫)、激素响应(脱落酸、水杨酸、茉莉酸甲酯、赤霉素和生长素)、光响应和生长发育等过程,此外还特异存在栅栏叶肉细胞分化响应元件及调控胚乳表达的元件等,这些功能元件解释了为什么XTH基因家族可能通过不同顺式作用元件的调控在生长和抵御外界胁迫中发挥重要作用。多项研究表明,植物XTH蛋白在植物纤维生长发育和抗逆性中起着重要作用[40-43]。在CsXTH基因的启动子区域中发现了许多顺式元件,这表明工业大麻中的XTH基因具有适应植物中各种修饰的能力,特别是对几种激素和许多胁迫响应元件(脱落酸、茉莉酸甲酯、厌氧诱导)的响应能力。
基因的表达模式与基因功能关系密切,本研究通过对工业大麻生长发育不同时期进行转录组测序,转录组测序表明CsXTH3,CsXTH5和CsXTH7在工业大麻发育中发挥主要作用,CsXTH3、CsXTH5在幼苗期表达量最高,CsXTH7在工艺成熟期表达量最高。有研究称不同纤维发育时期高表达的基因有不同作用,如纤维发育起始期高表达基因可能参与表皮细胞突起;纤维发育伸长期高表达基因可能促进纤维伸长;纤维发育次生壁加厚期高表达基因可能影响纤维强度[10]。本研究中CsXTH3、CsXTH5在幼苗期高表达可能与表皮细胞形成有关,CsXTH7在工艺成熟期高表达可能与纤维强度有关,目前对工业大麻中XTH基因功能研究有限,还需实验进一步验证,本研究结果为CsXTH基因在工业大麻纤维生长发育中的功能研究提供思路和理论依据。
4 结论
通过对工业大麻XTH家族的全基因组鉴定,得到了10个家族成员,划分为2个亚家族,均定位于细胞壁,Motif位置和数目基本一致,蛋白二、三级结构均含有较多卷曲与螺旋结构,CsXTH蛋白高度保守,启动子区除大量光响应、胁迫响应与激素响应元件外,同时存在分生组织表达等顺式元件。同一时期不同基因表达存在特异性,同时存在雌雄差异表达。在幼苗期CsXTH3和CsXTH5表达量最高;在生长后期CsXTH5和CsXTH7表达量最高。同一基因不同发育时期表达模式也存在不同,CsXTH3和CsXTH5在发育前期表达量较高,而CsXTH7表达模式相反。研究结果为CsXTH家族基因潜在功能研究提供参考。
参考文献
[1] SONG L,VALLIYODAN B,PRINCE S,et al. Characterization of the XTH gene family: new insight to the roles in soybean flooding tolerance[J]. International Journal of Molecular Sciences,2018,19(9):2705
[2] 杨亮.XET/XTH功能及基因家族表达模式的研究进展[J].吉林农业,2011(3):65-67
[3] EKLÖF J M,BRUMER H. The XTH gene family: an update on enzyme Structure, function, and phylogeny in xyloglucan remodeling[J]. Plant Physiology,2010,153(2):456-466
[4] ZHU X F,SHI Y Z,LEI G J,et al. XTH31, encoding an in vitro XEH/XET-active enzyme, regulates aluminum sensitivity by modulating in vivoXET action, cell wall xyloglucan content, and aluminum binding capacity in Arabidopsis[J]. The Plant Cell,2012,24(11):4731-4747
[5] YANG Z Y,ZHANG R,ZHOU Z C. The XTH gene family in Schima superba:genome-wide identification, expression profiles, and functional interaction network analysis[J]. Frontiers in Plant Science,2022,13:911761
[6] YOKOYAMAR,NISHITANI K. A comprehensive expression analysis of allmembers of a gene family encoding cell-wall enzymes allowed us to predict Cis-regulatory regions involved in cell-wall construction in specific organs of Arabidopsis[J]. Plant & Cell Physiology,2001,42(10):1025-1033
[7] WANG M,XU Z C,DING A M,et al. Genome-wide identification and expression profiling analysis of the xyloglucan endotransglucosylase/hydrolase gene family in tobacco (Nicotiana tabacum L.)[J]. Genes,2018,9(6):273
[8] YOKOYAMA R,ROSE J K C,NISHITANI K. A surprising diversity and abundance of xyloglucan endotransglucosylase/hydrolases in rice. Classification and expression analysis[J]. Plant Physiology,2004,134(3):1088-1099
[9] MAY S,JIE H D,ZHAO L,et al. Identification of the xyloglucan endotransglycosylase/hydrolase (XTH) gene family members expressed in Boehmeria nivea in response to cadmium stress[J]. International Journal of Molecular Sciences,2022,23(24):16104
[10] 安亚茹,杨君,刘正文,等.陆地棉XTH基因家族全基因组鉴定及在纤维发育过程的表达分析[J].植物遗传资源学报,2017,18(6):1179-1192
[11] CHENG Z H,ZHANG X M,YAO W J,et al. Genome-wide identification and expression analysis of the xyloglucan endotransglucosylase/hydrolase gene family in poplar[J]. BMC Genomics,2021,22(1):804
[12] WU J P,ZONG Y X,TU Z H,et al. Genome-wide identification of XTH genes in Liriodendron chinense and functional characterization of LcXTH21[J]. Frontiers in Plant Science,2022,13:1014339
[13] YANG Y,MIAO Y F,ZHONG S W,et al. Genome-wide identification and expression analysis of XTH gene family during flower-opening stages in Osmanthus fragrans[J]. Plants,2022,11(8):1015
[14] MA X W,CHEN Y,LIU M Y,et al. Genome-wide analysis of the XTH gene family and functional analysis of DlXTH23.5/25 during early longan somatic embryogenesis[J]. Frontiers in Plant Science,2022,13:1043464
[15] ZHU J Q,TANG G Y,XU P L,et al. Genome-wide identification of xyloglucan endotransglucosylase/hydrolase gene family members in peanut and their expression profiles during seed germination[J]. PeerJ,2022,10:e13428
[16] 张亚楠,王婷,欧斯艳,等.大豆响应低磷胁迫的XTH基因鉴定及XTH38调节根系生长研究[J].植物营养与肥料学报,2022,28(7):1167-1181
[17] DANSO B,ACKAH M,JIN X,et al. Genome-wide analysis of the xyloglucan endotransglucosylase/hydrolase (XTH) gene family: expression pattern during magnesium stress treatment in the mulberry plant (Morus alba L.) leaves[J]. Plants,2024,13(6):902
[18] ZHANG J Z,HE P W,XU X M,et al. Genome-wide identification and expression analysis of the xyloglucan endotransglucosylase/hydrolase gene family in sweet potato [Ipomoea batatas (L.) Lam][J]. International Journal of Molecular Sciences,2023,24(1):775
[19] SHAO M Y,WANG X D,NI M,et al. Regulation of cotton fiber elongation by xyloglucan endotransglycosylase/hydrolase genes[J]. Genetics and Molecular Research,2011,10(4):3771-3782
[20] 梁光容,谭弋,马慧,等.滇水金凤耐铜相关基因XTH和CSL克隆及表达分析[J].分子植物育种,2024:1-9
[21] 赵晗茜,宋佳怡,杨洁,等.金鱼草XTH家族基因鉴定及抗核盘菌和雄蕊瓣化相关基因筛选[J].植物学报,2024,59(2):188-203
[22] 陈晗,徐洪国,王志刚,等.大麻PEBP基因家族鉴定及生物信息学分析[J].福建农业学报,2022,37(8):1016-1024
[23] 隋月,张利国,房郁妍,等.基因家族鉴定技术在大麻中研究现状[J].分子植物育种,2023:1-9
[24] 黄素云,黄小琴,刘圆圆.工业大麻FLA基因家族的全基因组鉴定及生物信息学分析[J].分子植物育种,2023,21(13):4247-4255
[25] 秦振芬,孟祥霄,陈伟强,等.工业大麻TCP基因家族的鉴定及表达分析[J].中草药,2023,54(23):7806-7814
[26] 蔡晓雪,王思凡,米要磊,等.工业大麻PP2C基因家族成员鉴定及表达分析[J].中国实验方剂学杂志,2022,28(19):162-172
[27] FINN R D,COGGILL P,EBERHARDT R Y,et al. The pfam protein families database: towards a more sustainable future[J]. Nucleic Acids Research,2016,44(D1):D279-D285
[28] WU D,LIU A Q,QU X Y,et al. Genome-wide identification, and phylogenetic and expression profiling analyses, of XTH gene families in Brassica rapa L. and Brassica oleracea L.[J]. BMC Genomics,2020,21(1):782
[29] WILKINS M R,GASTEIGER E,BAIROCH A,et al. protein identification and analysis tools in the expasy server[M]// 2-D proteome analysis protocols. New Jersey: Humana Press,2003:531-552
[30] CHOU K C,SHEN H B. Cell-PLoc: a package of Web servers for predicting subcellular localization of proteins in various organisms[J]. Nature Protocols,2008,3(2):153-162
[31] BAILEY T L,JOHNSON J,GRANT C E,et al. The MEME suite[J]. Nucleic Acids Research,2015,43(W1):W39-W49
[32] CHEN C J,WU Y,LI J W,et al. TBtools-II: A “one for all, all for one” bioinformatics platform for biological big-data mining[J]. Molecular Plant,2023,16(11):1733-1742
[33] TAMURA K,STECHER G,KUMAR S. MEGA11: molecular evolutionary genetics analysis version 11[J]. Molecular Biology and Evolution,2021,38(7):3022-3027
[34] 郭蓉,张庆滢,木农布,等.大麻CesA基因家族的鉴定及生物信息学分析[J].分子植物育种,2022:1-16
[35] 董晨,魏永赞,王弋,等.基于转录组的荔枝XTH家族基因的鉴定及分析[J].分子植物育种,2019,17(12):3865-3873
[36] 郭绍雷,许建兰,王晓俊,等.桃XTH家族基因鉴定及其在桃果实贮藏过程中的表达特性[J].中国农业科学,2022,55(23):4702-4716
[37] 杜洋,张智韦,陆爽,等.菊苣TCP基因家族鉴定与分析[J].草地学报,2024,32(8):2428-2439
[38] 吕月庆.植物XTH基因家族的分子进化研究和拟南芥中AtXTH10基因功能的初步分析[D].镇江:江苏大学,2017:48
[39] 朱晓芳.拟南芥细胞壁半纤维素结合铝的机制及其调控[D].杭州:浙江大学,2014:35
[40] LEE J,BURNS T H,LIGHT G,et al. Xyloglucan endotransglycosylase/hydrolase genes in cotton and their role in fiber elongation[J]. Planta,2010,232(5):1191-1205
[41] 付曼曼.西藏野生大麦耐旱相关基因HvXTH1的克隆与功能鉴定[D].杭州:浙江大学,2019:54
[42] 孟涛,马艳红,武小娟,等.马铃薯StXTH9基因生物信息学及其干旱胁迫下表达分析[J].分子植物育种,2024:1-14
[43] 贾西贝,李效雄,杜雨,等.黑果枸杞XTH转录因子家族鉴定与生物信息学分析[J].草地学报,2023,31(10):2916-2924
文章摘自:隋月,闫博巍,张元野,房郁妍,郑楠,张明,张利国.工业大麻XTH基因家族鉴定及不同发育时期表达模式分析[J/OL].草地学报.https://link.cnki.net/urlid/11.3362.S.20250317.1812.002。