摘 要:干旱是影响植物生长发育的主要逆境之一。本研究探讨了苎麻(Boehmeria nivea L.)BnGCL1基因在干旱胁迫响应中的功能机制。结果表明,BnGCL1基因序列最大开放阅读框(ORF)为1581bp,编码526个氨基酸,蛋白的等电点为5.79,分子量为59,123.98Da,脂肪系数为78.78,稳定系数为37.42,属于稳定蛋白。BnGCL1基因在苎麻的根、茎、叶中均有表达,受干旱胁迫诱导表达。在干旱条件下,过表达BnGCL1植株的根长、鲜重、叶绿素a、叶绿素b均显著高于野生型,同时抗氧化酶如APX和γ-GCL活性以及渗透调节相关物质如GSSG、Pro等的代谢水平均发生显著变化。BnGCL1的过表达显著上调AtGST1、AtGST11、AtNCED3和AtWRKY40等干旱应答相关基因的表达水平,表明BnGCL1通过调控抗氧化系统和干旱响应信号通路参与植物的抗旱应答。通过VIGS技术验证了BnGCL1基因的沉默能够降低苎麻的耐旱性,表明其在苎麻干旱响应中的作用。本研究揭示了BnGCL1基因在干旱胁迫中的重要作用,为苎麻的抗旱分子机制研究和抗旱品种培育提供了理论依据。
关键词:苎麻;BnGCL1;干旱胁迫;抗氧化酶;分子机制
植物的生长发育会受到环境变化的影响,干旱、洪涝、极端温度、土壤或水源污染等均会对植物生长、发育、代谢及生理功能造成不利影响,进而影响到植物的产量和品质[1],甚至可能导致死亡。植物通过复杂的信号调控网络和防御机制,协调应对环境胁迫,从而维持正常生长与生存[2]。干旱胁迫通过抑制植物生长、降低光合作用效率、诱发代谢紊乱等途径,对植物的正常发育和存活构成严重威胁[3]。植物通常通过调整根系结构、积累渗透调节物质及增强抗氧化能力等方式来缓解干旱胁迫的影响[4]。
苎麻(Boehmeria nivea L.)是中国特有的多年生韧皮纤维作物,具有根系发达、生物量大、种质资源丰富等特点[5-6]。种植苎麻,不仅能显著降低水土流失治理成本,还兼具生态与经济效益,是南方坡耕地水土保持的重要作物之一[7]。苎麻具有较强的抗旱能力,但干旱环境仍对其生长发育产生显著影响,使苎麻植株产生机械损伤,进而降低苎麻的品质和产量,甚至可能造成株体死亡。
谷氨酸半胱氨酸连接酶(glutamate-cysteine ligase, GCL)又称为γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase, γ-GCS),该酶催化并调节谷胱甘肽(glutathione, GSH)的生物合成。GSH作为作物清除活性氧的重要酶类,在保护细胞免受氧化损伤、维持氧化还原稳态中起关键作用[8]。目前,关于植物GCL基因相关研究较少,但其催化并调节GSH的生物合成可佐证其相关基因在干旱胁迫下对植物生理功能的调控作用。如大豆(Glycine max(L.)Merrill)[9]、水稻(Oryza sativa L.)[10]在干旱胁迫下,GSH通过调节抗氧化系统、提高水分利用效率来改善其生长状况。在小麦(Triticum aestivum L.)[11]耐旱相关研究中,经过外源GSH处理的小麦表现出更高的叶绿素含量和更强的抗旱能力。
本实验室前期通过苎麻转录组数据筛选出BnGCL1基因(GenBank No.OP948895),该基因在苎麻的根、茎、叶中均有表达,可能与苎麻耐旱调节相关。本研究旨在进一步探讨苎麻BnGCL1基因在干旱胁迫下的功能,分析转基因拟南芥在干旱胁迫下的耐受能力、抗氧化酶活性以及耐旱相关基因的表达情况,并利用病毒诱导的基因沉默(virus-induced gene silencing, VIGS)技术在苎麻中进行验证,可为苎麻抗旱品种的培育提供新的候选基因。
1 材料与方法
1.1 试验材料
苎麻材料为中苎一号,由湖南农业大学苎麻研究所提供。拟南芥(Arabidopsis thaliana)Col-0、pCAMBIA1300-35S-BnGCL1-myc过表达载体、pTRV1、pTRV2-VIGS载体均来自本实验室保存。根癌农杆菌GV3101(CAT#:AC1001),以及大肠杆菌菌株TOP10(CAT#:DL1010)、DH5α(CAT#:DL1001)均购自上海唯地生物技术有限公司。
1.2 BnGCL1基因的生物信息学分析
利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)的ORF Finder程序查找基因的开放读码框(open reading frame, ORF);利用ExPASy-translate tool在线工具(https://web.expasy.org/translate/)对BnGCL1的核酸序列进行翻译;利用NCBI的CD-Search在线工具对其保守结构域进行鉴定;利用NCBI的BLASTn和BLASTp在线工具对BnGCL1的核苷酸序列及其推导的氨基酸序列进行相似性比对;利用ProtParam(http://web.expasy.org/prot-param/)对蛋白质的理化性质进行分析;利用ProtScale(https://www.expasy.org/resources/protscale)进行蛋白质的亲疏水性预测;利用DNAMAN 8软件对苎麻及其他物种的蛋白序列做多重比对分析;用MEGA5.0软件构建系统进化树。
1.3 BnGCL1基因的表达模式分析
使用20%PEG-200对中苎一号进行盆栽模拟干旱胁迫处理,分别于处理0、6、12、24h后取苎麻叶片。根据苎麻BnGCL1基因序列,利用Primer Premier5.0软件设计实时荧光定量PCR引物,由湖南擎科生物有限公司(长沙)合成引物,具体引物序列见表1。实时荧光定量PCR反应体系如下:10µL的2×SYBR Green PCR Mix、0.5µL的F引物(浓度为10µmolL−1)、0.5µL的R引物(浓度为10µmolL−1)、2µL的cDNA和7µL的RNase-free ddH2O。反应条件设置为:94℃30s;94℃5s,61℃35s,共45个循环。选定苎麻肌动蛋白(β-actin)作为内参基因,以确保目标基因表达量测定的准确性。利用qPCR方法对BnGCL1基因在苎麻叶片中的表达情况进行检测,每组设置3个生物学重复,采用2−??Ct法计算基因的相对表达量。
1.4 过表达BnGCL1拟南芥分子鉴定
将构建好的pCAMBIA1300-35S-BnGCL1-myc载体通过热激法转化至农杆菌(Agrobacterium tumefaciens)GV3101中,采用花序侵染法转入野生型拟南芥Col-0中。T0代种子经过50mgL-1的潮霉素MS平板筛选阳性苗。将筛选得到的植株移栽至营养土中,于25℃光温培养箱内采用16h光照/8h黑暗光周期继续培养3周左右,取转基因拟南芥叶片并提取其DNA,使用BnGCL1-F和BnGCL1-R引物进行PCR鉴定(表1),反应体系为10µL,包含DNA1µL、Taq DNA连接酶0.1µL、10×Buffer 1µL、dNTP 1µL、2µmolL-1上下游引物各1µL、ddH2O4.9µL。PCR扩增程序:97℃预变性3min;95℃变性40s,58℃退火40s,72℃延伸1min,30个循环;72℃延伸7min。将收获的阳性植株的种子继续筛选培养至T3代。
表1 本研究所用到的引物
1.5 过表达BnGCL1拟南芥表型
将T3代过表达BnGCL1的拟南芥与野生型拟南芥分别播种在1/2MS培养基上。2周后挑选高度一致且长势良好的拟南芥健康苗定植于珍珠岩盆栽中。培育10d后对拟南芥盆栽添加20%PEG-200,以未添加盆栽为对照,每个处理重复3次。处理7d后取整株洗净吸干多余水分,进行根长和鲜重的测量。测定步骤均重复3次。
1.6 生理指标检测
过表达BnGCL1的拟南芥处理7d后取整株,将根部附着的珍珠岩洗净,仔细吸干植株上的多余水分。放入液氮中进行速冻,转移至−80℃低温保存,以便后续的试验分析和测试。采用抑制氮蓝四唑(NBT)光化还原法测定超氧化物歧化酶(superoxide dismutase, SOD)活性;采用硫代巴比妥酸(TBA)法测定丙二醛(malondialdehyde, MDA)含量;采用硫酸钛法测定过氧化氢(H2O2)含量;通过商品化试剂盒测定氧化型谷胱甘肽(GSSG)活性;采用抗坏血酸耗尽法测定抗坏血酸过氧化物酶(ascorbic acid peroxidase, APX)活性;通过γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthase, γ-GCL)活性试剂盒测定γ-GCL活性;采用酸性茚三酮比色法测定脯氨酸(proline, Pro)含量;采用5,5’-二硫代双(2-硝基苯甲酸)(DTNB)法测定总谷胱甘肽(GSH)含量。使用紫外分光光度计分别测量波长645nm和663nm叶绿素提取物的吸光值,使用Arnon公式计算叶绿素a和叶绿素b及总叶绿素含量。所有试验均设置3个生物学重复,以保证试验结果准确性。
1.7 BnGCL1基因沉默苎麻植株抗旱性验证
为验证BnGCL1基因在苎麻响应干旱胁迫中的生物学功能,利用pTRV-VIGS体系构建VIGS-pTRV2-BnGCL1与VIGS-pTRV2-BnPDS沉默载体,并转入农杆菌GV3101菌种。参考吴法轩等[12]的方法,选用苎麻中苎一号作为试验品种,取苎麻顶芽于水培箱中培养3周后移栽,定植1周后侵染苎麻植株,侵染后的植株用黑色塑料袋包裹黑暗处理24h,随后置于25℃、湿度60%、光周期16h光照/8h黑暗条件下培养。在初次侵染处理1周后,对相同侵染部位进行2次处理以保证侵染效果。侵染处理后,分别于7d、10d观测表型,在第10天取苎麻叶片,测量叶片MDA含量。以苎麻肌动蛋白(β-actin)作为内参基因,利用Primer Premier5.0软件设计实时荧光定量PCR引物,由湖南擎科生物有限公司(长沙)合成引物,进行实时荧光定量PCR。反应体系配置:Vazyme2×SupRealQ Ultra Hunter SYBR qPCR Master Mix(U+)10µL,10µmolL-1上游和下游引物各0.4µL,cDNA 1.2µL以及ddH2O 8µL进行混合。反应条件设置:95℃30s;95℃10s,60℃30s,40个循环。每组设置3个生物学重复,以保证试验结果的准确性。采用2-??Ct法计算基因的相对表达量,使用SPSS 7.0与Microsoft Excel 2016软件进行数据分析。
1.8 过表达BnGCL1拟南芥耐旱相关基因的表达
使用与1.6中相同处理方法采集转基因拟南芥叶片组织,参照植物总RNA提取试剂盒(RNAprep pure Plant Kit)试剂盒(天根生化科技有限公司,北京)提取拟南芥总RNA,用1.5%的琼脂糖凝胶电泳和紫外分光光度计检测所得到的RNA的完整性及纯度。利用反转录试剂盒EasyScript FirstStrand cDNA Synthesis SuperMix(全式金生物技术有限公司,北京)将RNA反转录获得cDNA。
利用实时荧光定量PCR方法对拟南芥抗旱相关基因谷胱甘肽S-转移酶基因(AtGSTs)、9-顺-环氧类胡萝卜素双加氧酶基因(AtNCED3)、WRKY转录因子基因(AtWRKY40)在转基因植株内的表达情况进行检测。根据拟南芥AtGST1、AtGST11、AtNCED3和AtWRKY40基因序列,利用Primer Premier 5.0软件设计实时荧光定量PCR引物,由湖南擎科生物有限公司(长沙)合成引物。反应体系配置:2×ChamQ Universal SYBR qPCR Master Mix 10µL,10µmolL-1上游和下游引物各0.4µL,cDNA 2µL以及ddH2O 7.2µL进行混合。反应条件设置:95℃30s;95℃10s,60℃30s,40个循环。以拟南芥β肌动蛋白8(β-actin8)作为内参基因。每组设置3个生物学重复,采用2-??Ct法计算基因的相对表达量。使用SPSS 7.0与MicrosoftExcel2016软件进行数据分析。
2 结果与分析
2.1 BnGCL1基因克隆与生物信息学分析
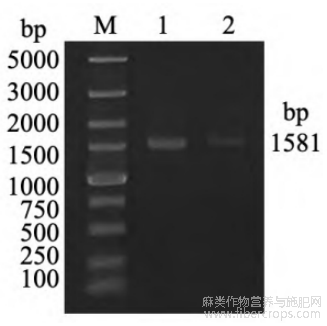
在提取苎麻叶片的RNA后,反转录获得cDNA。基于BnGCL1基因序列设计BnGCL1基因的特异性扩增引物(表1)。利用引物进行PCR扩增试验,并通过琼脂糖凝胶电泳技术对扩增产物进行检测。结果显示,成功扩增出条带大小为1581bp的目标片段(图1),标志着BnGCL1基因片段的成功获取。
图1 BnGCL1基因的克隆
利用ORF Finder程序和ExPASy-translate tool在线工具对BnGCL1基因分析,获得该基因序列最大开放阅读框(ORF)为1581bp,编码526个氨基酸。利用ProtParam在线工具分析发现,BnGCL1蛋白的等电点为5.79,分子量为59,123.98Da,脂肪系数为78.78,稳定系数为37.42(<40,属于稳定蛋白),分子式为C2650H4120N696O773S32。利用NCBI的CD-Search在线工具对其保守结构域进行鉴定,预测BnGCL1蛋白带有PLN02611结构域,属于谷氨酸-半胱氨酸连接酶家族2(GCS2)。
用NCBI的BLASTp对BnGCL1蛋白进行氨基酸相似性搜索发现,苎麻BnGCL1蛋白与烟草(Nicotiana tabacum,Q1W2L8.2)、拟南芥(Arabidopsis thaliana,P46309.2)、番茄(Solanum lycopersicum,O22493.1)、芥菜(Brassica juncea,O23736.1)、苜蓿(Medicago truncatula,Q9ZNX6.1)的氨基酸序列相似性较高,相似性分别为82.7%、82.35%、80.8%、80.8%、83.5%(图2)。利用DNAMAN进行多重序列比对发现,PLN02611结构域在不同物种间表现出高度的保守性。
图2 BnGCL1蛋白与其他植物氨基酸序列同源性比较
黑色表示序列同源性为100%,粉红色表示序列同源性大于75%,蓝色表示序列
同源性大于50%。
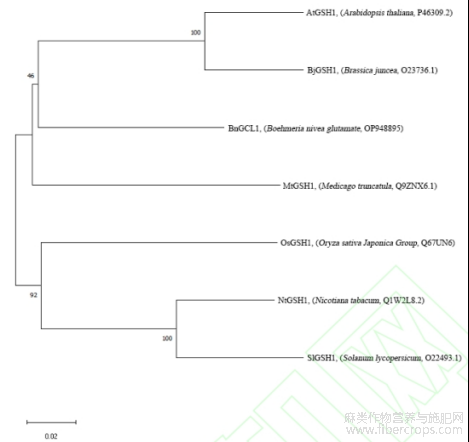
利用MEGA5软件的Neighbor-Joining法对BnGCL1以及GenBank数据库中其他植物的GCL蛋白构建系统进化树(图3)发现,苎麻BnGCL1蛋白与拟南芥(Arabidopsis thaliana,P46309.2)、芥菜(Brassica juncea,O23736.1)的亲缘关系最近,推测该类蛋白可能具有类似的功能。
图3 BnGCL1与其他植物GCL蛋白的系统进化树
2.2 干旱胁迫下BnGCL1基因的表达模式分析
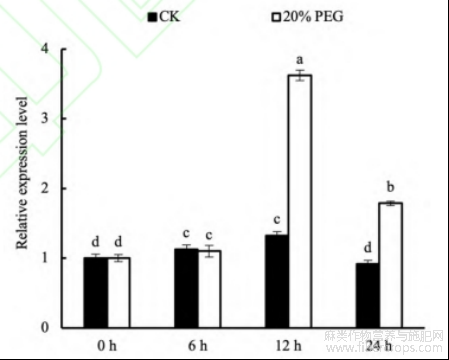
在20%PEG-200模拟的干旱胁迫下,研究BnGCL1基因在苎麻叶片中对干旱胁迫的响应,发现在干旱处理12h时苎麻叶片中BnGCL1基因的转录水平达到峰值,较干旱处理前(0h)提升3.62倍(图4)。表明BnGCL1基因能显著响应干旱胁迫,表达水平提高。
图4 干旱胁迫后BnGCL1基因在苎麻叶片中的表达量
CK:未经20%PEG-200模拟干旱胁迫处理;20%PEG:经20%PEG-200模拟干旱胁迫处理。误差线上不同小写字母表示5%显著水平下的差异性。
2.3 干旱胁迫下过表达BnGCL1拟南芥植株的表型
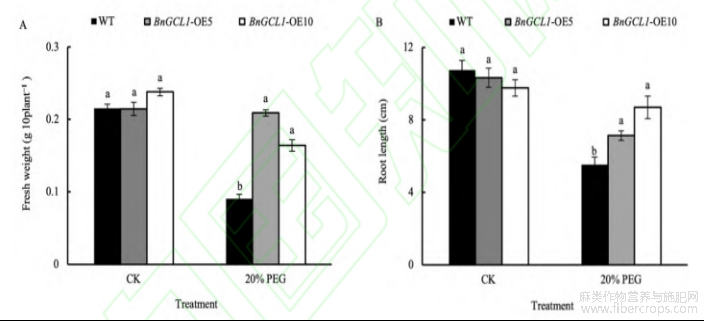
20%PEG-200模拟的干旱胁迫抑制了野生型拟南芥的生长(图5)。20%PEG-200干旱胁迫下,过表达BnGCL1基因的拟南芥株系(BnGCL1-OE5和BnGCL1-OE10)的根长和鲜重显著高于野生型(WT)。BnGCL1-OE5和BnGCL1-OE10的根长分别比野生型增加28.92%和57.23%,鲜重分别比野生型增加131.19%和81.42%(图6),表明BnGCL1的过表达显著增强了植株的耐旱能力。
图5 干旱胁迫下过表达BnGCL1拟南芥生长情况
处理同图4。WT:野生型拟南芥株系;BnGCL1-OE5、BnGCL1-OE10:过表达拟南芥株系。
图6 过表达BnGCL1基因拟南芥根长和鲜重
处理同图4。缩写同图5。误差线上不同小写字母表示5%显著水平下的差异性。
2.4 干旱胁迫下过表达BnGCL1拟南芥植株光合色素变化
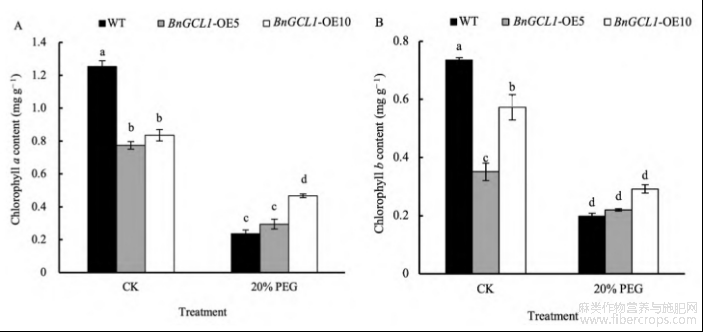
过表达BnGCL1拟南芥在20%PEG-200模拟的干旱胁迫条件下相较于野生型拟南芥叶绿素a与叶绿素b含量均有明显升高(图7),过表达BnGCL1拟南芥株系(BnGCL1-OE5和BnGCL1-OE10)的叶绿素a和叶绿素b含量显著高于野生型(WT)。BnGCL1-OE5和BnGCL1-OE10的叶绿素a含量分别比野生型增加25.07%和99.09%,叶绿素b含量分别比野生型增加11.14%和47.26%。
图7 干旱胁迫下过表达BnGCL1拟南芥叶绿素a与叶绿素b含量
处理同图4。缩写同图5。误差线上不同小写字母表示5%显著水平下的差异性。
2.5 干旱胁迫下过表达BnGCL1拟南芥的抗氧化酶活性及渗透调节物质含量
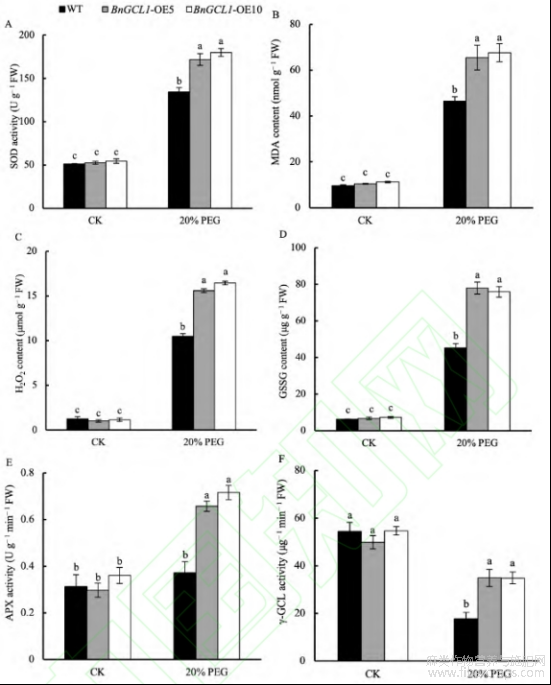
在干旱胁迫下,与野生型相比,BnGCL1-OE5和BnGCL1-OE10的抗氧化酶活性显著提高,其中APX活性分别增加77.21%和93.01%,γ-GCL活性分别增加96.65%和96.49%,GSSG含量分别增加72.14%和67.59%。同时,SOD活性分别提高28.13%和34.08%,MDA含量分别增加40.71%和45.19%,H2O2含量分别增加48.50%和56.86%。这些结果表明,BnGCL1能增强抗氧化能力,提高植物应对干旱胁迫的能力(图8)。
图8 干旱胁迫下过表达BnGCL1拟南芥抗氧化酶活性
A:超氧化物歧化酶(SOD)活性;B:丙二醛(MDA)含量;C:过氧化氢(H2O2)含量;D:氧化型谷胱甘肽(GSSG)含量;E:抗坏血酸过氧化物酶(APX)含量;F:γ-谷氨酰半胱氨酸合成酶(γ-GCL)活性。误差线上不同小写字母表示5%显著水平下的差异性。处理同图4。缩写同图5。
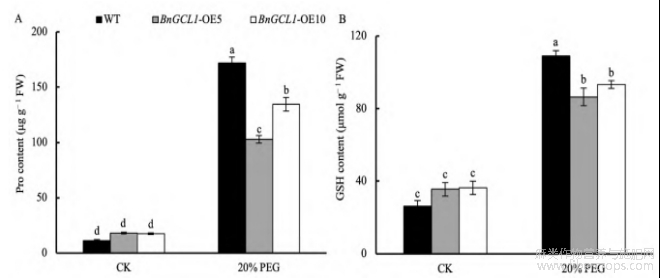
过表达BnGCL1拟南芥株系的Pro(图9-A)、GSH含量(图9-B)与野生型相比显著下降。BnGCL1-OE5的Pro含量减少40.27%,GSH含量减少20.77%;BnGCL1-OE10的Pro含量减少21.77%,GSH含量减少14.45%。这表明,过表达BnGCL1拟南芥可能通过优化渗透调节机制应对干旱胁迫。Pro、GSH的下降可能是由于其他代谢途径的激活或资源重分配;GSH作为抗氧化剂可能在清除活性氧的过程中被大量消耗,导致其净含量的下降。
图9 干旱胁迫下过表达BnGCL1拟南芥脯氨酸(Pro)及谷胱甘肽(GSH)含量
处理同图4。缩写同图5。误差线上不同小写字母表示5%显著水平下的差异性。
2.6 过表达BnGCL1拟南芥耐旱相关基因表达
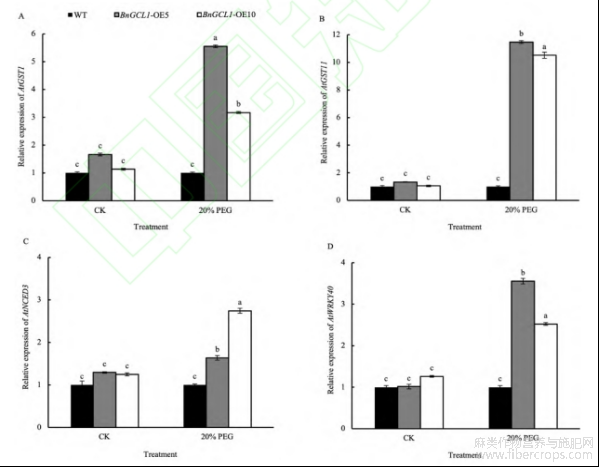
20%PEG-200干旱胁迫后BnGCL1-OE5和BnGCL1-OE10株系AtGST1表达量是野生型的5.55倍和3.17倍,AtGST11表达量是野生型的11.5倍和10.5倍,AtNCED3表达量分别是野生型的1.64倍和2.74倍,AtWRKY40表达量分别是野生型的3.56倍和2.52倍(图10)。表明过表达BnGCL1能显著提高干旱胁迫下拟南芥AtGST1、AtGST11、AtNCED3和AtWRKY40的转录水平。
图10干旱胁迫下过表达BnGCL1拟南芥中AtGST1、AtGST11、AtNCED3和AtWRKY40基因的表达
处理同图 4。缩写同图 5。误差线上不同小写字母表示 5%显著水平下的差异性。
2.7 BnGCL1基因VIGS功能验证
本研究利用pTRV-VIGS体系沉默了BnGCL1基因的表达,注射pTRV1::BnPDS的阳性对照植株2周后叶片出现白化现象(图11-A),表明pTRV-VIGS体系适用于苎麻的基因沉默研究。对照株系(pTRV::00)与基因沉默株系(pTRV::BnGCL1)叶片中丙二醛(MDA)含量的测定结果表明,在正常水分条件下,两者叶片中的MDA含量无显著差异。然而,经干旱处理后,基因沉默株系(pTRV::BnGCL1)叶片中的MDA含量显著高于对照株系(图11-B)。这表明,沉默目的基因严重削弱了植株的抗旱性,导致叶片中MDA的积累增加。通过实时荧光定量PCR检测pTRV::BnGCL1株系的沉默效率发现,VIGS沉默株系的BnGCL1基因表达水平较对照组显著降低(图11-C),表明pTRV能有效地沉默BnGCL1基因。在干旱处理第7天和第10天观测植株叶片的干旱表型,发现对照组中2种株系的叶片表型未见显著差异(图11-D)。干旱处理组中,基因沉默株系(pTRV::BnGCL1)的叶片在第7天即表现出轻微萎蔫和卷曲,而对照株系(pTRV::00)的叶片此时未发生萎蔫(图11-E)。干旱处理第10天,pTRV::BnGCL1株系的叶片萎蔫程度显著高于pTRV::00株系(图11-F)。
图11 VIGS试验验证BnGCL1的抗旱功能
A:pTRV::BnPDS株系白化表型。B:正常处理和干旱处理后VIGS沉默株系和对照组MDA含量。C:VIGS沉默株系和对照株系中BnGCL1基因的相对表达量。D:正常处理下对照组和VIGS沉默株系。E:干旱处理7d后对照组和VIGS沉默株系叶片表型。F:干旱处理10d后对照组和VIGS沉默株系叶片表型。标尺为2cm。误差线上不同小写字母表示5%显著水平下的差异性。
3 讨论
3.1 干旱胁迫下过表达BnGCL1拟南芥表型、ROS与渗透调节物质的调控特征
过表达BnGCL1拟南芥在干旱胁迫下叶绿素a、叶绿素b及总叶绿素含量均显著高于野生型,其含量的维持可能与其抗氧化系统的增强有关。干旱胁迫通常导致植物体内ROS的积累引起脂膜过氧化等氧化损伤。通常,抗旱性强的作物通过增强SOD、APX等抗氧化酶活性清除ROS,累积渗透调节物质如Pro、可溶性糖等,以维持细胞渗透压平衡[13]。本研究表明,BnGCL1过表达显著增强了抗氧化酶的活性,有效降低了ROS的积累,从而提高了植物对干旱胁迫的耐受性,这与拟南芥[14-15]、陆地棉[16]、小麦[17]APX相关基因的干旱响应机制一致,揭示了APX参与植物干旱胁迫应答过程,进一步印证了本研究相关结论。
干旱胁迫处理下,大豆GSSG含量呈升高趋势[18],与本研究结果一致。干旱胁迫下过表达BnGCL1拟南芥SOD与MDA含量明显增加,这与前人[19-23]研究结论相同。H2O2作为内源信号分子参与植物体内许多重要的生理过程并调控气孔开度,气孔细胞内H2O2含量与气孔开度呈负相关,H2O2对气孔开度的调节通过改变质膜H+-ATP酶的活性来实现[24],20%PEG-200干旱胁迫下过表达BnGCL1拟南芥H2O2含量均有所增加,表明H2O2的累积有利于苎麻抗旱能力的提升。本研究中Pro、GSH含量的下降可能归因于其他代谢途径的激活或细胞内资源的重新分配。干旱胁迫下,半胱氨酸可能被竞争性分配到脯氨酸合成途径以增强渗透调节能力。此外,GSH作为一种关键的抗氧化剂,可能在清除ROS的过程中被大量消耗,从而导致其净含量的显著降低[25-26]。过表达BnGCL1拟南芥Pro、GSH没有显著积累,但仍表现出较强的抗旱性,表明其可能通过非典型途径增强了转基因拟南芥的抗旱性[26-28]。
GCL与植物抗逆过程密切相关,绿豆γ-GCL水平受干旱胁迫调控[29],刚毛柽柳ThGCL基因受NaCl、PEG诱导上调表达[30]。这些研究结果表明,GCL基因的表达对环境胁迫存在响应,可能参与植物的抗逆过程。近年来的研究表明,GCL基因在其他植物中的表达均与环境胁迫密切相关。例如,马铃薯StGCL能提高植物对重金属的耐受性[31]。GSH不仅是植物抗氧化系统的核心成分之一,也是细胞内重要的抗氧化剂,能够有效清除植物在环境压力下产生的自由基和ROS。GCL酶活性能够决定细胞GSH水平和GSH生物合成能力,GCL活性的降低直接导致GSH合成量下降,其结果是植物清除活性氧的能力下降[32]。在干旱和盐碱胁迫下,GCL的表达会显著上调,从而增强GSH的合成,提高植物的抗逆性,GCL活性降低会导致GSH含量下降,随之清除植物体内活性氧的能力降低,进而活性氧动态平衡被破坏。同样地,GSH对GCL的活性也起到反馈作用[33]。在植物中,GCL基因的转录通常受到氧化应激、重金属、病原入侵等环境因素的调控[34]。对拟南芥转录因子ZAT6的研究显示,ZAT6通过调节AtGCL相关的GSH合成,增强了拟南芥对镉的耐受性[35]。
3.2 耐旱相关基因的表达变化
干旱胁迫通常导致植物体内耐旱相关基因的表达发生变化,以应对干旱胁迫带来的压力。AtGST1和AtGST11是谷胱甘肽S-转移酶基因,它们在植物抗氧化反应中起着重要作用。研究表明,GST基因家族参与植物对多种胁迫的响应,尤其是在抗氧化和解毒过程中[36]。GSTs参与GSH依赖的解毒过程,能够清除植物在环境压力下产生的ROS,减轻氧化损伤[37]。GSH的合成受GCL的调控,在干旱胁迫下BnGCL1的过表达可能通过提高GSH的合成水平来促进GSTs的活性,从而增强植物的抗氧化能力。AtNCED3基因在植物的水分平衡和应对干旱胁迫中扮演了重要角色。其参与脱落酸(ABA)的合成,在植物应对干旱胁迫中起到关键作用[38]。ABA通过调节气孔关闭、抑制水分蒸发等途径,帮助植物维持水分平衡[39]。BnGCL1通过上调AtNCED3的表达,可能通过增加ABA的合成,进一步调节ABA信号通路,促进拟南芥对干旱胁迫的应答。AtWRKY40基因属于WRKY转录因子家族,其在植物胁迫响应中发挥着重要的调控作用。AtWRKY40在拟南芥的干旱胁迫中起到正调控作用[40],在BnGCL1的过表达下,AtWRKY40的上调可能通过调控抗氧化相关基因的表达,进一步提升植物的抗氧化防御能力,帮助其更好地应对干旱胁迫。通过调节相关基因的表达,帮助植物适应干旱环境。干旱胁迫下,BnGCL1的过表达显著上调多个干旱应答相关基因如AtGST1、AtWRKY40和AtNCED3的表达水平,这些基因涉及抗氧化[41]、ABA信号途径及胁迫响应网络[42-43]。特别是AtWRKY40的上调可能通过调控下游应答基因,进一步增强植物对干旱胁迫的适应能力[44-45]。上述基因表达变化与抗氧化酶活性的变化相结合,可以更全面地理解BnGCL1的作用机制。AtGST1和AtGST11的上调可能通过增强GSH库的维持和ROS的清除,直接影响抗氧化酶的活性,从而加强拟南芥的抗氧化能力。这些变化共同作用,形成了增强的抗氧化防御体系,帮助拟南芥更好地应对干旱等胁迫。
这表明,BnGCL1在调控干旱相关信号传递和基因表达中可能处于重要节点。本研究证实了苎麻BnGCL1基因在干旱胁迫下的重要作用。BnGCL1的过表达能够通过上调AtGST1、AtGST11、AtNCED3和AtWRKY40等关键基因的表达,提高拟南芥的耐旱性。这一发现为进一步研究BnGCL1在植物耐旱机制中的作用提供了理论基础,并可能为农业作物的耐旱育种提供新的思路。但其在苎麻中的作用机制仍需进一步探究,以验证其在苎麻抗旱育种中的应用潜力。
3.3 BnGCL1基因沉默对苎麻MDA含量及其相对表达量的影响
病毒诱导的基因沉默是一种无需依赖转基因技术的基因功能缺失研究策略。该技术整合了植物病毒的系统性侵染特性、宿主的天然免疫应答以及细胞内的RNA干扰(RNAi)沉默机制,能够在植物体内实现靶基因的快速、高效、可逆的转录后沉默。相比基于遗传转化的基因缺失研究方法,VIGS技术具有试验周期短、研究成本低、无需遗传转化以及适用植物种类广泛等显著优势[46-47]。本研究构建了病毒诱导基因沉默(VIGS)载体,获得了pTRV::BnGCL1基因沉默株系及TRV::00对照株系。对基因沉默株系的表型以及MDA指标的分析显示,在干旱胁迫条件下,与对照组相比,pTRV::BnGCL1基因沉默株系表现出更为明显的叶片萎蔫表型。对各株系苎麻叶片的MDA含量测定结果进一步表明,相对于TRV::00对照株系,pTRV::BnGCL1基因沉默株系叶片MDA的积累量显著提高。综合分析上述表型和MDA含量结果,证明了BnGCL1基因沉默有效地削弱了苎麻的抗旱性,表明该基因在苎麻应对干旱胁迫过程中发挥着作用。
4 结论
本研究通过功能验证表明,BnGCL1基因在干旱胁迫下通过增强抗氧化酶活性和调控渗透调节物质代谢,显著提高了植物对干旱胁迫的适应能力。干旱胁迫下,过表达BnGCL1拟南芥根长、鲜重、叶绿素a、叶绿素b显著高于野生型,且抗氧化酶APX、γ-GCL活性及GSSG、Pro等的积累均发生显著变化。BnGCL1过表达还显著上调了多个干旱应答相关基因如AtGST1、AtGST11、AtWRKY40和AtNCED3的表达水平。沉默BnGCL1显著降低了苎麻的抗旱性,并且增加了苎麻叶片中的MDA含量,表明BnGCL1可能参与苎麻的干旱胁迫响应。
参考文献
[1] Zhu J K. Abiotic stress signaling and responses in plants. Cell, 2016,167:313-324.
[2] Ma L J, Xing L H, Li Z C, et al. Epigenetic control of plant abiotic stress responses. J Genet Genom,2025,52:129-144.
[3] Cramer G R, Urano K, Delrot S, et al. Effects of abiotic stress on plants: a systems biology perspective. BMC Plant Biol,2011,11:163.
[4] Zeid I M, Shedeed Z A. Response of alfalfa to putrescine treatment under drought stress. Biol Plant,2006,50:635-640.
[5] 张波,郑长清,林华如.干旱胁迫下苎麻种质的抗旱生理与经济性状的研究.中国麻作,1997,19(1):26-30.
[6] 全芮萍,王昕慧,刘婕仪,等.苎麻响应非生物胁迫的生理学研究进展.中国麻业科学,2022,44(3):183-189.
[7] 熊伟,汤涤洛,熊常财,等.山坡地种植苎麻水土保持效果研究.中国水土保持,2017,(5):63-66.
[8] Lu S C. Regulation of glutathione synthesis. Mol Aspects Med, 2009,30:42-59.
[9] Akram S, Siddiqui M N, Nahid Hussain B M, et al. Exogenous glutathione modulates salinity tolerance of soybean [Glycine max (L.) Merrill] at reproductive stage. J Plant Growth Regul,2017,36:877-888.
[10] Panda D, Mishra S S, Behera P K. Drought tolerance in rice: focus on recent mechanisms and approaches. Rice Sci, 2021,28:119-132.
[11] Suliman M S E, Elradi S B M, Zhou G S, et al. Exogenous glutathione protected wheat seedling from high temperature and water deficit damages. Sci Rep,2024,14:5304.
[12] 吴法轩,李秦,杨昕,等.红麻HcKAN4基因克隆?表达及在类黄酮合成中的功能.作物学报,2024,50:645-655.
[13] 冯涛,王海月.四种苹果属植物耐旱性比较研究.湖北农业科学,2018,57(11):59-61.
[14] Zimmermann P, Hirsch-Hoffmann M, Hennig L, et al. GENEVESTIGATOR. Arabidopsis Microarray database and analysis toolbox. Plant Physiol,2004,136:2621–2632.
[15] 李泽琴,李锦涛,邴杰,等.拟南芥APX家族基因在植物生长发育与非生物逆境胁迫响应中的作用分析.遗传,2019,41:534-549.
[16] 陈琴,李多露,高文举,等.陆地棉APX基因家族鉴定及抗旱性分析.农业生物技术学报,2021,29:1894-1903.
[17] 王润豪,于永昂,胡海燕,等.小麦抗坏血酸过氧化物酶TaAPX基因克隆与表达分析.华北农学报,2020,35(2):48-56.
[18] 董守坤,马玉玲,李爽,等.干旱胁迫及复水对大豆抗坏血酸-谷胱甘肽循环的影响.东北农业大学学报,2018,49(1):10-18.
[19] 黄国存,崔四平,马春红,等.干旱对小麦幼苗SOD活性和CaM水平的影响.华北农学报,1995,10(1):40-44.
[20] 马尧,于漱琦.水分胁迫下小麦幼苗SOD活性的变化及脂质过氧化作用.农业与技术,1998,18(3):18–19.
[21] 戴高兴,彭克勤,萧浪涛,等.聚乙二醇模拟干旱对耐低钾水稻幼苗丙二醛?脯氨酸含量和超氧化物歧化酶活性的影响.中国水稻科学,2006,20:557–559.
[22] 聂石辉,齐军仓,张海禄,等.PEG-6000模拟干旱胁迫对大麦幼苗丙二醛含量及保护酶活性的影响.新疆农业科学,2011,48(1):11-17.
[23] 李雪凝,董守坤,刘丽君,等.干旱胁迫对春大豆超氧化物歧化酶活性和丙二醛含量的影响.中国农学通报,2016,32(15):93-97.
[24] Zhang X, Takemiya A, Kinoshita T, et al. Nitric oxide inhibits blue light-specific stomatal opening via abscisic acid signaling pathways in Vicia Guard cells. Plant Cell Physiol,2007,48:715-723.
[25] Wang X Y, Li X M, Zhao W, et al. Current views of drought research: experimental methods, adaptation mechanisms and regulatory strategies. Front Plant Sci,2024,15:1371895.
[26] 王丽媛,丁国华,黎莉.脯氨酸代谢的研究进展.哈尔滨师范大学自然科学学报,2010,26(2):84-89.
[27] Delauney A J, Hu C A, Kishor P B, et al. Cloning of ornithine delta-aminotransferase cDNA from Vigna aconitifolia by trans-complementation in Escherichia coli and regulation of proline biosynthesis. J Biol Chem, 1993, 268: 18673-18678.
[28] Ahmed A A M, Roosens N, Dewaele E, et al. Overexpression of a novel feedback-desensitized Δ1-pyrroline-5-carboxylate synthetase increases proline accumulation and confers salt tolerance in transgenic Nicotiana plumbaginifolia. Plant Cell Tissue Organ Cult,2015,122:383-393.
[29] Sengupta D, Ramesh G, Mudalkar S, et al. Molecular cloning and characterization of γ-glutamyl cysteine synthetase (VrγECS) fromroots of Vigna radiata (L.) Wilczek under progressive drought stress andrecovery. Plant Mol Biol Rep,2012,30:894-903.
[30] 张勇,张力,杨佩民,等.刚毛柽柳ThγGCS基因克隆及表达分析.分子植物育种,2017,15:113-120.
[31] 张亚鹏.马铃薯γ-谷氨酸半胱氨酸连接酶基因(StGCL)的克隆和转基因研究.华南农业大学硕士学位论文,广东广州,2018.
[32] Forman H J, Zhang H Q, Rinna A. Glutathione: overview of its protective roles, measurement, and biosynthesis. Mol Aspects Med,2009,30:1-12.
[33] Richman P G, Meister A. Regulation of gamma-glutamyl-cysteine synthetase by nonallosteric feedback inhibition by glutathione. J Biol Chem, 1975, 250:1422-1426.
[34] Gupta S C, Goldsbrough P B. Phytochelatin accumulation and cadmium tolerance in selected tomato cell lines. Plant Physiol,1991, 97:306-312.
[35] Chen J, Yang L B, Yan X X, et al. Zinc-finger transcription factor ZAT6 positively regulates cadmium tolerance through the glutathionedependent pathway in Arabidopsis. Plant Physiol,2016,171:707-719.
[36] Nianiou-Obeidat I, Madesis P, Kissoudis C, et al. Plant glutathione transferase-mediated stress tolerance: functions and biotechnological applications. Plant Cell Rep,2017,36:791-805.
[37] Cummins I, Dixon D P, Freitag-Pohl S, et al. Multiple roles for plant glutathione transferases in xenobiotic detoxification. Drug Metab Rev,2011,43:266-280.
[38] Zhu J K. Salt and drought stress signal transduction in plants. Annu Rev Plant Biol,2002, 53:247-273.
[39] Wani S H, Kumar V, Shriram V, et al. Phytohormones and their metabolic engineering for abiotic stress tolerance in crop plants. Crop J,2016,4:162-176.
[40] 车永梅,孙艳君,卢松冲,等.AtWRKY40参与拟南芥干旱胁迫响应过程.植物生理学报,2018,54:456-464.
[41] 王玲娟,鲁帅,高聪,等.拟南芥AtGST8的功能及其过表达植株对甲基紫精胁迫的响应.南通大学学报(自然科学版),2023,22(1):44-53.
[42] Molinari M D C, Fuganti-Pagliarini R, Marin S R R, et al. Overexpression of AtNCED3 gene improved drought tolerance in soybean in greenhouse and field conditions. Genet Mol Biol, 2020, 43: e20190292.
[43] Woo D H, Park H Y, Kang I S, et al. Arabidopsis lenc1 mutant displays reduced ABA accumulation by low AtNCED3 expression under osmotic stress. J Plant Physiol,2011,168:140-147.
[44] Jiang J J, Ma S H, Ye N H, et al. WRKY transcription factors in plant responses to stresses. J Integr Plant Biol,2017,59:86-101.
[45] Chen X J, Li C, Wang H, et al. WRKY transcription factors: evolution, binding, and action. Phytopathol Res,2019,1:13.
[46] 季娜娜,闵德栋,邵淑君,等.VIGS载体在蔬菜作物中的应用研究进展.植物生理学报,2016,52:810-816.
[47] 刘俊飞,杨晓娟,潘根,等.基于TRV病毒的工业大麻(Cannabis sativa L.)VIGS体系的优化.中国麻业科学,2023,45(5):197-205.
文章摘自:刘海波,张蕾,王立琦,石晓丽,周文莹,崔国贤,佘玮.苎麻BnGCL1基因响应干旱胁迫的功能研究[J].作物学报.https://link.cnki.net/urlid/11.1809.S.20251105.1041.002。