摘 要:目的 开展罗布麻茶的安全性评价,为其在制茶新工艺中提供参考依据?方法 72只ICR小鼠进行28d经口毒性试验,对蒸煮工艺加工的罗布麻茶进行初步安全性评价?结果 蒸煮工艺制备的罗布麻茶对小鼠的经口给药安全剂量大于30.0g/kg·bw,属无毒级;小鼠体重?脏器重量?脏器指数?血液生化等各项指标与对照组比较差异均无统计学意义(P<0.05)?结论 蒸煮工艺制备的罗布麻茶在30g/kg·bw剂量范围内未见明显毒性反应?
关键词:蒸煮;罗布麻茶;安全性
罗布麻叶为夹竹桃科植物罗布麻(Apocynum venetum L.)的干燥叶,具有“平肝安神?清热利水”的功能,是我国许可的保健食品生产原料[1]?现代研究表明,罗布麻茶具有治疗非酒精性脂肪肝?改善睡眠?抗衰老?抗动脉粥样硬化?镇静催眠?调节代谢与肠道菌群?改善脑损伤小鼠认知功能?减轻氧化应激?抗抑郁?抗高脂血症和降血压等多种功效[2-11]?目前国家食品药品监督管理局已批准了5款罗布麻保健食品?罗布麻茶为罗布麻叶经过制茶工艺生产的茶,制茶工艺可在一定程度上部分脱除罗布麻叶的涩味和碱味,改善口感?蒸煮是我国传统的制茶工艺之一,目前在罗布麻茶加工中应用较少?相对于传统炒制工艺,蒸煮工艺能更好脱除罗布麻叶的涩味和碱味,并增添了特殊香味,具有潜在的推广应用价值,但其安全性尚未进行报道?因此,本研究以蒸煮工艺制备的罗布麻茶为研究对象,依据《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》要求进行28d喂养实验,评价其对正常小鼠的毒性,为罗布麻制茶新工艺的引入提供依据和参考?
1 材料与方法
1.1 样品 受试样品为罗布麻叶?蒸煮工艺制罗布麻茶(以下均称为“罗布麻茶”)?称取一定质量的受试样品,按照1g∶10ml的比例加入开水浸泡30min,过滤,分离茶汤,取茶渣按照1g∶8ml比例加入开水,浸泡20min,过滤,分离茶汤?将两次提取茶汤合并,采用旋转蒸发仪浓缩至适当浓度,储存于4℃冰箱,备用?
1.2 实验动物 6~8周清洁级ICR小鼠,购自新疆医科大学,雌雄对半,共72只?小鼠饲养温度为(22±2)℃,自然光照,自由采食和饮水,适应性饲养1周之后开始实验?
1.3 试剂和仪器 生化试剂盘?全自动动物生化分析仪(型号:HR300V)均购买自华仁普施康?
1.4 实验方法 依据罗布麻茶说明书推荐剂量,每天推荐用量为18g,依成人体重60kg计算,人日常用量为0.3g/kg?将小鼠分为5组,分别为空白组对照组?罗布麻叶中剂量组?罗布麻茶低剂量组?罗布麻茶中剂量组?罗布麻茶高剂量组,每组6只小鼠,低?中和高剂量组分别为人体推荐用量的25?50和100倍?采用灌胃方式给药,给药时间28d,每天给药1次,期间每3d称1次体重,第28天给药后,对小鼠摘眼球取血,采用试剂盘测定其血常规五分类?肝肾功能指标;取血后脱颈处死小鼠,解剖后称量各脏器重量,计算脏器指数?
肝功能评价指标包括谷氨酰基转移酶(GGT)?天冬氨酸转氨酶(AST)?丙氨酸转氨酶(ALT)?AST/ALT?总胆红素(TBIL)?总蛋白(TP)?白蛋白(ALB)?球蛋白(GLOB)?白球比(A/G),肾功能评价指标包括尿素(UREA)?肌酐(CREA)?尿素/肌酐(UREA/CRE)?
1.5 统计学方法 采用SPSS 14.0统计软件进行单因素方差分析,组间两两比较采用LSD?S-N-K?以P<0.05为差异有统计学意义?
2 结果
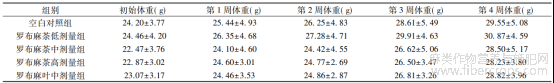
2.1 罗布麻茶?罗布麻叶对小鼠体重的影响 各组小鼠均为雌?雄对半,实验过程灌胃给药28d,未出现死亡,最大给药剂量为30g/kg,属于无毒级别,与市售罗布麻茶安全性相当[12-13]?各剂量组小鼠体重与对照组比较,差异无统计学意义(P>0.05),罗布麻茶?罗布麻叶在本试验条件下对动物的体重无明显影响,结果见表1?
表1 罗布麻茶?罗布麻叶对小鼠体重的影响(![]() ±s)
±s)
2.2 罗布麻茶?罗布麻叶对脏器重量和脏器指数的影响 各组小鼠的心脏?肝?脾?肺?肾的重量和脏器系数,与空白对照组比较,差异无统计学意义,说明罗布麻茶?罗布麻叶在本试验条件下对小鼠的各脏器无明显影响?
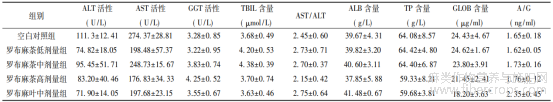
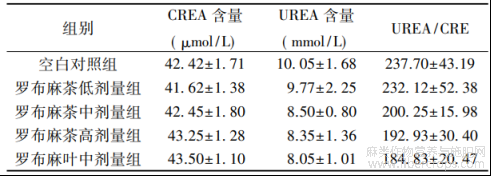
2.3 血液生化检验结果 测定各组小鼠的血液生化指标,结果见表2~3?与空白对照组相比,除罗布麻叶中剂量组GLOB?A/G数值有明显增加外,其余各项指标差异均无统计学意义,说明罗布麻茶在本试验条件下对正常小鼠的肝?肾及血液相关生化指标无明显影响,未造成肝?肾损伤?
表2 罗布麻茶对小鼠肝相关生化指标的影响(![]() ±s)
±s)
注: 与空白对照组比较,*P<0.05?
表3 罗布麻茶对小鼠肾相关血液生化指标的影响(![]() ±s)
±s)
3 讨论
ALB?GLOB是血清蛋白的两个主要成分,临床上ALB被用来反映营养状况,而GLOB则被用来评估慢性炎症的严重程度[14]?通常,GLOB水平的升高可以作为慢性炎症反应的标志物,在实验中罗布麻叶中剂量组GLOB呈现出降低趋势,说明小鼠存在慢性炎症的情况,这可能是由于该组小鼠免疫功能受到抑制等原因造成的[15]?
A/G可作为肝功能评价的一个指标,近年来,A/G作为一种新的预测指标出现,低水平的A/G在临床上具有重要意义,其可用于预测心衰患者的生存率[14,16],也可能是评估癌症患者预后的一个潜在指标[17]?在实验中罗布麻叶中剂量组A/G呈现增加趋势,说明小鼠肝功能出现异常,但其他肝功能评价指标并未出现异常,这可能是由于该组小鼠肝功能受到轻微损害等原因造成的?
上述结果说明罗布麻叶对小鼠肝?免疫系统能产生一定的影响,加工后罗布麻茶并不会对小鼠肝?肾?免疫系统等产生不利影响,安全性较高?
采用蒸煮工艺制备的罗布麻茶对小鼠的经口给药安全剂量大于30.0g/kg·bw,属无毒级;小鼠28d喂养试验结果表明,蒸煮工艺制备的罗布麻茶对小鼠体重?脏器重量?脏器指数?血液生化等各项指标与对照组比较差异均无统计学意义,说明制备的罗布麻茶在实验剂量(30g/kg)范围内未见明显毒性反应?
参考文献
[1]国家药典委员会.中国药典(2020版,一部)[S].北京:中国医药科技出版社,2020.
[2]王同为,米慧佳,卢刘欣,等.基于网络药理学探究罗布麻治疗非酒精性脂肪肝的作用机制[J].广东化工,2023,50(9):64-66.
[3]何伟,王莉,刘磊,等.罗布麻茶改善睡眠功能实验研究[J].世界中医药,2022,17(23):3356-3359.
[4]王飞,李祥婷,徐莉莉,等.罗布麻的抗衰老作用机制研究[J].中国临床医学,2022,29(4):596-602.
[5]李富利,张爱文,巨名飞.基于网络药理学探讨罗布麻叶抗动脉粥样硬化的作用机制[J].现代中西医结合杂志,2022,31(12):1709-1717.
[6]何伟,王莉,黄景凤,等.罗布麻叶水提物镇静催眠作用研究[J].药物评价研究,2022,45(2):274-280.
[7]杨杰,付慧,张晋,等.罗布麻提取物改善小鼠高脂饮食诱导的代谢失调与肠道菌群紊乱[J].陆军军医大学学报,2022,44(3):266-274.
[8]张健强.罗布麻多酚对脑损伤小鼠认知和氧化应激的影响[J].当代医学,2021,27(30):77-80.
[9]徐莉莉,李祥婷,张雯,等.基于网络药理学和分子对接研究罗布麻抗抑郁机制[J].中成药,2022,44(3):995-999.
[10]许泽恭,祝晨蔯,周玖瑶,等.基于网络药理学和分子对接探究罗布麻叶抗高脂血症的作用机制[J].中药新药与临床药理,2021,32(8):1154-1163.
[11]戴伟,尹进,胡余明.罗布麻茶对高血压病人的临床观察[J].实用预防医学,2010,17(7):1357-1359.
[12]李立,王秋水,陈东方,等.罗布麻茶毒理学安全性评价[J].实用预防医学,2010,17(10):2081-2084.
[13]郭瑜,何伟,罗福祥,等.罗布红麻提取物单次给药及20天亚急性毒性实验研究[J].新疆医学,2019,49(8):770-773.
[14]董素素,王天立,邹叶强,等.白球比?血红蛋白对慢性阻塞性肺疾病急性加重期患者机械通气?住院时间的预测价值[J].中国现代医药杂志,2023,25(10):54-58.
[15]Epstein FH,Gabay C,Kushner I.Acute-phase proteins and other systemic responses to inflammation[J].N Engl J Med,1999,340(6):448-454.
[16]Li K,Fu W,Bo Y,et al.Effect of albumin-globulin score and albumin to globulin ratio on survival in patients with heart failure:a retrospective cohort study in China[J].Bmj Open,2018,8(7):e022960.
[17]Chi J,Xie Q,Jia J,et al.Prognostic value of albumin/globulin ratio in survival and lymph node metastasis in patients with cancer:A systematic review and meta-analysis[J].J Cancer,2018,9(13):2341-2348.
文章摘自:李兴泉,申艺琳,苗静.蒸煮工艺制罗布麻茶安全性评价[J].毒理学杂志,2025,39(04):300-302.DOI:10.16421/j.cnki.1002-3127.2025.04.006.