摘 要:本发明提出了一种高α-亚麻酸的制备方法及其应用,涉及医药技术领域。包括:选取紫苏籽种子进行清洗、干燥后,在保护气氛下进行机械研磨,随后过滤得到紫苏籽粗油;在保护气氛下将所述紫苏籽粗油进行脱胶、脱酸、脱色、脱蜡处理,得到初步富集的α-亚麻酸粗油;将所述初步富集的紫苏籽油分别经超临界CO2萃取、酶法分子蒸馏、制备色谱分离后,得到高α-亚麻酸。此方法通过对紫苏籽种子进行多级处理,并且经由超临界CO2萃取、酶法分子蒸馏、制备色谱分离三个步骤逐层进行萃取提炼,能够有效去除紫苏籽粗油中的游离脂肪酸,并对α-亚麻酸进行富集,得到纯度高于96%的高α-亚麻酸,适用于医药领域批量化生产。
权利要求书
1.一种高α-亚麻酸的制备方法,其特征在于,包括如下步骤:
S1:原料预处理,选取紫苏籽种子进行清洗、干燥后,在保护气氛下进行机械研磨,随后过滤得到紫苏籽粗油;
S2:粗油精炼,在保护气氛下将所述紫苏籽粗油进行脱胶、脱酸、脱色、脱蜡处理,得到初步富集的α-亚麻酸粗油;
S3:将所述初步富集的α-亚麻酸粗油分别经超临界CO2萃取、酶法分子蒸馏、制备色谱分离后,得到高α-亚麻酸。
2.根据权利要求1所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S1中,所述机械研磨过程中,需在所述紫苏籽种子中加入浓度为0.01-0.05%的植酸,且所述机械研磨过程需在20-40℃的条件下进行;所述过滤方式为硅藻土和/或离子膜过滤。
3.根据权利要求1所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S2中,所述脱胶方式采用酶法脱胶,所述酶法脱胶的反应时间为1-2h,反应温度为40-60℃。
4.根据权利要求3所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S2中,所述脱酸方式为在保护气氛下进行分子蒸馏脱酸,蒸馏温度为120-150℃,反应时间为10-20min,蒸馏后得到的脱酸油加入吸附剂和迷迭香提取物,搅拌20-40min进行脱色,随后过滤得到脱色油。
5.根据权利要求4所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S2中,所述脱蜡方式为先将所述脱色油缓慢冷却至5-10℃,保温4-6h使其结晶化,进一步降温至0-4℃,保温12-20h,使结晶体增大;之后在0-5℃的温度下进行压缩过滤,得到含α-亚麻酸的液态油,随后立即将所述液态油升温至15-20℃,避免二次结晶,以此得到所述α-亚麻酸粗油。
6.根据权利要求5所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S3中,先在所述α-亚麻酸粗油中加入5-10%的乙醇和/或甲醇-KOH溶剂,混合后放入超临界萃取釜中,在压力为300-400bar、温度为30-40℃、C02流速为20-40L/h的条件下反应1-3h,得到α-亚麻酸初级精油。
7.根据权利要求6所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S3中,将所述α-亚麻酸初级精油按照油水比为1:(0.5-0.8)的比例混合,加入质量分数为2-5w%的固定化脂肪酶和5-8w%的甘油,在40-50℃的条件下混合搅拌6-8h,得到酶解液;随后将所述酶解液离心分离,取离心后的游离脂肪酸混合液,按1:(1-1.5)的比例加入乙醇,再加入质量分数为5-8w%的选择性脂肪酶,在30-40℃下反应4-6h,再次离心分离,得到α-亚麻酸—游离脂肪酸混合液;
在所述α-亚麻酸—游离脂肪酸混合液中按1:(1-3)的比例加入甲醇,再加入质量分数为2-5w%的浓硫酸进行催化反应2-4h,得到脂肪酸甲酯混合液,随后对其进行三次短程蒸馏,得到α-亚麻酸次级精油,在α-亚麻酸次级精油中加入复合抗氧化剂,保存。
8.根据权利要求7所述的一种高α-亚麻酸的制备方法,其特征在于,步骤S3中,首先选取正己烷、乙腈、甲醇和水按8:5:5:1的比例配置溶剂,混合后置于分液漏斗中,振荡10-30min,静止分层为上相固定液和下相流动液,随后超声脱气20min分离两相,注入制备型色谱柱仪器中;随后将α-亚麻酸次级精油注入上相固定液中溶解,在设定温度为20-25℃、转速为1500-2200rpm、流速为10-20ml/min的条件下启动仪器,依次进样洗脱样品组分,收集富含α-亚麻酸的馏分;收集完毕后将所述富含α-亚麻酸的馏分合并,在保护气氛下进行水浴和浓缩,得到高α-亚麻酸,随后在高α-亚麻酸中加入维生素E,收集后避光冷藏保存。
9.根据权利要求8所述的一种高α-亚麻酸的制备方法,其特征在于,所述保护气氛为氮气或氩气,所述复合抗氧化剂为质量分数为0.01-0.02%的生育酚和0.02-0.03%的抗坏血酸棕榈酸酯。
10.一种高α-亚麻酸的应用,其特征在于,采取如权利要求8所述的制备方法制备的高α-亚麻酸,用于制备富含高α-亚麻酸的口服乳剂;
所述口服乳剂按照质量分数如下的组分合成:高α-亚麻酸10-20%,豆磷脂10-15%,乙二醇1-5%,茶多酚0.1-2%,芳香剂0.5-1%,余量为纯化水。
技术领域
本发明涉及医药技术领域,具体而言,涉及一种高α-亚麻酸的制备方法及其应用。
背景技术
α-亚麻酸(ALA),存在于绿色植物中,是N-3系(又称为ω-3)不饱和脂肪酸类的一种,它是人体所必需的不饱和脂肪酸,其有益于预防和治疗冠心病、糖尿病、类风湿、皮炎症、抑郁症、神经分裂症、痴呆、过敏、哮喘、肾病和慢性塞性肺病等,人体一旦缺乏α-亚麻酸,即会引起机体脂质代谢紊乱,导致免疫力降低、健忘、疲劳、视力减退、动脉粥样硬化等症状的发生。尤其是婴幼儿、青少年如果缺乏α-亚麻酸,就会严重影响其智力和视力的正常发育。α-亚麻酸进入人体后在脱氢酶和碳链延长酶的作用下,在人体代谢中衍生为EPA和DHA和前列腺素的前体物质,具有广泛生理活性和明显药理作用。
现有技术中,α-亚麻酸富集成高α-亚麻酸的方式有尿素包合法、分子蒸馏、低温结晶法和色谱法等。目前工业上绝大部分还是选择的尿素包合法,其成本相对较低,但是在使用过程中,并非所有的α-亚麻酸都能被包合,总会有一定比例的α-亚麻酸混入母液中,对于α-亚麻酸和亚油酸等同为多不饱和脂肪酸的分离效果也有限,以致于最终得率并不高,并且在使用过程中还需要大量使用甲醇/乙醇等有机溶剂,其溶剂回收和废水处理也是一大问题。
中国专利CN105331648A公开了一种高纯度α-亚麻酸单甘酯及其制备方法,其通过脂肪酶的特异性催化功能,将α-亚麻酸富集到单甘脂中。然而,仅通过脂肪酶的特异性催化,得到的是α-亚麻酸—游离脂肪酸混合液(FFA)的混合液,α-亚麻酸的纯度较低。
另外,由于α-亚麻酸是一种含有3个双键的多不饱和脂肪酸,其双键相邻的亚甲基上的氢原子非常活泼,极易被氧气、光照、高温、金属离子(如Fe2+,Cu2+)等因素引发自由基链式反应,导致氧化变质,产生过氧化物、醛类、酮类等有害物质,影响产品质量和安全性。故如何保障α-亚麻酸在富集成高α-亚麻酸过程中的不被氧化,是整个生产过程中的一大挑战。
发明内容
本发明的目的在于提供一种高α-亚麻酸的制备方法,此方法通过对紫苏籽种子进行多级处理,并且经由超临界CO2萃取、酶法分子蒸馏、制备色谱分离三个步骤逐层进行萃取提炼,能够有效去除紫苏籽粗油中的游离脂肪酸,并对α-亚麻酸进行富集,得到纯度高于96%的高α-亚麻酸,适用于医药领域批量化生产。
本发明解决其技术问题是采用以下技术方案来实现的。
一方面,本申请实施例提供一种高α-亚麻酸的制备方法,其特征在于,包括如下步骤:
S1:原料预处理,选取紫苏籽种子进行清洗、干燥后,在保护气氛下进行机械研磨,随后过滤得到紫苏籽粗油;
S2:粗油精炼,在保护气氛下将上述紫苏籽粗油进行脱胶、脱酸、脱色、脱蜡处理,得到初步富集的α-亚麻酸粗油;
S3:将所述初步富集的紫苏籽油分别经超临界CO2萃取、酶法分子蒸馏、制备色谱分离后,得到高α-亚麻酸。
进一步的,步骤S1中,在上述机械研磨过程中,需在上述紫苏籽种子中加入浓度为0.01-0.05%的植酸,且上述机械研磨过程需在20-40℃的条件下进行;所述过滤方式为硅藻土和/或离子膜过滤。
进一步的,步骤S2中,上述脱胶方式采用酶法脱胶,上述酶法脱胶的反应时间为1-2h,反应温度为40-60℃。
进一步的,步骤S2中,上述脱酸方式为在保护气氛下进行分子蒸馏脱酸,蒸馏温度为120-150℃,反应时间为10-20min,蒸馏后得到的脱酸油加入吸附剂和迷迭香提取物,搅拌20-40min进行脱色,随后过滤得到脱色油。
进一步的,步骤S2中,上述脱蜡方式为先将上述脱色油缓慢冷却至5-10℃,保温4-6h使其结晶化,进一步降温至0-4℃,保温12-20h,使结晶体增大;之后在0-5℃的温度下进行压缩过滤,得到含α-亚麻酸的液态油,随后立即将上述液态油升温至15-20℃,避免二次结晶,以此得到上述α-亚麻酸粗油。
进一步的,步骤S3中,先在上述α-亚麻酸粗油中加入5-10%的乙醇和/或甲醇-KOH溶剂,混合后放入超临界萃取釜中,在压力为300-400bar、温度为30-40℃、C02流速为20-40L/h的条件下反应1-3h,得到α-亚麻酸初级精油。
进一步的,步骤S3中,将上述α-亚麻酸初级精油按照油水比为1:(0.5-0.8)的比例混合,加入质量分数为2-5w%的固定化脂肪酶和5-8w%的甘油,在40-50℃的条件下混合搅拌6-8h,得到酶解液;随后将上述酶解液离心分离,取离心后的游离脂肪酸混合液,按1:(1-1.5)的比例加入乙醇,再加入质量分数为5-8w%的选择性脂肪酶,在30-40℃下反应4-6h,再次离心分离,得到α-亚麻酸—游离脂肪酸混合液;
在上述α-亚麻酸—游离脂肪酸混合液中按1:(1-3)的比例加入甲醇,再加入质量分数为2-5w%的浓硫酸进行催化反应2-4h,得到脂肪酸甲酯混合液,随后对其进行三次短程蒸馏,得到α-亚麻酸次级精油,在α-亚麻酸次级精油中加入复合抗氧化剂,保存。
进一步的,步骤S3中,首先选取正己烷、乙腈、甲醇和水按8:5:5:1的比例配置溶剂,混合后置于分液漏斗中,振荡10-30min,静止分层为上相固定液和下相流动液,随后超声脱气20min分离两相,注入制备型色谱柱仪器中;随后将上述α-亚麻酸次级精油注入上相固定液中溶解,在设定温度为20-25℃、转速为1500-2200rpm、流速为10-20ml/min的条件下启动仪器,依次进样洗脱样品组分,收集富含α-亚麻酸的馏分;收集完毕后将所述富含α-亚麻酸的馏分合并,在保护气氛下进行水浴和浓缩,得到高α-亚麻酸,随后在高α-亚麻酸中加入维生素E,收集后避光冷藏保存。
进一步的,上述保护气氛为氮气或氩气,上述复合抗氧化剂为质量分数为0.01-0.02%的生育酚和0.02-0.03%的抗坏血酸棕榈酸酯。
本发明另一个实施例提供高α-亚麻酸的应用,包括制备一种富含高α-亚麻酸的口服乳剂,其含有如用本发明实施例中提供的制备方法制备而成的高α-亚麻酸,并按照质量分数如下的组分合成:高α-亚麻酸10-20%,豆磷脂10-15%,乙二醇1-5%,茶多酚0.1-2%,芳香剂0.5-1%,余量为纯化水。
相对于现有技术,本发明的实施例至少具有如下优点或有益效果:
1.本发明通过对紫苏籽种子进行多级处理,并且经由超临界CO2萃取、酶法分子蒸馏、制备色谱分离三个步骤逐层进行萃取提炼,能够有效去除紫苏籽粗油中的游离脂肪酸,并对α-亚麻酸进行富集,得到纯度高于96%的高α-亚麻酸,适用于医药领域批量化生产。
2.本发明通过在生产制备的各个环节中添加不同的抗氧化剂和在保护气氛下进行工作,可以保障α-亚麻酸在由原料研磨到富集保存的整个环节中不因氧化变质,提高了高α-亚麻酸的成品质量和安全性。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
一方面,本申请实施例提供一种高α-亚麻酸的制备方法,其特征在于,包括如下步骤:
S1:原料预处理,选取紫苏籽种子在10℃下反复清洗、去除杂质,随后捞出后风干,加入浓度为0.01-0.05%的植酸,一并放入研磨皿中,随后将其密闭,充满氮气或者氩气,在20-40℃下充分研磨2-3h,待其完全磨碎后,采用硅藻土和/或离子膜过滤掉残渣,得到紫苏籽粗油;
S2:粗油精炼,此环节需要在充满氮气的环境下进行,包括:
首先将上述紫苏籽粗油置于充满氮气的密闭环境中,将其加热至40-50℃,随后加入30-50ppm的磷脂酶,用0.01-0.02%的柠檬酸调节PH至4.5-5.0,静止反应1-2h后,升温至75-80℃灭酶,随后进行离心分离,得到脱胶油,此步骤可以去除紫苏籽粗油中的磷脂、胶质和微量的Fe2+、Mg2+;
需要说明的是,在升温环节中,为了避免高温破坏α-亚麻酸的分子结构,加热时间不可过长,每次加热时间保持在3-5min内即可,柠檬酸在此步骤中还可以作为金属螯合剂防止高温催化氧化α-亚麻酸。
进一步的,将上述脱胶油放入短程分子蒸馏设备,在真空度<0.5Pa、蒸馏温度为120-150℃的情况下进行蒸馏,此步骤可以将部分游离脂肪酸和低沸点杂质蒸发至冷凝器,α-亚麻酸混合油脂作为馏余物(脱酸油)收集;然后在脱酸油中加入1-2w%的活性白土、0.1-0.5w%的活性炭以及0.1w%的m迷迭香提取物,充分搅拌20-40min,以此吸附脱酸油中的色素、磷脂、多环芳烃和异味等,迷迭香提取物保护α-亚麻酸在搅拌过程中不被氧化。搅拌完成后,将混合液冷却至常温,随后通过板框压滤机过滤掉活性炭和活性白土,得到的脱色油进行充氮保护。
需要注意的是,在此步骤中,由于蒸馏的温度抵近α-亚麻酸的耐热性极限,故蒸馏温度不可超过150℃,并且需要精准控制加热时间,每次加热时间不能超过30秒。
进一步的,将脱色油进行低温处理,缓慢(0.5℃/min)冷却至5-10℃,随后保持此温度4-6h,使脱色油结晶化。待观察到产生小块结晶体之后,进一步降温至0-4℃,保温12-20h,使结晶体进一步增大,待结晶体成块状后,采用带冷却夹层的板框压滤机在0-5℃下对结晶体进行压缩过滤,压缩过滤过程中可以采用0.1%的硅藻土进行助滤,得到的滤液为含α-亚麻酸的液态油;压缩过滤完成后,立刻将液态油升温至15-20℃,避免低温引起的二次结晶,以此得到α-亚麻酸粗油。此步骤可以去除高熔点饱和脂肪酸甘油酯、蜡质,显著提高α-亚麻酸在混合油中的比例。
S3:将上述初步富集的α-亚麻酸粗油经超临界CO2萃取、酶法分子蒸馏、制备色谱分离三个步骤逐层进行萃取提炼,进一步去除α-亚麻酸粗油中的游离脂肪酸,并对α-亚麻酸进行富集,包括:
先在上述α-亚麻酸粗油中加入5-10%的乙醇和/或甲醇-KOH溶剂,充分搅拌30min,混合均匀后放入超临界萃取釜中,在压力为300-400bar、温度为30-40℃、C02流速为20-40L/h的条件下反应1-3h,得到α-亚麻酸初级精油。
进一步的,将上述α-亚麻酸初级精油按照油、水比为1:(0.5-0.8)的比例混合,加入质量分数为2-5w%的固定化脂肪酶(例如NovozymR435)和5-8w%的甘油,将其放置于恒温搅拌反应釜中,在40-50℃的条件下混合搅拌6-8h,以此方式将α-亚麻酸初级精油进行水解,得到酶解液;随后将上述酶解液放于碟片式离心机中进行离心分离,然后静置分层,上层为游离脂肪酸混合液,下层则为甘油和水;取离心后的游离脂肪酸混合液,按摩尔比为1:(1-1.5)的比例加入乙醇,再加入质量分数为5-8w%的选择性脂肪酶(例如LipozymeRRM IM),在30-40℃下反应4-6h,再次离心分离,上层则为α-亚麻酸—游离脂肪酸混合液,下层则为分离出来的饱和脂肪酸;
在上述α-亚麻酸—游离脂肪酸混合液中按1:(1-3)的比例加入甲醇,再加入质量分数为2-5w%的浓硫酸进行催化反应2-4h,得到脂肪酸甲酯混合液,随后利用连续性分子蒸馏机组对其进行三次短程蒸馏,得到α-亚麻酸次级精油,在α-亚麻酸次级精油中加入质量分数为0.01-0.02%的生育酚和0.02-0.03%的抗坏血酸棕榈酸酯,保存;
需要说明的是,此步骤全程需要氮气覆盖处理,避免α-亚麻酸氧化。加入5-8w%的甘油可以进一步抑制α-亚麻酸酯化。另外,在此步骤中,三次短程蒸馏分别包括:
①在70℃、100Pa的条件下蒸馏10min,移除脂肪酸甲酯混合液中的水分、残留的甲醇和短链脂肪酸酯;
②在100℃,10Pa的条件下蒸馏5min,进一步移除脂肪酸甲酯混合液中的的油酸甲酯和亚油酸甲酯;
③在150摄氏度,0.5Pa的条件下多次蒸馏,每次蒸馏30S,得到α-亚麻酸次级精油。
进一步的,首先选取正己烷、乙腈、甲醇和水按8:5:5:1的比例配置溶剂,混合后置于分液漏斗中,振荡10-30min,静止分层为上相固定液和下相流动液,随后超声脱气20min分离两相,注入制备型色谱柱仪器中;随后将α-亚麻酸次级精油注入上相固定液中溶解,在设定温度为20-25℃、转速为1500-2200rpm、流速为10-20ml/min的条件下启动仪器,依次进样洗脱样品组分,收集富含α-亚麻酸的馏分;收集完毕后将上述富含α-亚麻酸的馏分合并,在氮气覆盖的真空条件下,先加入质量分数为10%的KOH-乙醇溶液,在60℃的条件下水解1h,随后加入浓HCl调节ph至2.0,再加入乙醚进行振荡1h,以此萃取剩余的游离脂肪酸,最后加入无水Na2SO4,进行多次水洗,浓缩,即可得到高α-亚麻酸,随后在高α-亚麻酸中加入维生素E,收集后避光冷藏保存。
可选的,此步骤也可以进行工业化放大生产,例如采用动态轴向压缩柱联用系统可以实现1kg/日的通量,实现批量化生产。
本发明另一个实施例提供一种富含高α-亚麻酸的口服乳剂,其含有如用本发明实施例中提供的制备方法制备而成的高α-亚麻酸,并按照质量分数如下的组分合成:高α-亚麻酸10-20%,豆磷脂10-15%,乙二醇1-5%,茶多酚0.1-2%,芳香剂0.5-1%,余量为纯化水。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例中,依据上述实验方法,具体表现为:
1)选取紫苏籽种子,在10℃下反复清洗、去除杂质,随后捞出后风干、称重,然后加入浓度为0.02%的植酸,一并放入研磨皿中,随后将其密闭,充满氮气,在20℃下充分研磨2h,待其完全磨碎后,采用离子膜过滤掉残渣,得到紫苏籽粗油;
将上述紫苏籽粗油置于充满氮气的密闭环境中,加热至40℃,随后加入30ppm的磷脂酶,用0.01%的柠檬酸调节PH至5.0,静止反应1h后,升温至75℃、每次加热时间3min、灭酶,随后进行离心分离,得到脱胶油,此步骤可以去除紫苏籽粗油中的磷脂、胶质和微量的Fe2+、Mg2+;
2)将上述脱胶油放入短程分子蒸馏设备,在真空度0.4Pa、蒸馏温度为120℃的情况下进行蒸馏,此步骤可以将部分游离脂肪酸和低沸点杂质蒸发至冷凝器,α-亚麻酸混合油脂作为馏余物(脱酸油)收集;然后在脱酸油中加入1w%的活性白土、0.1w%的活性炭以及0.1w%的迷迭香提取物,充分搅拌30min,以此吸附脱酸油中的色素、磷脂、多环芳烃和异味等,迷迭香提取物保护α-亚麻酸在搅拌过程中不被氧化。搅拌完成后,将混合液冷却至常温,随后通过板框压滤机过滤掉活性炭和活性白土,得到的脱色油进行充氮保护。
在此步骤中,蒸馏温度为140℃,并且需要精准控制加热时间,每次加热时间不能超过30秒。
3)将脱色油进行低温处理,以降低0.5℃/min的速率缓慢冷却至5℃,随后保持此温度4h,使脱色油结晶化。待观察到产生小块结晶体之后,进一步降温至0℃,保温12h,使结晶体进一步增大,待结晶体成块状后,采用带冷却夹层的板框压滤机在3℃下对结晶体进行压缩过滤,压缩过滤过程中可以采用0.1%的硅藻土进行助滤,得到的滤液为含α-亚麻酸的液态油;压缩过滤完成后,立刻将液态油升温至20℃,避免低温引起的二次结晶,以此得到α-亚麻酸粗油。此步骤可以去除高熔点饱和脂肪酸甘油酯、蜡质,显著提高α-亚麻酸在混合油中的比例。
4)先在上述α-亚麻酸粗油中加入5%的乙醇,充分搅拌30min,混合均匀后放入超临界萃取釜中,在压力为300bar、温度为30℃、C02流速为20L/h的条件下反应1h,得到α-亚麻酸初级精油,然后按照索氏提取法(GB/T5009.6-2016)标准执行,准确称取α-亚麻酸初级精油的质量,然后按公式

计算紫苏籽油的提取率,结果如表1所示;
5)将上述α-亚麻酸初级精油按照油、水比为1:0.5的比例混合,加入质量分数为2w%的固定化脂肪酶(例如NovozymR435)和5w%的甘油,将其放置于恒温搅拌反应釜中,在40℃的条件下混合搅拌6h,以此方式将α-亚麻酸初级精油进行水解,得到酶解液;随后将上述酶解液放于碟片式离心机中进行离心分离,然后静置分层,上层为游离脂肪酸混合液,下层则为甘油和水;取离心后的游离脂肪酸混合液,按摩尔比为1:1的比例加入乙醇,再加入质量分数为5w%的选择性脂肪酶(例如LipozymeRRM IM),在30℃下反应4h,再次离心分离,上层则为α-亚麻酸—游离脂肪酸混合液,下层则为分离出来的饱和脂肪酸;
在上述α-亚麻酸—游离脂肪酸混合液中按1:1的比例加入甲醇,再加入质量分数为2w%的浓硫酸进行催化反应2h,得到脂肪酸甲酯混合液,随后利用连续性分子蒸馏机组对其进行三次短程蒸馏,得到α-亚麻酸次级精油,在α-亚麻酸次级精油中加入质量分数为0.01-0.02%的生育酚和0.02-0.03%的抗坏血酸棕榈酸酯,保存;
在此步骤中,三次短程蒸馏分别包括:
①在70℃、100Pa的条件下蒸馏10min,移除脂肪酸甲酯混合液中的水分、残留的甲醇和短链脂肪酸酯;
②在100℃,10Pa的条件下蒸馏5min,进一步移除脂肪酸甲酯混合液中的的油酸甲酯和亚油酸甲酯;
③在150摄氏度,0.5Pa的条件下多次蒸馏,每次蒸馏30S,得到α-亚麻酸次级精油。
6)首先选取正己烷、乙腈、甲醇和水按8:5:5:1的比例配置溶剂,混合后置于分液漏斗中,振荡10min,静止分层为上相固定液和下相流动液,随后超声脱气20min分离两相,注入制备型色谱柱仪器中;随后将α-亚麻酸次级精油注入上相固定液中溶解,在设定温度为20℃、转速为1500rpm、流速为10ml/min的条件下启动仪器,依次进样洗脱样品组分,收集富含α-亚麻酸的馏分;收集完毕后将上述富含α-亚麻酸的馏分合并,在氮气覆盖的真空条件下,先加入质量分数为10%的KOH-乙醇溶液,在60℃的条件下水解1h,随后加入浓HCl调节ph至2.0,再加入乙醚进行振荡1h,以此萃取剩余的游离脂肪酸,最后加入无水Na2SO4,进行多次水洗,浓缩,即可得到高α-亚麻酸,随后在高α-亚麻酸中加入维生素E,收集后避光冷藏保存。
此步骤中,待收集完富含α-亚麻酸的馏分,统计反应所需时间。
另外,在实验过程中,分别采取步骤4)-步骤6)中得到的α-亚麻酸初级精油、α-亚麻酸次级精油和高α-亚麻酸样品,利用GC-FID(CP-Sil 88柱)来测定α-亚麻酸的纯度,具体结果如表2所示。
实施例2
本实施例和实施例1步骤1)-步骤3)均相同,区别仅在于,步骤4)-步骤6)的实验参数不同,具体表现为:
步骤4)中,超临界反应釜的压力为320bar,温度32℃,C02流速为24L/h的条件下反应1.5h;
步骤5)中,选择的固定化脂肪酶(例如NovozymR435)质量分数为3w%、甘油为6w%,在42℃的条件下搅拌6.5h得到酶解液;选择的选择性脂肪酶(例如LipozymeRRM IM)质量分数为6w%,在32℃下反应4.5h;
步骤6)中,在设定温度为21℃、转速为1700rpm、流速为12ml/min,其余均一致。
实施例3
本实施例和实施例1步骤1)-步骤3)均相同,区别仅在于,步骤4)-步骤6)的实验参数不同,具体表现为:
步骤4)中,超临界反应釜的压力为340bar,温度34℃,C02流速为28L/h的条件下反应2h;
步骤5)中,选择的固定化脂肪酶(例如NovozymR435)质量分数为4w%、甘油为7w%,在44℃的条件下搅拌7h得到酶解液;选择的选择性脂肪酶(例如LipozymeRRM IM)质量分数为7w%,在34℃下反应5h;
步骤6)中,在设定温度为22℃、转速为1900rpm、流速为14ml/min,其余均一致。
实施例4
本实施例和实施例1步骤1)-步骤3)均相同,区别仅在于,步骤4)-步骤6)的实验参数不同,具体表现为:
步骤4)中,超临界反应釜的压力为360bar,温度36℃,C02流速为32L/h的条件下反应2.5h;
步骤5)中,选择的固定化脂肪酶(例如NovozymR435)质量分数为5w%、甘油为8w%,在46℃的条件下搅拌7.5h得到酶解液;选择的选择性脂肪酶(例如LipozymeRRM IM)质量分数为8w%,在36℃下反应5.5h;
步骤6)中,在设定温度为24℃、转速为2100rpm、流速为16ml/min,其余均一致。
实施例5
本实施例和实施例1步骤1)-步骤3)均相同,区别仅在于,步骤4)-步骤6)的实验参数不同,具体表现为:
步骤4)中,超临界反应釜的压力为400bar,温度40℃,C02流速为40L/h的条件下反应3h;
步骤5)中,选择的固定化脂肪酶(例如NovozymR435)质量分数为5w%、甘油为8w%,在50℃的条件下搅拌8h得到酶解液;选择的选择性脂肪酶(例如LipozymeRRM IM)质量分数为8w%,在36℃下反应6h;
步骤6)中,在设定温度为24℃、转速为2100rpm、流速为16ml/min,其余均一致。
对照例
本对照例和实施例1-5的区别在于,步骤6)中,选取市面上购买的纯度为96%的α-亚麻酸试剂,采用GC-FID(CP-Sil 88柱)来测定其α-亚麻酸的纯度。
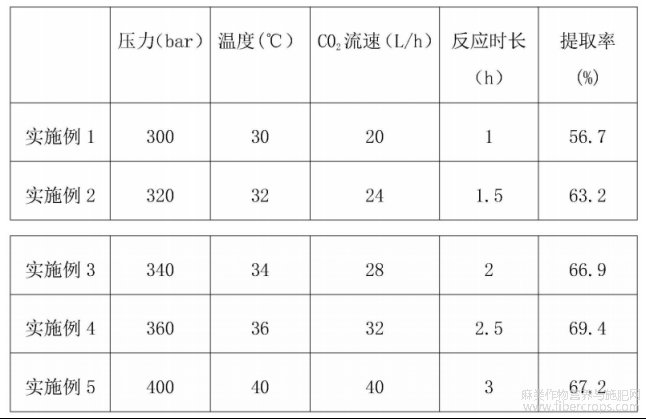
表1 紫苏籽油的提取率
根据表1可以看出,在进行超临界CO2萃取过程中,紫苏籽油的提取率会先随着压力、温度和C02流速和反应时间的增加而先上升后降低,并非是一直上升,故超临界CO2萃取反应条件选取超临界反应釜的压力为360bar,温度36℃,C02流速为32L/h的条件下反应2.5h为宜。
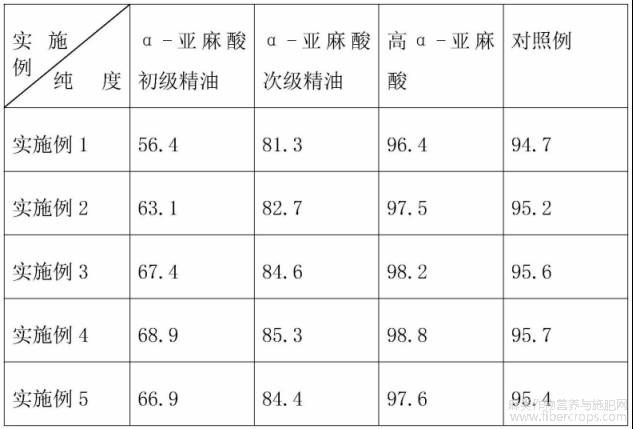
表2 α-亚麻酸的纯度
根据表2可知,合成制备的高α-亚麻酸的纯度达到了96%以上,符合医用生产标准。制备色谱分离过程中的参数对α-亚麻酸的富集过程影响不大。
本发明另一个实施例提供一种富含高α-亚麻酸的口服乳剂,其含有如用本发明实施例中提供的制备方法制备而成的高α-亚麻酸,并按照质量分数如下的组分合成:高α-亚麻酸10-20%,豆磷脂10-15%,乙二醇1-5%,茶多酚0.1-2%,芳香剂0.5-1%,余量为纯化水。其具体制备步骤可以参考CN107441217A,此处不再额外赘述。
综上所述,本发明提供了一种高α-亚麻酸的制备方法及其应用,其通过对紫苏籽种子进行多级处理,并且经由超临界CO2萃取、酶法分子蒸馏、制备色谱分离三个步骤逐层进行萃取提炼,能够有效去除紫苏籽粗油中的游离脂肪酸,并对α-亚麻酸进行富集,得到纯度高于96%的高α-亚麻酸,适用于医药领域批量化生产;
另外,本发明通过在生产制备的各个环节中添加不同的抗氧化剂和在保护气氛下进行工作,可以保障α-亚麻酸在由原料研磨到富集保存的整个环节中不因氧化变质,提高了高α-亚麻酸的成品质量和安全性。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
文章摘自国家发明专利,一种高α-亚麻酸的制备方法及其应用,发明人:郭书铭,丁艳霞,胡梦涵,申请号:202510788745.7,申请日:2025.06.13。