摘 要:为了探讨褪黑素(MT)对干旱胁迫下罗布麻(Apocynum venetum)种子萌发和幼苗生长的影响,使用不同浓度(0?20?40?60?80?100?200μmol/L)的MT分别浸种罗布麻种子0?3?6?9 h后,在15%PEG-6000胁迫下研究MT对罗布麻种子发芽指标(发芽率?发芽势?发芽指数?活力指数)及幼苗茎长?根长和鲜质量的影响?结果表明:1)MT对种子发芽率和发芽势具有抑制作用;2)使用100μmol/L的MT浸种9h能提高种子发芽指数而且能显著提高种子活力指数(P<0.05),并提高种子茎长,另外使用100μmol/L的MT浸种9h处理下的种子根长和鲜质量达到最大值?结果表明:使用100μmol/L的MT浸种9h处理能有效提高种子发芽指数?活力指数?茎长?根长和鲜质量,该处理可以促进罗布麻幼苗的生长发育和生物量的积累?提高罗布麻抵御干旱胁迫的能力?本实验为罗布麻逆境高产和抗逆减灾技术提供借鉴,为荒漠地区罗布麻的种植和生态修复提供参考价值?
关键词:褪黑素;罗布麻;Apocynum venetum;干旱胁迫;萌发指标;幼苗生长
干旱是影响植物生长和发育的主要环境因子之一[1],具有发生频率大、受旱面积广、区域变化明显等特点[2]。相关统计数据表明,我国干旱受灾面积在全国受灾总面积中占比高达56.6%,这一数据充分凸显出我国干旱灾害相较于其他自然灾害所产生的影响更为突出[3]。我国西北干旱区由于其远离海洋且深居大陆内部的特殊地理区位,呈现出降水稀缺、蒸发旺盛的特征,是我国沙漠化问题最为严峻的区域之一[4]。干旱作为一种隐伏于地表的生态胁迫过程,能对农作物的生长构成直接威胁[5],并通过水文—土壤—植被—生物链的级联效应,对区域生态系统产生多维胁迫。具体表现为:土壤含水率低于作物水分临界阈值,引发物理结构劣化与化学肥力衰退,形成植被群落逆向演替的环境驱动机制。这一过程导致以特定植被为生态位基础的物种面临栖息地碎片化乃至丧失风险,引发生物多样性指数显著下降。故而,干旱区沙漠化的防治工作显得极为关键。生物措施乃是防治沙漠化的主要手段之一,而在生物措施实施过程中,耐旱植物的运用较为广泛,所以深入探究如何增强植物的抗旱性具有极为深远的意义[6]。
浸种作为种子预处理的一种重要途径,其主要原理在于提升种子的含水率,以此助力种子突破休眠的禁锢,开启萌发进程。值得注意的是,不同的浸种方式以及浸种时长对种子所产生的作用效果存在显著差异[7-8]。浸种方式与浸种时长在针对同一种子所产生的主导作用方面亦可能存在差异。以花椒种子为例,碱溶液的类型差异在很大程度上主导着花椒种子的发芽率、发芽指数以及平均发芽时间等关键指标的变化。而浸种时间的长短则主要对花椒种子的发芽势起着决定性的影响作用[9]。在浸种技术的应用范畴中,运用化学药品对植物种子进行浸种处理是较为常见的策略。诸如过氧化氢(H2O2)[10]、5-氨基乙酰丙酸(ALA)[11]以及高锰酸钾(KMnO?)[12]等化学药品均在该领域有着广泛的应用实例。然而,本研究将关注点聚焦于褪黑素溶液浸种处理这一特定方向。褪黑素(N-乙酰-5-甲氧基色胺,MT)又称松果体素,广泛分布于动植物中,能够凭借对多种代谢途径的干预作用,实现对植物抗逆性的精准调节与显著强化,在有效缓解重金属胁迫、干旱胁迫、低温或高温等不利逆境对高等植物所造成的损伤方面具备卓越的性能[13]。基于其易于获取且成本低廉的显著优势,加之其在胁迫环境下能够显著提升种子出苗率的独特效能,MT现已逐步在农业生产实践领域崭露头角并得到日益广泛的应用[14]。已有研究表明,外源MT对番茄果实特性具有多方面有益影响,包括促进果实发育、提升果实品质(如改善色泽、增加硬度、提高营养成分含量等)、增强果实抗逆性(抵御病虫害、适应不良环境等)[15]。同样,针对干旱胁迫下的紫花苜蓿种子,MT浓度、浸种时长以及二者之间的交互作用均能够对其萌发指数产生积极的促进效果[16]。因此,在农业生产实践中,科学筛选外源物质浓度与浸种时长极为关键,只有这样才能发挥其促进种子萌发与幼苗生长的最优效能,为农业高产、优质、可持续发展筑牢根基。
罗布麻(Apocynum venetum)属于夹竹桃科(Apocynaceae),兼具显著的经济与药用价值[17],其突出的耐旱、耐盐、耐冻、耐高温以及抗风沙等生态特性,加之对土壤条件要求并不严苛且不易被风沙完全掩埋,使得罗布麻在生态修复领域独具优势。相较于传统造林方式,罗布麻具有周期短、成活率高、成本低廉且易于管理等优点,能够有效实现改良土壤、调节气候、保持水土以及防风固沙等多重生态功能[18]。由此可见,罗布麻作为一种极为重要的防风固沙植物,对于干旱地区的土壤改良起着关键作用。罗布麻自身具备应对干旱环境的特殊适应机制,在低浓度干旱胁迫条件下,其萌发率、萌发指数以及活力指数反而呈现出促进效应,仅当遭遇高浓度干旱胁迫时才会受到显著抑制[19]。已有研究表明,适宜浓度及浸种时长的MT能够对紫花苜蓿种子萌发起到积极的促进作用[16]。然而,当前针对MT对罗布麻种子影响的研究相对匮乏。鉴于此,本研究使用不同浓度和不同浸种时长的MT浸种干旱胁迫下的罗布麻种子,探究其对罗布麻种子萌发及其幼苗生长的影响,为罗布麻的高效培育筛选出最佳的MT处理方案,提高种子发芽率、幼苗成活率和生长质量,从而为罗布麻的干旱区种植提供参考意见。
1 材料与方法
1.1 实验材料
罗布麻种子购于甘肃省民勤县沙漠魂苗木有限公司(103.17°E,38.62°N,平均海拔1400m)属大陆性沙漠气候,年平均降水量113.2mm;聚乙二醇(PEG-6000)购于天津市光复科技发展有限公司;75%乙醇;褪黑素购于上海源叶生物科技有限公司。
1.2 实验设计
1.2.1 种子处理 于2024年9月24日选择均匀饱满、大小一致、无破损的种子为萌发材料。采用MT浓度(7个梯度)和浸种时长(4个梯度+CK)双因素完全随机区组设计,共29个处理,每个处理重复3次。将参试种子浸种在浓度为0、20、40、60、80、100、200μmol/L的10 mL MT溶液中,浸种时长分别为12、9、6、3、0 h,上午8:00浸种第1组(T12),上午11:00浸种第2组(T9),14:00浸种第3组(T6),17:00浸种第4组(T9),第5组不浸种(CK)。于20:00分别滤出全部种子,用75%乙醇溶液浸种10 min消毒,然后用蒸馏水冲洗两次,以去除试剂残留,用吸水纸吸干表面水分待种。
1.2.2 发芽试验 将浸种处理后的种子均匀播种到放有双层滤纸的培养皿中(直径为9cm),每皿50粒,每个培养皿中加入15%PEG-6000溶液6mL。记录每组培养皿重量取均值,每天同一时间向培养皿中添加蒸馏水达到均值以保证PEG-6000的渗透水势不变。
1.3 测定指标及方法
1.3.1 发芽指标的测定 每天同一时间观察并记录种子的发芽数(目测芽长超过半个种子长认定为发芽),第5d计算种子的发芽势,10d后种子停止萌发,结束试验。统计种子的发芽率等指标。本实验种子的发芽率(GR)、发芽势(GE)、发芽指数(GI)和活力指数(VI)计算方法如下[14]:
GR=第10d发芽种子数/供试种子数×100%
GE=5d内发芽种子数/供试种子数×100%
GI=∑Gt/Dt VI=S×∑Gt/Dt
式中:Gt指时间t的发芽数,Dt指相应的发芽天数;S指芽苗的鲜质量。
1.3.2 生长指标的测定 在第10d发芽结束后对幼苗取样进行生长指标测定。从各培养皿中随机选取10株正常生长的幼苗(不足10株则全部取),用万分之一天平称其幼苗鲜质量,用直尺测定其茎长和根长。
1.4 数据处理
利用Excel 2010软件作柱状图和方差分析的三线表,利用Origin 2021软件作相关性热图,利用SPSS 26.0软件对数据进行统计分析。结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同MT浓度和浸种时长对干旱胁迫下种子发芽的影响
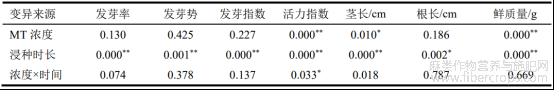
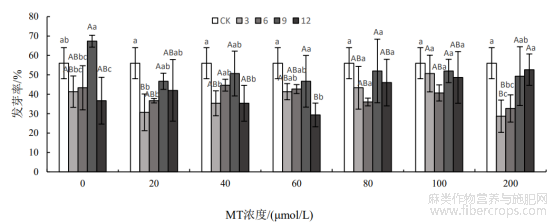
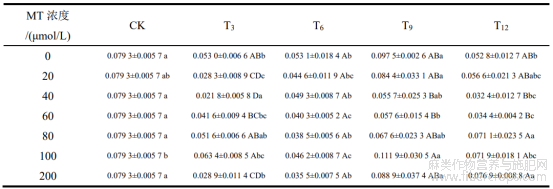
双因素方差分析表明(表1),浸种时长对种子发芽率和发芽势具有显著影响(P<0.05),但MT浓度及其与浸种时长的交互作用对种子发芽率、发芽势无显著影响(P>0.05)。从图1可以看出,除MT浓度为200μmol/L以外,浸种时长为9h的处理均比其余MT浸种过的罗布麻种子发芽率高,这表明使用MT浸种(除MT浓度为200μmol/L外)时浸种时长为9h能促进种子萌发。当MT浓度为200μmol/L时,浸种时长为12h的处理下,出现罗布麻种子发芽率高于其他经MT浸种处理的情况。然而,仅蒸馏水浸种9h时,种子发芽率比CK高11.33%,但差异并不显著(P>0.05)。其余处理的种子发芽率均比CK低。与CK相比,除MT0+T9处理外,其余处理的种子发芽率均有所降低,但差异不显著(P>0.05)。综上所述,MT浸种对罗布麻种子发芽率存在明显的抑制作用。
表1 MT浓度和浸种时长对种子萌发特征指数和生长指标影响的方差分析
注:*表示显著水平(P<0.05);**表示极显著水平(P<0.01)
注:不同大写字母表示相同浸种时长下,不同的MT浓度处理间的差异显著(P<0.05);不同小写字母表示在相同的MT浓度处理下,不同浸种时长间差异显著(P<0.05);每个MT浓度处理组均插入了CK;下同
图1 不同处理组合下罗布麻种子的发芽率
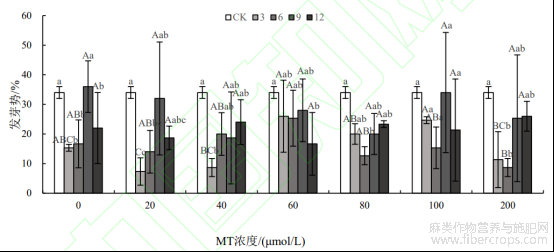
图2 不同处理组合下罗布麻种子的发芽势
从图2可知,不同浓度的MT和浸种时长对种子的发芽势均有不同影响。发芽势的高低可以反映种子质量的优劣,发芽势高的种子表示种子生活力强、生命力旺盛。与发芽率的情况不同,在浸种9h时,不仅有MT200处理下的发芽势低于12h的情况,而且还有MT40处理的发芽势低于6h和12h以及MT80处理下的发芽势低于12h的情况,但上述差异均不显著(P>0.05)。这说明MT40+T9、MT80+T9、MT200+T9处理下的种子活力较差。经过MT100处理后,种子在3、6、9和12h的浸种时长下发芽势差异不显著(P>0.05)。当种子经过MT0(蒸馏水)+T9处理后,种子的发芽势最高,表明此处理下的种子活力最强,但仅比CK提高了2.00%,差异并不显著(P>0.05)。其余处理均比CK的发芽势低,尤其在MT20+T3处理下的种子发芽势比CK降低了26.67%,差异显著(P<0.05)。综上,MT对罗布麻种子的发芽势并无促进作用,反而具有较为明显的抑制。
2.2 不同MT浓度和浸种时长对干旱胁迫下种子发芽指数和活力指数的影响
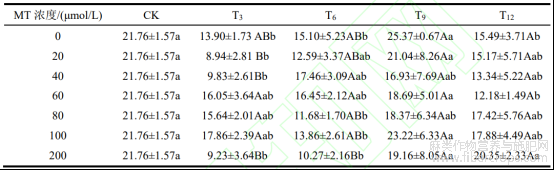
双因素方差分析表明,浸种时长对发芽指数和活力指数均有极显著影响(P<0.01),而且种子活力指数还受MT浓度以及两者交互作用的影响显著(P<0.05),但是种子发芽指数受MT浓度以及两者交互作用影响不显著(P>0.05)(表1)。发芽指数是种子的活力指数,发芽指数越高代表种子有更好的萌发率和成活率。从表2中可以看出,MT0+T9和MT100+T9处理的种子发芽指数高于CK,但仅高出3.61和1.46,差异不显著(P>0.05)。MT0+T9在所有处理中种子的发芽指数最高,代表种子萌发率和成活率最好,同时也说明蒸馏水浸种9h对种子活力有一定促进作用。在使用了MT浸种的所有处理中,浸种9h和12h的发芽指数随MT浓度变化差异不显著(P>0.05)。在浸种9h的处理中(除MT40和MT200),种子发芽指数均高于其他使用MT浸种的,MT40和MT200处理的种子发芽指数虽不是最高但与其差异也不显著(P>0.05)。
表2 罗布麻种子发芽指数的测定结果
注:不同大写字母表示相同浸种时长下,不同的MT浓度处理间的差异显著(P<0.05);不同小写字母表示在相同的MT浓度处理下,不同浸种时长间差异显著(P<0.05);下同
MT浓度、浸种时长以及两者交互作用对罗布麻种子的活力指数均有显著影响(P<0.05),且MT浓度和浸种时长对活力指数有极显著影响(P<0.01)(表1)。从表3中可以看出,MT0+T9、MT20+T9、MT100+T9和MT200+T9处理下的种子活力指数均高于CK,MT100+T9处理与CK差异显著(P<0.05),其余3个处理与CK差异不显著(P>0.05)。说明在MT100+T9处理下显著提高了种子活力指数,对种子产生有利影响。此外,MT100+T9处理的种子活力指数高于MT0+T9处理,尽管两者差异不显著(P>0.05),但仍可说明在浸种9h情况下,MT100能更好提高种子活力。
表3 罗布麻种子活力指数的测定结果
2.3 不同MT浓度和浸种时长对干旱胁迫下种子茎长、根长和鲜质量的影响
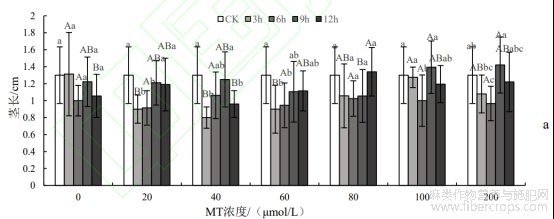
双因素方差分析表明,MT浓度对种子的茎长有显著影响(P<0.05),浸种时长对种子茎长有极显著影响(P<0.01,表1)。从图3a中可以看出,MT0+T3、MT80+T12、MT100+T9和MT200+T9处理下的种子茎长均高于CK,但仅分别提高了1.3%、4%、9.5%、12%,差异不显著(P>0.05)。除MT80外,在所有使用了MT浸种的试验中浸种时长为9h的种子茎长均高于其他MT浸种试验,其中MT200+T9处理下的种子茎长最长。在MT80处理下,浸种时长为12h高于其他值,但差异不显著(P>0.05)。
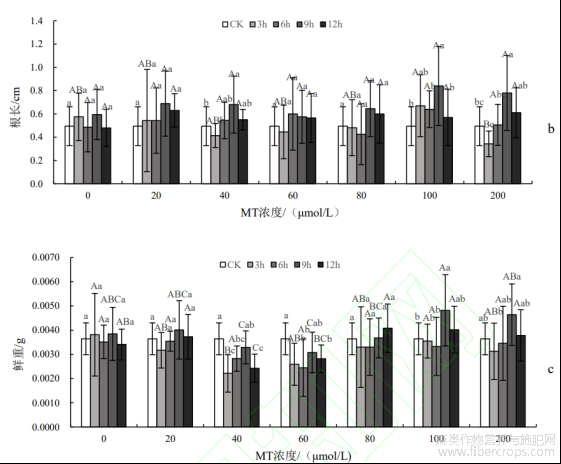
双因素方差分析表明,浸种时长对种子的根长有显著影响(P<0.05),但是种子根长受MT浓度以及两者交互作用影响不显著(P>0.05,表1)。种子根长越长稳定性越强,对水分和养分的吸收能力越强。MT0、MT20、MT60和MT80浸种的处理中,种子根长在不同浸种时长之间差异不显著(P>0.05)(图3b),且各浓度间差异也不显著(P>0.05)。从图3还可知,在MT40+T9、MT100+T9和MT200+T9处理下种子根长分别比CK提高了18.6%、34.6%和28.6%,且差异显著(P<0.05),MT100+T9处理下种子根长达到最大值。这些结果表明,在浸种时长9h下MT处理能有效提高种子根长。
双因素方差分析表明,MT浓度和浸种时长对种子鲜质量均有极显著影响(P<0.01),但两者交互作用对其影响不显著(P>0.05)(表1)。由图3c可知,MT100+T9处理下的种子鲜质量达到最大值,与CK之间差异显著(P<0.05)。在中高浓度MT80、MT100和MT200处理下,种子鲜质量在9h和12h均高于CK,在中低浓度MT40和MT60处理下,种子鲜质量在所有浸种时长下均低于CK,在蒸馏水和MT20处理下,种子鲜质量与CK变化不明显,说明中高浓度MT80、MT100和MT200处理在浸种时长为在9h和12h能提高种子鲜质量,有利于种子正常生长,中低浓度MT40和MT60处理会抑制种子生长,蒸馏水和MT20处理对种子基本无影响。
图3 罗布麻茎长、根长和鲜质量的测定结果
2.4 罗布麻种子各测定指标间的相关性分析
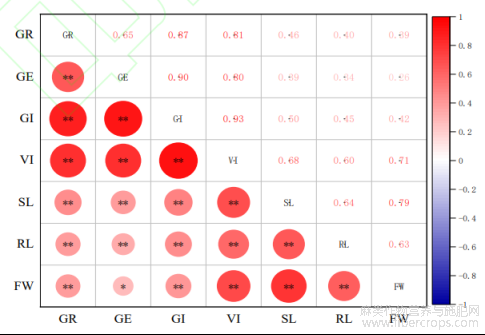
注:SL表示茎长;RL表示根长;FW表示鲜质量;**P<0.01表示极显著相关;*P<0.05表示显著相关
图4 罗布麻种子各测定指标间的相关性分析
在罗布麻各测定指标的相关性分析中(图4),可以看出所有指标之间均呈现正相关,除GE与FW之间呈现显著正相关,相关系数为0.26外,其余各指标之间均呈现极显著正相关。
3 讨论
3.1 浸种时长对种子发芽和幼苗生长的影响
基于清水浸种所建立的种子生理活性初步启动的基础[20],采用MT浸种有望在清水浸种的基础上,进一步通过其独特的调节机制,如调节植物体内的激素代谢[21]、增强抗氧化系统活性[22]、调控基因表达[23]等,对种子萌发和幼苗生长产生更为精细和高效的调控作用。俞龙生等[24]采用200mg/L的赤霉素和蒸馏水分别浸种猪屎豆(Crotalaria pallida)、黄槐决明(Cassia surattensis)种子,发现使用赤霉素浸种12h猪屎豆种子能显著促进种子萌发,并对幼苗生长有一定的促进作用,使用赤霉素浸种24h对黄槐决明种子萌发也有一定促进效果,但是赤霉素浸种36h后对黄槐决明苗长和根长的促进效果最好。本研究中发现MT浸种3、6、9、12h均抑制了罗布麻种子萌发,这与于奇等[25]、李冬等[26]和雷新慧等[27]研究结果不一致,原因可能是由于供试物种不同导致。此外,从整体情况来看,本实验中,与其他浸种时长相比,浸种9 h能较好促进幼苗生长发育,这与肖珍珍等[28]的研究结果相似,但由于供试种子不同,导致MT最佳浸种时间不同。
3.2 浸种浓度对种子发芽和幼苗生长的影响
聂必林等[29]研究表明,0.1mmol/L MT对中性复合盐胁迫的黑果枸杞种子发芽和幼苗生长促进效果最佳,0.3mmol/L MT则对中度和重度碱性复合盐胁迫的黑果枸杞种子发芽和幼苗生长有最佳促进效果。雷新慧等[27]使用浓度为200μmol/L的MT浸种不同盐浓度胁迫下的荞麦种子,发现MT浸种荞麦种子可有效缓解盐胁迫危害,促进种子发芽及幼苗生长。王宁宁等[30]采用不同浓度的MT对油莎豆种子进行浸种,结果显示50~150μmol/L MT浸种对盐、旱胁迫下油莎豆种子的萌发和幼苗生长有促进作用,200~250μmol/L MT浸种则抑制种子萌发和幼苗生长。在本试验中,所有MT浓度均抑制了种子发芽率和发芽势,具有抑制种子发芽的效果,这与上述研究结论相悖,究其原因可能是不同物种对MT溶液的需求量不同,未来还需进一步增加更多MT浓度来处理种子。但是,在本实验中,从整体看100μmol/L的MT为促进幼苗生长发育的最佳浓度,这与梁佳等[31]和尉欣荣等[32]研究结果相似。MT不同浓度对植物种子萌发和幼苗生长发育的影响情况与作用机理还有待进一步研究。
3.3 浸种时长和浸种浓度交互作用对种子发芽和幼苗生长的影响
非生物胁迫通过恶化种子质量、降低发芽潜力和种子活力来降低种子发芽能力,MT是一种重要的生物分子,它在发育过程中通过与不同的生理机制相互作用,在非生物胁迫条件下调节种子发芽[33]。LI等[34]的研究揭示了一种新的调节机制,指出了MT发挥作用的方式是拮抗脱落酸(ABA)的作用,MT抵消ABA诱导种子发芽,并且阐述了其作用机制涉及调节Ca2+外流和H2O2积累。MT在植物中最初提出的作用之一是它可能作为生长调节剂的作用。过往研究多侧重于单一因素,但MT浸种时长不同对植物的影响也具有较大差异,需要根据植物种来选取合适的MT浓度和浸种时长组合,才能发挥最佳的作用效果。肖珍珍等[28]以不同浓度(0~200μmol/L)的MT分别对无芒雀麦种子浸种处理12h、24h和48h,发现75μmol/L MT浸种时长为24h能有效促进干旱胁迫下无芒雀麦种子萌发。在本实验中,100μmol/L MT浸种9h为促进罗布麻种子萌发和幼苗生长的最适组合,这与上述研究结果相似。此处理组合对根长的作用较为显著,在此处理下根长达到最大值。罗布麻幼苗根长的增加有利于吸收水分和养分、增强支撑作用,这将会更加有利于罗布麻在干旱地区的生存。
4 结论
用MT来增强罗布麻抵抗干旱胁迫时,需要选取合适的MT使用浓度和浸种时长,从试验结果来看,施用100μmol/L MT浸种9h对干旱胁迫后罗布麻幼苗生长发育作用效果较优,且该组合MT对罗布麻种子萌发的抑制效果不强,为罗布麻种子抵抗干旱胁迫的最适处理组合。综上所述,外源MT浸种处理能有效缓解干旱胁迫对罗布麻幼苗生长发育产生的抑制作用,但MT不能缓解干旱胁迫对罗布麻种子的发芽产生的抑制效果。目前的研究多集中在MT处理对罗布麻种子萌发和幼苗早期生长阶段的短期影响。然而,对于其对罗布麻整个生长周期以及长期干旱适应能力的影响尚不清楚。未来可开展长期定位试验,观察MT处理对罗布麻整个生长周期以及后续世代的影响,评估其对罗布麻种群的可持续发展和生态适应性的作用。
参考文献
[1]杨帆,苗灵凤,胥晓,等.植物对干旱胁迫的响应研究进展[J].应用与环境生物学报,2007,13(4):586-591.
[2]吕娟,高辉,孙洪泉.21世纪以来我国干旱灾害特点及成因分析[J].中国防汛抗旱,2011,21(5):38-43
[3]顾颖,刘静楠,林锦.近60年来我国干旱灾害特点和情势分析[J].水利水电技术,2010,41(1):71-74.
[4]郭泽呈,魏伟,石培基,等.中国西北干旱区土地沙漠化敏感性时空格局[J].地理学报,2020,75(9):1948-1965.
[5]GUPTA A,RICO-MEDINA A,CAÑO-DELGADO A I.The physiology of plant responses to drought[J].Science,2020,368(6488):266-269.
[6]李磊,贾志清,朱雅娟,等.我国干旱区植物抗旱机理研究进展[J].中国沙漠,2010,30(5):1053-1059.
[7]欧立军,邓力喜,陈良碧.不同浸种方法对水稻种子发芽率的影响[J].种子,2007,26(12):8-10.
[8]赵叶,杨瑶君,吴三林,等.浸种时间对凤丹种子萌发的影响[J].基因组学与应用生物学,2015,34(9):2024-2029.
[9]他富文,李莲芳,蒙进芳,等.碱溶液浸种对花椒种子发芽的影响[J].西部林业科学,2024,53(4):29-34+51.
[10]陆姣云,田宏,张鹤山,等.H2O2浸种对盐胁迫下紫花苜蓿种子萌发和幼苗生长的影响[J].草业学报,2023,32(10):141-152.
[11]赵艳艳,胡晓辉,邹志荣,等.不同浓度5-氨基乙酰丙酸(ALA)浸种对NaCl胁迫下番茄种子发芽率及芽苗生长的影响[J].生态学报,2013,33(1):62-70.
[12]刘锦川,刘建设,赵慧.不同药剂浸种对糜子、谷子种子发芽特性的影响[J].种子,2017,36(1):33-35.
[13]佟莉蓉,倪顺刚,任星远,等.褪黑素对干旱胁迫下达乌里胡枝子幼苗生长及叶片水分生理的影响[J].草地学报,2021,29(8):1682-1688.
[14]熊海琳,田小霞,毛培春,等.褪黑素浸种对干旱胁迫下白三叶种子萌发和幼苗生长的影响[J].中国草地学报,2024,46(5):23-32.
[15]LIU J L,ZHANG R M,SUN Y K,et al.The beneficial effects of exogenous melatonin on tomato fruit properties[J].Scientia Horticulturae,2016,207:14-20.
[16]张兰,马淑梅,宋谦,等.褪黑素浓度和浸种时长对干旱胁迫下紫花苜蓿种子萌发的影响[J].黑龙江畜牧兽医,2024(3):79-85.
[17]XIONG Q,FAN W,TEZUKA Y,et al.Hepatoprotective effect of Apocynum venetum and its active constituents[J].Planta Medica,2000,66(2):127-133.
[18]JIANG L,SHE C W,TIAN C Y,et al.Storage period and different abiotic factors regulate seed germination of two apocynum species-cash crops in arid saline regions in the northwestern China[J].Frontiers in Plant Science,2021,12:671157.
[19]徐振朋,宛涛,蔡萍,等.PEG模拟干旱胁迫对罗布麻种子萌发及生理特性的影响[J].中国草地学报,2015,37(5):75-80.
[20]ASHRAF M,FOOLAD M R.Pre‐sowing seed treatment:a shotgun approach to improve germination,plant growth,and crop yield under saline and non‐saline conditions[J].Advances in Agronomy,2005,88:223-271.
[21]DONG C F,ZHENG Q M,LI S Y,et al.Exogenous melatonin priming promotes seed germination by enhancing reserve mobilization and hormone metabolism of late sown wheat[J].Plant Growth Regulation,2024,104(2):1059-1073.
[22]CAO Q J,LI G,CUI Z G,et al.Seed priming with melatonin improves the seed germination of waxy maize under chilling stress via promoting the antioxidant system and starch metabolism[J].Scientific Reports,2019,9(1):15044.
[23]WEI W,LI Q T,CHU Y N,et al.Melatonin enhances plant growth and abiotic stress tolerance in soybean plants[J].Journal of Experimental Botany,2015,66(3):695-707.
[24]俞龙生,李卫,许铭宇,等.赤霉素浸种对2种矿区修复先锋植物种子萌发和幼苗生长的影响[J].生态环境学报,2022,31(11):2225-2233.
[25]于奇,曹亮,金喜军,等.低温胁迫下褪黑素对大豆种子萌发的影响[J].大豆科学,2019,38(1):56-62.
[26]李冬,王艳芳,王悦华,等.外源褪黑素对镉胁迫下豌豆种子萌发、幼苗抗性生理及镉含量的影响[J].核农学报,2019,33(11):2271-2279.
[27]雷新慧,万晨茜,陶金才,等.褪黑素与2,4-表油菜素内酯浸种对盐胁迫下荞麦发芽与幼苗生长的促进效应[J].作物学报,2022,48(5):1210-1221.
[28]肖珍珍,隋晓青,石国庆,等.外源褪黑素不同浸种浓度和时长对干旱胁迫下无芒雀麦种子萌发的影响[J].草地学报,2022,30(3):655-660.
[29]聂必林,巫利梅,如马南木·尼合买提,等.外源褪黑素对复合盐碱胁迫下黑果枸杞种子萌发和幼苗生长的缓解效应[J].西北植物学报,2021,41(10):1711-1724.
[30]王宁宁,罗雪梅,陈明媛,等.外源褪黑素对盐旱复合胁迫下油莎豆种子萌发和幼苗生长的影响[J].中国农业科技导报(中英文),2025,27(2):51-61.
[31]梁佳,胡朝阳,谢志明,等.外源褪黑素缓解甜高粱幼苗干旱胁迫的生理效应[J].草业学报,2023,32(7):206-215.
[32]尉欣荣,张智伟,周雨,等.褪黑素对低温和干旱胁迫下多年生黑麦草幼苗生长和抗氧化系统的调节作用[J].草地学报,2020,28(5):1337-1345.
[33]WANG L,TANVEER M,WANG H L,et al.Melatonin as a key regulator in seed germination und er abiotic stress[J].Journal of Pineal Research,2024,76(1):e12937.
[34]LI H,GUO Y L,LAN Z X,et al.Melatonin antagonizes ABA action to promote seed germination by regulating Ca2+efflux and H2O2 accumulation[J].Plant Science,2021,303:110761.
文章摘自:夏天奇,刁雨涵,马润雪,等.外源褪黑素浸种处理对干旱胁迫下罗布麻种子萌发和幼苗生长的影响[J/OL].林业科技通讯,1-10[2025-10-03].https://doi.org/10.13456/j.cnki.lykt.2025.07.07.0003.