摘 要:为研究草酸对镉污染土壤中亚麻根际细菌微生物的影响,采用盆栽试验,待亚麻生理成熟期取根际土壤,通过Illumina-MiSeq高通量测序技术,分析不同浓度草酸对镉污染土壤中亚麻根际细菌多样性及群落组成的影响。结果显示,高浓度的草酸处理有助于增加镉污染土壤中亚麻根际细菌的OTU数量2.5 mmol·kg-1草酸处理下,ACE、Chao1、Shannon和Simpson指数值均为最高,其中,Shannon和Simpson指数值显著大于对照;PCoA分析结果表明,2.5 mmol· kg-1草酸处理后的亚麻根际土壤细菌OTU组成与对照的土壤细菌OTU组成之间的群落结构差异最大;在细菌组成方面,所有处理的优势菌门和优势菌属分别为髌骨细菌门和TM7a,平均占比分别为40.60%和26.06%。综合来看,2.5 mmol·kg-1草酸处理能够增加镉污染土壤中亚麻根际细菌的多样性和丰富度,对细菌组成的影响也最大。本研究有助于为后续研究草酸等外源有机酸对亚麻镉吸收的影响提供一定的理论参考。
关键词:草酸;亚麻;根际;细菌多样性
微生物对土壤生态系统具有很大影响,尤其是对植物根际微生态体系的影响更加明显[1]。根际是指植物根系附近的土壤,植物根系与根际土壤微生物之间的相互作用导致了植物-微生物共生体的产生[2]。根际微生物是土壤中最活跃的组成之一,参与许多生化反应,在土壤生态微环境中具有重要作用。
植物向自身根际环境中释放的根系分泌物是根际微生物营养物质的重要来源[3]。低分子量有机酸是植物根系分泌物的重要组成成分之一,能够为土壤中的细菌等微生物提供生长繁殖所需要的重要能源,会直接影响到土壤中细菌等微生物的数量及种类等,因而在调节植物根际生态系统的动态平衡中发挥重要作用[4]。此外,低分子量有机酸在缓解不利环境对植物的伤害尤其是重金属对植物的胁迫等方面也具有重要作用[5]。草酸(oxalic acid,OA)是一种重要的低分子量有机酸,在植物根际微环境中普遍存在。研究表明,当土壤镉浓度为247 mg· kg-1时,外源添加一定浓度的草酸后,小飞扬草根系的ATP酶活性显著增加,其地上部和根部的镉含量也有所提高[6];外源添加草酸能够提高披碱草的生物量以及镉含量,有效缓解镉对披碱草的毒害作用[7]。因此可以看出,草酸在缓解镉等重金属对植物的毒害,提高植株对重金属的吸收等方面发挥重要作用。
亚麻(Linum usitatissimum L.)是亚麻科(Linaceae)亚麻属(Linum)一年生草本植物,有着悠久的种植历史。亚麻是古老的纤维作物,种子还可以榨油。亚麻生物量大,抗逆性强,对镉等重金属有很强的抗性[8-9]。目前,关于外源有机酸对亚麻镉吸收的影响研究比较多,但鲜有从微生物的角度进行报道。本研究利用高通量测序的手段,对不同浓度草酸处理后的镉污染土壤中亚麻根际细菌的多样性、丰富度以及物种组成等进行分析,以期为后续研究草酸等外源有机酸对亚麻镉吸收的影响奠定基础。
1材料与方法
1.1试验材料和设计
本试验所用亚麻品种为陇亚15,采用盆栽法,共设计4个处理:不添加草酸(CK)、添加0.5 mmol·k-1草酸(OA1)、添加1.5 mmol·kg-1草酸(OA2)、添加2.5 mmol·kg-1草酸(OA3)。每个处理播种3盆,每盆装风干土40 kg,土壤中Cd含量为1.0 mg·kg-1。待亚麻到达快速生长期时,将0、0.5、1.5、2.5 mmol·kg-1的草酸施加到土壤中,每隔14 d施加一次,共施加3次。本试验在浙江省园林植物与花卉研究所试验大棚进行。
1.2样品采集
本试验采取5点取样法,待亚麻生理成熟期时,采集亚麻根系,摇晃并留下约1 mm的根表黏附土后放于50 mL离心管中,用30 mL磷酸缓冲盐溶液(PBS)于180 r·min-1清洗20 min,根表黏附土壤洗脱后将根取出,溶液以10 112 r·min-1离心20 min,去除上清液,收集沉淀用于提取[10]。
1.3 DNA提取、PCR扩增和测序
使用HiPure Soil DNA提取试剂盒(Magen,中国)提取DNA,具体操作按照说明书进行。
使用特异引物扩增16S rDNA的V3~V4区,引物序列为:341F,5'-CCTACGGGNGGCWGCAG-3';806R,5'-GGACTACHVGGGTATCTAAT-3'。PCR扩增条件为:95℃5 min,然后95℃1 min,60℃1 min,72℃1 min,30个循环,最后72℃7 min。扩增体系为:50 ng模板DNA,1.5μL上下游引物(10μmol·L-1),0.2μL Q5@高保真DNA聚合酶(New England Biolabs,美国),1.5μL 2.5 mmol·L-1 dNTPs(New England Biolabs,美国),10μL 5×Q5@反应缓冲液(New England Biolabs,美国),10μL 5×Q5@高GC增强剂(New England Biolabs,美国),用ddH2O补足至50μL。
使用2.0%的琼脂糖凝胶对扩增产物的质量进行评估。使用AMPure XP Beads(Beckman,美国)对PCR产物进行纯化。使用Qubit 3.0荧光定量仪进行定量。使用Illumina DNA Prep试剂盒(Illumina,美国)构建测序文库。使用ABI StepOnePlusRealTime PCRSystem(Life Technologies,美国)进行文库质量检测。确认合格后的文库采用Novaseq 6000的PE250模式pooling上机测序。
1.4数据分析与处理
将测序得到的原始数据利用FASTP 0.18.0[11]进行过滤,使用FLASH 1.2.11[12]将过滤后得到的数据进行拼接,使用UPARSE 9.2.64[13]将得到的序列按照大于等于97%的相似度聚类为OTU(operationaltaxonomic unit,操作分类单元)。使用UCHIME算法[14]进行嵌合体检查。过滤嵌合体后得到的有效序列进行OTU丰度统计和其他后续分析。选取丰度最高的序列作为每个OTU的代表序列。
利用Excel 2019对数据进行初步整理分析,利用SPSS 25.0进行单因素方差分析(ANOVA),利用最小显著差法(LSD)进行显著性差异分析。
2结果与分析
2.1测序结果分析
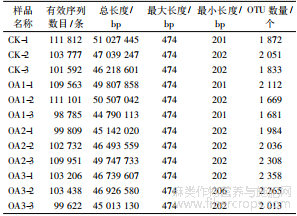
对所有试验样品的细菌16S rDNA基因的V3~V4区进行测序,共获得有效序列1 255 388条,总长度为569 452 935 bp,其中最长序列的长度为474 bp,最短序列的长度为201 bp,平均序列长度为453 bp;共获得24 182个亚麻根际土壤OTU(表1)。
表 1 亚麻根际土壤细菌测序数据统计分析
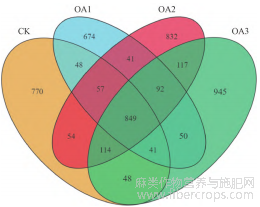
各个处理的韦恩图分析结果(图1)显示,CK、OA1、OA2和OA3中的OTU数量分别为1 981、1 852、2 156和2 256个,各个处理共有的OTU数量为849个,其中CK独有的OTU数量为770个,OA1、OA2和OA3独有的OTU数量分别为674、832和945个。可以看出,低浓度的草酸处理(0.5 mmol·kg-1)降低了镉污染土壤中亚麻根际细菌的总OTU数量和独有OTU数量,较高浓度的草酸处理(1.5、2.5 mmol·kg-1)增加了镉污染土壤中亚麻根际细菌的总OTU数量及独有OTU数量,且处理浓度越高,镉污染土壤中亚麻根际细菌的总OTU数量及独有OTU数量越多。
图 1 不同处理下亚麻根际土壤细菌
2.2 α多样性分析
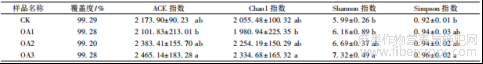
对不同浓度草酸处理的镉污染土壤中亚麻根际细菌进行α多样性分析,结果显示,测序覆盖度均在99.00%以上,说明各处理样品序列检出概率高,测序的结果可以反映不同浓度草酸处理下镉污染土壤中亚麻根际细菌群落的真实情况(表2)。与对照相比,不同浓度草酸处理后的亚麻根际土壤细菌的ACE指数和Chao1指数均呈先下降后上升的趋势,说明亚麻根际土壤细菌的丰富度随着草酸处理浓度的增加先降低后逐渐增加,其中OA3相对于OA1的ACE指数和Chao1指数均显著增加。从Shannon和Simpson指数来看,草酸处理后亚麻根际土壤细菌的Shannon和Simpson指数均呈增加趋势,其中OA3的Shannon和Simpson指数值最高,显著高于对照,说明较高浓度的草酸处理有助于增加镉污染土壤中亚麻根际细菌的多样性。
表 2 亚麻根际土壤细菌 α 多样性指数分析
注: 同列数据后无相同小写字母表示不同处理间差异显著 ( P<0. 05) 。
2.3 β多样性分析
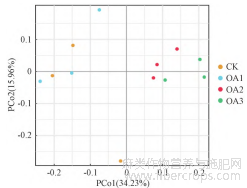
对不同浓度草酸处理的镉污染土壤中亚麻根际细菌的OTU组成进行PCoA分析,提取了2个主成分因子用来显示细菌群落特征(图2)。
图 2 不同处理下亚麻根际土壤细菌 PCoA 分析
结果显示,PCo1是造成各个处理间差异性的最主要因素,解释度为34.23%;PCo2是造成处理间差异性的次要因素,解释度为15.96%;这2个因素共解释了样本50.19%的信息。其中,OA3距离对照最远,说明在2.5 mmol·kg-1草酸处理下的土壤细菌OTU组成与对照土壤细菌OTU组成之间的群落结构差异最大。
2.4物种组成分析
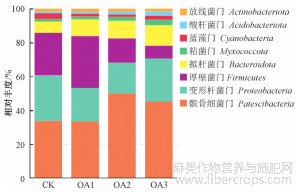
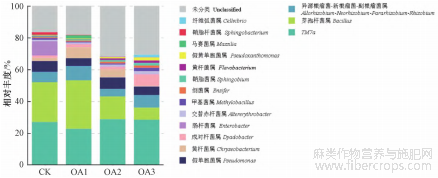
对不同浓度草酸处理的镉污染土壤亚麻根际细菌在门和属水平上相对丰度大于1%的物种进行分析。结果显示,在门水平上,不同浓度草酸处理的亚麻根际土壤优势菌群为髌骨细菌门(Patescibacteria)、变形杆菌门(Proteobacteria)、厚壁菌门(Firmicutes)等8个门,其中髌骨细菌门在所有处理中均为优势菌门,平均占比为40.60%(图3)。髌骨细菌门、变形杆菌门和厚壁菌门为CK、OA1、OA2中的优势菌门,在CK中的占比分别为33.78%、26.93%、25.05%,在OA1中的占比分别为33.42%、19.72%、30.55%,在OA2中的占比分别为50.08%、18.04%、14.33%;髌骨细菌门、变形杆菌门和拟杆菌门(Bacteroidota)为OA3中的优势菌门,占比分别为45.13%、25.38%、12.16%。进一步从属水平上对不同浓度草酸处理下的镉污染土壤中亚麻根际细菌进行分析,结果显示,不同浓度草酸处理的亚麻根际土壤的优势菌属为TM7a、芽孢杆菌属(Bacillus)、异源根瘤菌-新根瘤菌-副根瘤菌属(Allorhizobium-NeorhizobiumPararhizobium-Rhizobium)等16个属,其中TM7a是所有样品中的优势菌属,平均占比为26.06%(图4)。TM7a和芽孢杆菌属为CK、OA1、OA2中的优势菌属,在CK中的占比分别为26.91%、25.05%,在OA1中的占比分别为22.59%、30.55%,在OA2中的占比分别为28.67%、14.33%;TM7a为OA3中的优势菌属,占比为28.37%。
图 3 亚麻根际土壤细菌群落在门水平上的组成和相对丰度
图 4 亚麻根际土壤细菌群落在属水平上的组成和相对丰度
3结论与讨论
土壤微生物在陆地生态系统中承担着有机质分解者和转化者的角色,对维持土壤生态平衡具有重要影响[15]。植物在生长发育的过程中可以为微生物的生长和繁殖提供生态位,其中根际是植物和土壤之间发生相互作用的主要区域,因而根际微生物受植物的影响也较大;另一方面,根际微生物也对
植物的生长发育产生重要影响,在维持植物根际土壤生态平衡、抑制病原菌等方面发挥重要作用,根际微生物也因此被称作是植物的第二基因组,植物根际土壤微生物的研究也受到了广泛关注[16]。传统的土壤微生物研究方法有生物标记、生物平板培养法等,这些方法都具有自身的局限性,难以对土壤微生物的群落组成进行全面的分析。近年来,随着测序技术突飞猛进的发展,Illumina MiSeq高通量测序技术有效地克服了传统微生物研究方法准确率低、操作复杂等不足,其操作简单、结果全面,已经得到了广泛应用[17-18]。本研究利用16S rDNA基因高通量测序技术,对各个试验样品进行分析,共获得1 255 388条有效序列,24 182个OTU(表1);各处理样品的测序覆盖度均在99.00%以上(表2),说明本次测序数据量充足,能够反映出各处理的真实情况。
植物的根系会向根际土壤中释放复杂的根系分泌物,如有机酸、氨基酸、糖类等,这些分泌物可为植物根际微生物提供能源[19]。草酸是一种低分子量的有机酸,在促进植物生长、增强植物对镉等重金属胁迫方面发挥重要作用[6-7,20],相关研究也多集中在这方面,但在对植物根际微生物的影响方面的研究还较少。本研究对不同浓度草酸处理的镉污染土壤中亚麻根际细菌进行了分析,发现与对照相比,OA1的总OTU数量及独有OTU数量降低,OA2和OA3总OTU数量及独有OTU数量升高,且OA3的总OTU数量及独有OTU数量均大于OA2(图1),说明高浓度的草酸处理能够增加镉污染土壤中亚麻根际细菌的OTU数量。
土壤中微生物的多样性能够反映土壤质量情况,多样性指数的大小则可以指示微生物的群落变化情况[21]。本研究中,对不同浓度草酸处理后的镉污染土壤亚麻根际细菌进行α多样性分析,发现OA3的ACE、Chao1、Simpson和Shannon指数均为最高,其中OA3的Simpson和Shannon指数值显著高于CK(表2),说明较高浓度的草酸处理有助于增加镉污染土壤中亚麻根际细菌的多样性和丰富度。利用PCoA分析探究不同处理间细菌群落的相似性,结果显示,OA3的OTU组成与CK相比差异最大,其次是OA2(图2),说明2.5 mmol·kg-1的草酸处理对镉污染土壤中亚麻根际细菌的OTU组成影响最大。土壤细菌的群落结构情况可以通过不同的分类水平体现,本研究所有处理的优势菌门和优势菌属分别为髌骨细菌门和TM7a;CK、OA1、OA2中占比大于10%的优势菌门为髌骨细菌门、变形杆菌门和厚壁菌门,优势菌属为TM7a和芽孢杆菌属;OA3中占比大于10%的优势菌门为髌骨细菌门、变形杆菌门和拟杆菌门,优势菌属为TM7a(图3~4)。从以上结果可以看出,2.5 mmol·kg-1的草酸处理能够增加镉污染土壤中亚麻根际细菌的多样性和丰富度,对细菌群落组成的影响也最大。通过本研究的实施,有助于从根际微生物的层面为后续研究草酸等外源有机酸对亚麻镉吸收的影响奠定基础。
参考文献
[1]周松,杨健豪,晏士玮,等.根际有机酸对土壤中重金属化学行为和生物有效性的影响研究进展[J].生物学杂志,2022,39(3):103-106,124.
[2]HALDARS,SENGUPTA S.Plant-microbe cross-talk in therhizosphere:insight and biotechnological potential[J].The Open Microbiology Journal,2015,9:1-7.
[3]吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.
[4]丁永祯,李志安,邹碧.土壤低分子量有机酸及其生态功能[J].土壤,2005,37(3):243-250.
[5]赵宽,万昕,邢德科,等.低分子量有机酸对土壤有效磷及重金属释放影响的研究进展[J].土壤通报,2022,53(5):1228-1236.
[6]詹淑威,潘伟斌,赖彩秀,等.外源有机酸对小飞扬草(Euphorbia thymifolia L.)修复镉污染土壤的影响[J].环境工程学报,2015,9(10):5096-5102.
[7]薛博晗,李娜,宋桂龙,等.外源柠檬酸、苹果酸和草酸对披碱草镉耐受及富集的影响[J].草业学报,2018,27(6):128-136.
[8]王玉富,郭媛,汤清明,等.亚麻修复重金属污染土壤的研究与应用[J].作物研究,2015,29(4):443-448.
[9]柳婷婷,骆霞虹,李文略,等.不同亚麻品种重金属Cd吸收积累的差异[J].浙江农业科学,2022,63(9):2030-2032,2045.
[10]EDWARDS J,JOHNSON C,SANTOS-MEDELLÍN C,et al.Structure,variation,and assembly of the root-associated microbiomes of rice[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(8): E911-E920.
[11]CHEN S F,ZHOU Y Q,CHEN YR,et al.Fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[12]MAGOCˇT,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[13]EDGARRC.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[14]EDGARRC,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of Chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[15]张东艳,赵建,杨水平,等.川明参轮作对烟地土壤微生物群落结构的影响[J].中国中药杂志,2016,41(24):4556-4563.
[16]艾超,孙静文,王秀斌,等.植物根际沉积与土壤微生物关系研究进展[J].植物营养与肥料学报,2015,21(5):1343-1351.
[17]刘良茜,陶怡,方林平,等.野生金线莲根际土壤微生物分析[J].分子植物育种,2023,21(24):8210-8217.
[18]赵娅红,吴治兴,刘敏荣,等.菊花枯萎病植株根际土壤细菌群落多样性比较[J].中国农学通报,2023,39(13):109-116.
[19]GIRKIN N T,TURNERB L,OSTLE N,et al.Composition and concentration of root exudate analogues regulate greenhouse gas fluxes from tropical peat[J].Soil Biology and Biochemistry,2018,127:280-285.
[20]王水良,王平,王趁义.铝胁迫下马尾松幼苗有机酸分泌和根际pH值的变化[J].生态与农村环境学报,2010,26(1):87-91.
[21]张晓波,于春雷,张文洋,等.不同连作年限菊花根际土壤微生物多样性变化特征[J].浙江农业学报,2022,34(12):2710-2719.
文章摘自:柳婷婷,邹丽娜,骆霞虹,等.草酸对镉污染土壤亚麻根际细菌多样性的影响[J].浙江农业科学,2025,66(07):1764-1769.DOI:10.16178/j.issn.0528-9017.20240275.