摘 要: 以药用植物罗布麻(Apocynum venetum)和白麻(Apocynum pictum)为试材,采用培养皿法,研究其萌发期的抗旱性特征,用聚乙二醇(PEG-6000)模拟干旱环境对种子进行处理,研究不同浓度(0%?5%?10%?15%?20%?25%)PEG溶液对种子萌发率、发芽率、发芽指数、胚芽、胚根、保护酶活性等指标的影响。结果表明:1)与对照相比,在5%?10%的PEG环境下,罗布麻和白麻种子的萌发指标均无显著变化;在15%?20%?25%的PEG环境下,罗布麻和白麻种子萌发指标出现抑制现象,浓度越大,抑制作用越大;2)罗布麻和白麻幼苗的丙二醛含量有相似的变化规律,在15%的PEG环境下达到最大值;SOD活性随PEG浓度的升高呈先升高后降低的趋势,在10%的PEG环境下达到最大值;CAT活性随PEG浓度的升高呈逐渐下降,在5%的PEG环境下达到最低值;罗布麻的POD活性在5%的PEG环境下达到最大值,白麻幼苗的POD活性处理组与对照组无显著差异。本研究结果可为干旱区荒漠植物的人工选育和沙漠化治理提供参考。
关键词:罗布麻;白麻;干旱;聚乙二醇;种子萌发
干旱是世界范围内一种严重的气象灾害,它不仅会对农业生产造成严重的损失,而且还给人类的社会和经济带来了巨大的影响。种子萌发是植物生命周期中既脆弱又重要的阶段,对维持种群的存活起着非常重要的作用[1]。在干旱和半干旱地区,降水少,蒸发量多,水分成为种子萌发以及幼苗成长的主要因子[2]。干旱环境下,种子发芽、生长期间如果无法获取足够的水分,会导致其正常的生理代谢功能受损,严重的缺水将制约种子的生长发育,进而影响作物的产量与品质。为应对干旱环境,植物往往是通过体内细胞代谢等来适应逆境达到防御的效果[3]。药用植物罗布麻和白麻均是潜水性旱中生的高大植株,它们具有迅速吸收大面量水分来应对炎热干旱、日照长等沙漠气候条件的特性。
罗布麻(Apocynum venetum)和白麻(Apocynum pictum)均隶属于夹竹桃科(Apocynaceae)罗布麻属(Apocynum),表现为多年生宿根草本植物的特征[4]。罗布麻和白麻在我国分布广泛,集中在秦岭、淮河、长江流域以及昆仑山北部等自然生态环境多样的地域[5]。罗布麻和白麻的特点在于其宽广的生态幅度和强大的环境适应能力,这使得它们即便在恶劣的沙漠环境中也能生存并繁衍。此外,它们还蕴藏着巨大的开发潜力,作为一种新型的多功能植物资源,它们不仅具有生态价值,还能为经济和医药领域提供重要资源,展现出了极好的产业化前景。PEG-6000作为一种高分子量渗透剂,凭借其易控制和周期短的特点,在植物逆境模拟实验中常被选用来模拟干旱环境。PEG-6000的应用提供了一种高效且理想的实验方法,有助于更准确地评估植物在干旱胁迫下的生理响应和适应性。本文以药用植物罗布麻、白麻为研究对象,通过聚乙二醇(PEG-6000)设置不同程度的干旱处理,探讨其发芽期和幼苗期的抗旱性,为药用植物罗布麻和白麻在干旱地区引种栽培驯化提供参考,进而为沙漠化土地上植被的修复和重建提供理论基础[6-7]。
干旱是我国西北地区植物生存环境中遇到的主要逆境因子之一。在生理机制上,罗布麻和白麻具有较强的适应力,它通过积累渗透调节物质和提高活性氧的清除能力来有效抵御干旱胁迫。王东清等[8]发现,罗布麻中丙二醛、脯氨酸含量均随干旱胁迫程度的增加而升高,而可溶性蛋白含量、超氧化酶和过氧化物酶活性等则表现出先升高后降低的趋势。罗布麻建植期间表现出了一定的抗旱能力,在适当的干旱处理下,能促进种子的发芽和幼苗的生长[9]。
植物的抗旱能力是一个非常复杂的过程,单一指标往往难以全面揭示其抗旱性的影响机制。因此,需要借助多指标的综合评价方法,以更加准确、客观地反映植物种子的抗旱性能。韩福贵等[10]研究发现,随着PEG浓度的逐步增加,罗布麻和白麻种子在萌发期间的含水率逐渐降低。这一变化导致了相对发芽率、相对发芽势、发芽指数以及活力指数均呈显著的下降趋势。同时,种子的发芽日进程被推迟,表明种子的萌发活力受到了抑制。此外,胚芽和胚根的长度以及幼苗的鲜质量也受到了显著抑制。该研究旨在通过研究药用植物罗布麻和白麻萌发期的抗旱性特征,为干旱区荒漠植物的人工选育和沙漠化治理提供参考。
1 材料与方法
1.1 试验材料
罗布麻和白麻均采自新疆尉犁县,4℃冰箱贮藏备用。
1.2 试验方法
1.2.1 种子萌发准备
选择罗布麻和白麻大小一致,无损伤,颜色良好的种子,测定千粒重、种子长宽和种子活力。
1.2.2 种子萌发处理
罗布麻和白麻种子均设立了1个对照组(CK)和5个处理组。照组添加蒸馏水;处理组分别加入了不同浓度的PEG-6000水溶液,以模拟不同程度的干旱条件,具体浓度梯度设置为5%?10%?15%?20%和25%。根据预试验的结果,白麻种子用10%次氯酸钠溶液消毒10min,罗布麻种子用5%次氯酸钠溶液消毒10min,分别用蒸馏水清洗3次,晾干待用。用双层滤纸将种子置于培养皿(直径9cm)中,将上述不同浓度PEG溶液浸透滤纸,每2d加入1次适量的渗透液,使滤纸保持湿润,并盖上盖子防止其挥发,每一浓度梯度播40粒种子,重复3次,贴上标签后放入光照培养箱内进行发芽,箱内温度为25℃,培养箱内相对湿度为50%,光周期为光照14h光照/10h黑暗。
1.3 项目测定
1.3.1 种子千粒质量测定与种子长宽的测定
种子千粒质量的测定:罗布麻和白麻种子中各随机选取1000粒为1组,用电子天平称重,3次重复,计算千粒质量(精确度为0.001g)。种子长宽的测定:罗布麻和白麻种子分别充分混合均匀后,各从中随机地抽选100粒种子,用游标卡尺测量每颗种子的长、宽再求出罗布麻和白麻的平均长、宽(精确度为0.01mm)。
1.3.2 种子萌发前期活力的测定
选择种子大小一致,无损伤,颜色良好的种子,2个品种各40粒,重复3次,用蒸馏水漂洗3次,用过滤纸吸去水分。把种子放入500mL烧杯,加250mL蒸馏水,并放置在室温下,用DDS-301电导计测量种子的初始渗透导电率,每4h测量一次。计算公式为:种子电导率(μS·cm-1·g-1)=(样品值-对照值)/样品种子质量[11]。
1.3.3 种子萌发指标的测定
每天10:00开始观测记录罗布麻和白麻种子萌发情况当连续3d内均未观察到新的种子发芽时,判定种子萌发试验结束。从每一处理组中随机挑选出10株幼苗,对它们的胚根长度和胚芽长度进行测量;同时,这10株幼苗也将被用于鲜质量的测定。统计每日累计萌发个数,并以此计算相应发芽率和发芽势等,计算公式[12]:
发芽率(Gp)=(萌发结束时累计萌发种子数/供试种子数)×100;
相对发芽率(RGp)=(处理组发芽率/对照组发芽率)×100;
发芽势(Ge)=(第4天累计萌发个数/供试种子数)×100;
相对发芽势(RGe)=(处理发芽势/对照发芽势)×100;
发芽指数(Gi)=∑(Gt/Dt);
相对发芽指数(RGi)=(处理发芽指数/对照发芽指数)×100;
抗旱指数=(干旱环境下种子萌发指数/对照种子萌发指数)×100;
萌发率(GR)=(每日累计的发芽粒数/供试种子数)×100。
1.3.4 幼苗生理指标的测定
测定萌发后的幼苗4个生理指标:丙二醛含量、超氧化物歧化酶(SOD)活性、氧化物酶(POD)活性和过氧化氢酶(CAT)活性,均采用索莱宝试剂盒进行测定。其中,SOD活性以抑制氮蓝四唑光氧化还原50%时的酶量为1个活力单位(U),POD活性以1min内引起OD470变化0.01的酶量为1个活力单位(U),CAT活性以1min OD240变化0.1的酶量为1个活力单位(U)[13]。上述4项生理指标均重复测定3次。
1.4 数据分析
利用Origin.2022软件绘制图表。采用SPSS 27.0软件对试验数据进行均值比较,用邓肯检验法进行差异性比较,当P<0.05为差异显著,当P<0.01为差异极显著。
2 结果与分析
2.1 干旱环境对罗布麻和白麻种子萌发指标的影响
2.1.1 种子形态特征、千粒质量测定
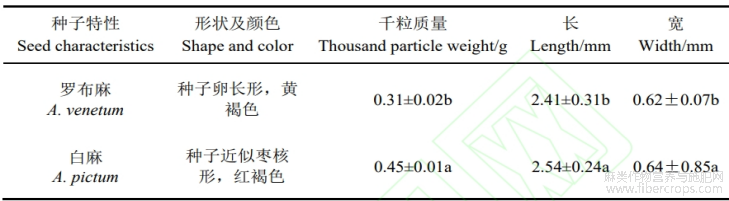
由表1可知,罗布麻种子与白麻形态与颜色基本接近,罗布麻呈枣核形,红棕色;白麻种子的外形和色泽为卵圆形,棕黄色。在千粒质量方面,二者有显著差异(P<0.05),罗布麻与白麻千粒质量分别为0.31?0.46g,罗布麻与白麻的种子在长、宽度方面均有显著差异(P<0.05)。罗布麻种子的长与宽分别为2.41?0.62mm;白麻种子长与宽分别为2.54?0.66mm,罗布麻种子的大小和厚度均小于白麻种子。
表1 罗布麻与白麻种子形态特征
注:表中不同小写字母表示同一指标不同种间差异显著。下同。
2.1.2 种子电导率与种子活力的关系
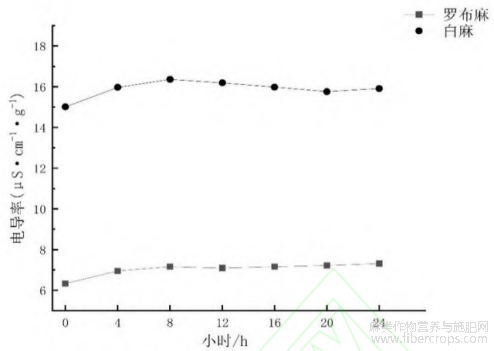
细胞膜的完整性与修复能力是衡量种子生活力的一个重要指标[14]。当种子的细胞膜受到破坏时,细胞质的成分就会被释放出来,细胞质物质释放得越多,电导率越高,表明种子活力越低;反之,活力越高。由图1可知,罗布麻和白麻种子的电导率变化趋势相似,但电导率值存在较大的差异。罗布麻种子的电导率范围在6~8μS/(cm·g);白麻种子的电导率范围在15~17μS·cm-1·g-1)。综上所述,电导率测定试验,并不是唯一测定种子活力的方法,后期试验会进一步验证罗布麻和白麻种子活力。
图1 罗布麻白麻种子的电导率变化
2.1.3 干旱环境对罗布麻和白麻种子萌发率的影响
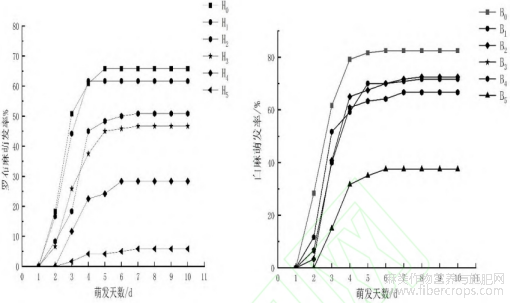
由图2可知,随PEG-6000浓度的增大,罗布麻和白麻种子的萌发率为先上升后趋于平缓。罗布麻种子在第2天开始萌发;第3天时,在CK和5%的PEG-6000处理进入萌发盛期,分别达到为50.83%和44.16%;第4天时,在10%和15%的PEG-6000处理进入萌发盛期,分别达到45%和37.5%;第5天时,在20%和25%的PEG-6000处理进入萌发期,分别达到24.16%和4.16%。白麻种子在第2天开始萌发;第3天时,在CK、5%的PEG-6000处理进入了萌发盛期分别为62.15%?52.14%;第4天时,在10%?15%?20%?25%的PEG-6000处理进入萌发盛期分别为61.25%?58.51%?59.16%?46.10%。总体而言,在轻度干旱环境下(5%的PEG-6000),罗布麻种子和白麻的萌发率分别在处理第2天和第3天达到最高;在重度干旱环境下(20%~25%的PEG-6000),罗布麻和白麻种子的萌发率分别在第6天和第7天达到最高。
图2 PEG-6000对罗布麻与白麻种子萌发率的影响
注:罗布麻萌发图:H0:对照组、H1:5%PEG、H2:10%PEG、H3:15%PEG、H4:20%PEG、H5:25%PEG;白麻萌发图:B0:对照组、B1:5%PEG、B2:10%PEG、B3:15%PEG、B4:20%PEG、B5:25%PEG
2.1.4 干旱环境对罗布麻和白麻种子发芽率、相对发芽率等影响
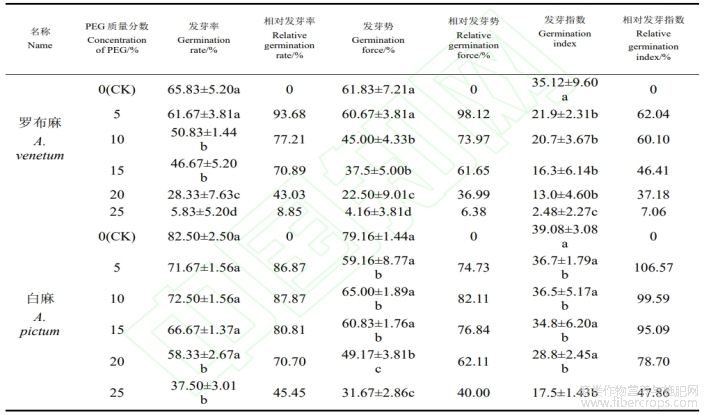
由表2可知,与对照相比,轻度干旱环境下(5%的PEG-6000),罗布麻的发芽率和发芽势均无显著变化;在中度干旱环境下(10%~15%的PEG-6000),罗布麻的发芽率、发芽指数和发芽势均显著下降,在15%的PEG条件下发芽率和发芽势急剧下降,分别比对照减少了19.16%和24.33%;在重度干旱环境下(20%~25%的PEG-6000),罗布麻的发芽率和发芽势有显著差异变化,在20%的PEG环境下发芽率和发芽势呈下降趋势,分别比对照减少了37.5%?39.33%。但在25%的PEG环境下发芽率和发芽势急剧下降分别为5.18%?4.16%,分别比对照相比下降了60%?57.67%。与对照相比,在5%的PEG环境下,白麻的发芽率、发芽指数和发芽势均无显著变化,但发芽势显著下降,为59.16%,比对照相比下降了18.33%;在15%的PEG环境下,白麻的发芽率和发芽势均显著变化,分别为66.67%和34.8%,分别比对照下降了15.83?18.33%;在25%的PEG环境下,白麻的发芽率、发芽势、发芽指数均发生显著差异变化,与对照相比分别减少了45.00%?47.49%?21.58%。将罗布麻与白麻的对照相比发现,相同浓度处理时,白麻的发芽率、发芽指数和发芽势较罗布麻的高。从整体上看,罗布麻种子的抗旱性要低于白麻种子,轻度干旱(5%的PEG-6000)对罗布麻种子和白麻种子的萌发无显著影响;中度干旱(10%~15%的PEG-6000)对罗布麻和白麻种子的萌发有显著差异;而重度干旱(20%~25%的PEG-6000)则能显著地抑制罗布麻种子和白麻种子的萌发。
表2 干旱环境对罗布麻和白麻种子发芽率、相对发芽率等影响
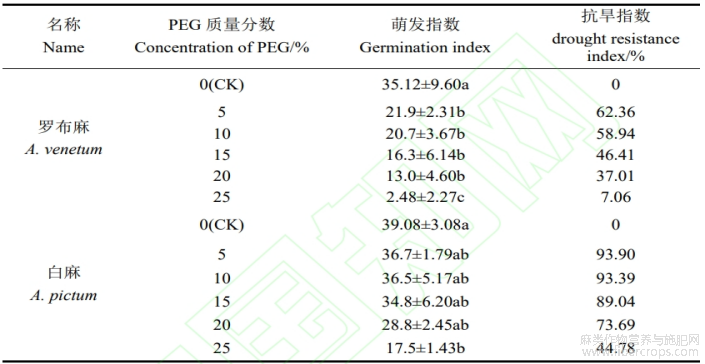
2.1.5 干旱环境对罗布麻和白麻种子萌发指数、抗旱指数的影响
萌发指数可以较好地反映出种子生长状况以及在不同浓度条件下的抗旱性。从表3可以看出,罗布麻种子和白麻种子的萌发指数均呈降低变化趋势。与对照相比,在5%PEG浓度处理的罗布麻萌发指数有显著变化,比CK减少了13.22;在10%PEG浓度处理的罗布麻萌发指数有显著变化,与对照相比减少了14.42;在15%、20%和25%浓度PEG处理的罗布麻萌发指数有显著差异,分别比对照减少了18.82?22.12?32.64。与对照相比,白麻种子的萌发指数在5%?10%?15%和20%的PEG处理下无显著变化;白麻种子的萌发指数在25%的PEG处理下有显著差异,比CK减少了21.58。当PEG溶液浓度在5%?10%时,罗布麻抗旱指数分别为62.36%?58.94%,白麻抗旱指数分别为93.90%?93.39%。罗布麻和白麻种子在25%PEG时抗旱指数分别为7.06%和44.78%。综上所述,通过对PEG环境下罗布麻和白麻种子的萌发指数、抗旱指数的分析,其的耐旱性强弱顺序为:白麻>罗布麻。
表3 干旱环境对罗布麻和白麻种子萌发指数、抗旱指数的影响
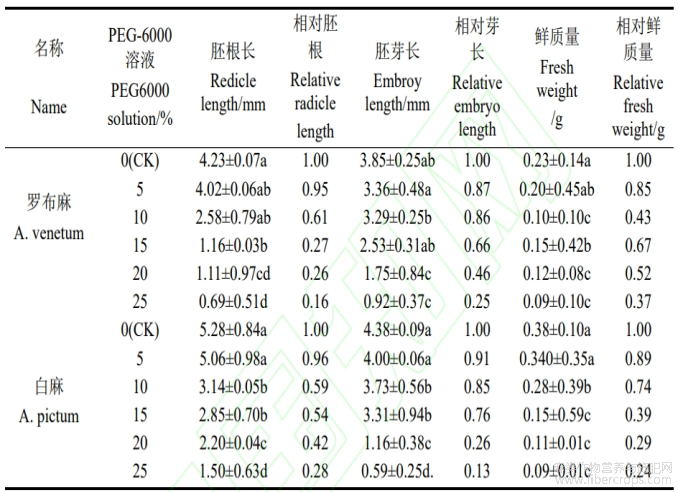
2.1.6 干旱环境对罗布麻和白麻种子胚根胚芽长度和鲜质量的影响
从表4可以看出,与对照相比,5%PEG浓度处理的罗布麻胚根长和胚芽长无显著变化;10%和15%PEG浓度处理的罗布麻胚根长和胚芽长显著变化呈降低趋势,15%浓度处理时种子的胚根长和胚芽长分别为1.16?2.53mm;20%PEG浓度处理时罗布麻胚根、胚芽生长受到抑制,相对胚根长≤0.26,相对胚芽长≤0.46;25%PEG浓度处理时胚根长和胚芽长有显著变化,在这浓度下胚根长、胚芽长达到最小值,分别为0.69?0.92mm。与对照相比,轻度干旱环境下(5%的PEG-6000),白麻种子的胚根长、胚芽长无显著变化;中度干旱环境下(10%~15%的PEG-6000),白麻种子的胚根长、胚芽长显著降低,在15%的PEG环境下胚根长和胚芽长急剧下降,分别为2.85mm和3.31mm,分别比对照下降了2.43、1.07mm;重度干旱环境下(20%-25%的PEG-6000),白麻种子的胚根长和胚芽长均有显著变化,并在25%PEG浓度处理的白麻种子胚根长和胚芽长达到最低值,分别为1.50、0.09mm。与对照相比,5%PEG浓度处理的罗布麻幼苗鲜质量无显著差异;10%?15%?20%和25%PEG浓度处理的罗布麻幼苗鲜质量有显著差异,分别比CK减少了0.33?0.48?0.63。与对照相比,5%PEG浓度处理的白麻鲜质量无显著差异;10%?15%?20%和25%PEG浓度处理的白麻鲜质量有显著差异,并在25%PEG浓度处理的白麻鲜质量达到最低值,为0.09mm。从整体上看,在5%~15%的PEG-6000环境下罗布麻和白麻的胚根长、胚芽长和幼苗鲜质量的变化规律趋势基本一致,其中罗布麻幼苗的受害程度较大,而白麻幼苗则相对较小。
表4 干旱环境对罗布麻和白麻种子胚根胚芽长与鲜质量的影响
2.2 干旱环境对罗布麻和白麻幼苗生理生化指标的影响
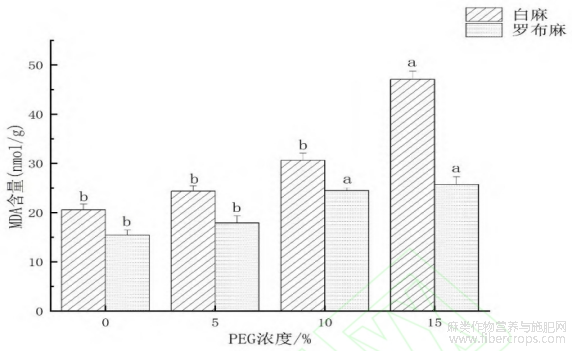
2.2.1 干旱环境对罗布麻和白麻幼苗丙二醛(MDA)含量的影响
丙二醛(MDA)是膜脂过氧化的产物,也是细胞膜损伤的重要特征[15]。罗布麻幼苗与白麻幼苗的丙二醛含量对干旱环境的响应有相似的变化规律。从图3可以看出,与对照相比,5%PEG浓度处理的罗布麻MDA含量无显著变化,为15.12nmol·g-1;10%和15%PEG浓度处理罗布麻MDA含量有显著变化,比对照升高了5.34nmol·g-1和6.14nmol·g-1。与对照相比,5%和10%PEG浓度处理的白麻MDA含量无显著变化;15%PEG浓度处理的白麻MDA含量有显著差异,比对照上升了26.30nmol·g-1,15%PEG浓度处理的白麻MDA含量与5%、10%PEG浓度处理的白麻MDA含量之间也有显著差异,分别相比升高了22.02?16.06nmol·g-1。
图3 干旱环境对罗布麻和白麻幼苗丙二醛(MDA)含量的影响
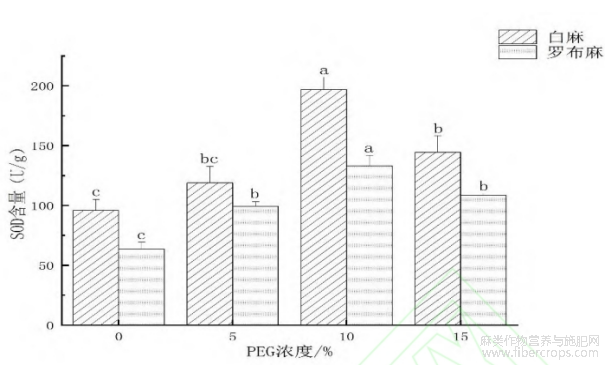
2.2.2 干旱环境对罗布麻和白麻幼苗超氧化物歧化酶(SOD)活性的影响
由图4可知,罗布麻幼苗与白麻幼苗对干旱环境的响应相似,均呈先升高后降低的趋势,均在10%PEG浓度处理时达到最大值。与对照相比,轻度干旱环境下(5%的PEG-6000)罗布麻种子的SOD活性无显著差异;中度干旱环境下(10%~15%的PEG-6000)罗布麻种子的SOD活性有显著差异,10%PEG浓度处理的SOD活性为133.13U·g-1,比对照升高了68.30U·g-1,而15%PEG浓度处理的SOD活性为110.34U·g-1,比对照升高了45.34U·g-1。对照相比,轻度干旱环境下(5%的PEG-6000)白麻种子的SOD活性无显著差异;中度干旱环境下(10%~15%的PEG-6000)白麻种子的SOD活性有显著差异,并在15%PEG浓度处理的白麻SOD活性达到最大值,为196.93U·g-1,比对照升高了101.02U·g-1。
图4 干旱环境对罗布麻和白麻幼苗SOD活性的影响
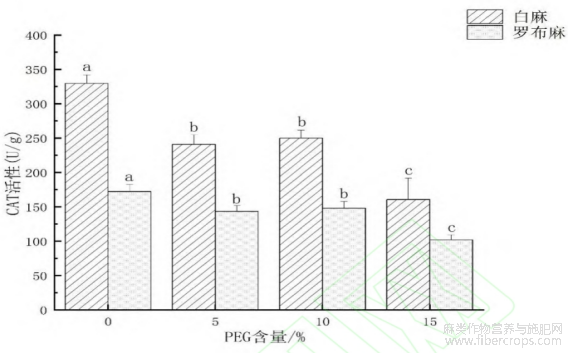
2.2.3 干旱环境对罗布麻和白麻幼苗过氧化氢酶(CAT)活性的影响
从图5可以看出,罗布麻和白麻幼苗的CAT活性在不同浓度PEG环境条件下的变化趋势基本一致。与对照相比,5%?10%和15%的PEG-6000处理罗布麻种子的CAT活性均有显著差异,分别为127.56?128.05U·g-1和85.66U·g-1,分别比CK减少了47.44?46.95U·g-1和89.34U·g-1而10%和15%的PEG-6000处理罗布麻种子的CAT活性之间无显著差异。与对照相比,5%?10%和15%的PEG-6000处理罗布麻种子的CAT活性均有显著差异,分别比CK减少了97.00?77.03?167.45U/g在15%PEG浓度时CAT活性达到最低值,为152.14U·g-1,与对照相比下降了172.86U·g-1。
图5 干旱环境对罗布麻和白麻幼苗CAT活性的影响
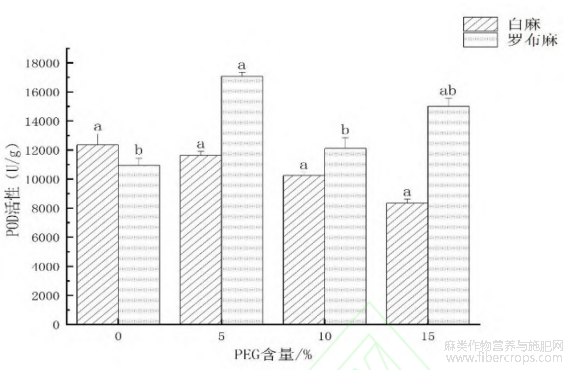
2.2.4 干旱环境对罗布麻和白麻幼苗过氧化物酶(POD)的影响
POD是一种广泛存在于生物体中的酶类,它主要具有催化过氧化物分解的能力。由图6可以看出,与对照相比,5%PEG浓度处理的罗布麻POD活性显著增加,并达到最大值,为1.70×104U·g-1,比CK增加了6.06×103U·g-1;10%和15%PEG浓度处理的罗布麻POD活性无显著变化。与对照相比,5%?10%?15%PEG浓度处理的白麻均无显著变化,说明干旱环境下白麻幼苗POD能保持较高活性,有利于清除体内自由基,提高抗旱性。
图6 干旱环境对罗布麻和白麻幼苗过氧化物酶(POD)的影响
3 讨论
3.1 干旱环境对罗布麻和白麻植物种子萌发指标的影响
在一定浓度的PEG-6000溶液下可以人工模拟自然干旱的条件,让植物组织和细胞处于干旱环境中,植物体为应对干旱环境会做出响应,是研究植物种子萌发时期抗旱性研究的有效方法[16]。不同植物个体对于干旱环境下的响应不同,某些植物在干旱胁迫下会出现各种指标的显著降低,它们在低浓度时对种子萌发有促进作用,而在高浓度时则表现抑制。根据朱慧等[17]研究表明:在针对五爪金龙种子的研究中,采用PEG模拟干旱环境的方法,发现水分对种子的萌发过程具有显著的抑制效应。郭晋梅等[18]的研究揭示了白羊草种子在应对不同浓度条件下的响应。在低浓度条件下,白羊草种子的萌发会受到积极的促进作用;随着浓度的升高,其萌发过程则表现出明显的抑制效应。试验发现,与对照相比,在5%?10%的PEG环境下,罗布麻和白麻种子的萌发指标均无显著变化;在15%?20%?25%的PEG环境下,罗布麻和白麻种子萌发指标出现抑制现象,浓度越大,抑制作用越大。
3.2 干旱环境对罗布麻和白麻植物幼苗生理指标的影响
生命活动最小最基本的单元是细胞,干旱环境可破坏细胞膜的稳定性,导致胞内电解质外流。该研究干旱环境下罗布麻与白麻丙二醛含量的总体变化趋势,随着PEG浓度的增加而逐渐增大,与前人研究结论一致[19]。本试验结果表明:罗布麻幼苗和白麻幼苗在15%PEG浓度时MDA含量达到最大值,可能是二者此时干旱环境尚未对细胞膜系统造成严重损伤,细胞膜有能力保持着相对较好的流动性和选择性;罗布麻和白麻幼苗SOD活性均呈先升高后降低趋势;罗布麻和白麻幼苗CAT活性随着PEG浓度的增加呈降低趋势;罗布麻幼苗POD活性在5%PEG浓度时达到最大值,而白麻幼苗POD活性各处理组与对照组无显著差异,说明干旱环境下白麻幼苗POD能保持较高活性,有利于清除体内自由基,提高抗旱性。罗布麻总体MDA?SOD?CAT?POD活性基本均低于罗布麻,可能是白麻种子整体活力优于罗布麻,或者是罗布麻种子放置时间过久,种子出现干瘪、受损等情况所导致。
4 结论
一定程度的干旱对罗布麻和白麻种子萌发无显著影响,罗布麻种子在0-15%PEG浓度下,白麻种子在0-20%PEG浓度下能够较好地萌发;在此基础上,随着干旱程度的增加,罗布麻和白麻种子萌发率发芽势、胚芽长、胚根长递减;罗布麻和白麻幼苗的MDA含量随着PEG浓度升高而呈上升趋势;罗布麻幼苗与白麻幼苗的SOD活性对干旱环境的响应基本相似,均呈先升高后降低的趋势,均在10%PEG浓度处理时达到最大值;罗布麻幼苗与白麻幼苗的CAT活性基本呈下降趋势,均在15%PEG浓度处理时达到最低值;5%PEG浓度处理时罗布麻POD活性达到最大值,而白麻幼苗的CK和5%?10%和15%PEG浓度处理组均无显著差异。综合种子萌发数、发芽势、发芽指数、抗旱指数等分析发现,白麻的抗旱性优于罗布麻。因此,开展植物种子萌发特征及其耐旱机制的理论研究,在生态环境中具有重要的科学价值,并且为沙漠化土地上植被的修复和重建提供理论基础。
参考文献
[1] MILLER T E. Effects of emergence time on survival and growth in an early old field plant community[J].Oecologia,1987,72:272-278.
[2] 张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106-112.
[3] 曾庆平,郭勇.植物的逆境应答与系统抗性诱导[J].生命的化学,1997,17(3):31-33.
[4] 苏红文,马淼,李学禹.罗布麻和白麻不同居群植物的比较解剖学研究[J].西北植物学报,1999,17(3):348-354
[5] 杨佳乐,王海燕,范桂枝,等.罗布麻资源利用的研究进展[J].黑龙江农业科学,2019(7):176-179.
[6] 耿蕾.干旱胁迫下内蒙古地区罗布麻叶片生理生化特性的测定分析[J].呼和浩特:内蒙古农业大学硕士学位论文,2015.
[7] 甄熙.野生罗布麻生态适应性及响应盐胁迫机制研究[D].呼和浩特:内蒙古农业大学,2023.
[8] 王东清,李国旗,程志.罗布麻研究利用现状及展望[J].江苏农业科学,2011,39(3):310-313.
[9] 韦超.罗布麻的生长特点?纤维理化性能及其开发利用[J].中国纤检,2004(9):25-26.
[10] 韩福贵,徐先英,马全林,等.大花白麻和罗布麻种子萌发对干旱胁迫的响应[J].西北林学院学报,2021,36(1):139-143,256.
[11] 周大云,许红霞,匡猛,等.电导法研究热处理对包衣棉种发芽率和活力的影响[J].江苏农业科学,2008,6:55-56.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13] 薛应龙.植物生理学实验手册[M].上海:上海科学技术出版社,1985.
[14] 宋立奕.盐胁迫对青檀幼苗生长及生理特性的影响[D].南京:南京林业大学,2004.
[15] 严媚欣.混合盐碱胁迫对不同种源地罗布麻种子萌发及幼苗生理特性的影响[J].石河子大学,2021.
[16] 洪震,刘术新,洪琮浩,等.5种造林树种对干旱胁迫的抗性应答[J].南京林业大学学报(自然科学版),2021,45(2):111-119.
[17] 朱慧,马瑞君,吴双桃,等.干旱胁迫对五爪金龙种子萌发与幼苗生长的影响[J].西北植物学报,2009,29(2):344349.
[18] 郭晋梅,刘娟,董宽虎.PEG胁迫对白羊草种子萌发的影响[J].中国草地学报,2015,37(2):78-62.
[19] 孙存华,李杨,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,5(10):2556-2561.
文章摘自:韩占江,马淑英,吴校锋,姜黎.罗布麻和白麻萌发期的抗旱性特征研究[J/OL].北方园艺.https://link.cnki.net/urlid/23.1247.S.20250407.1749.002。