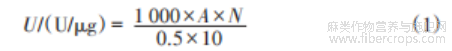摘 要:该研究以前期筛选分离的7株黑曲霉菌株为研究对象,通过脱胶实验确定了黑曲霉TJ07为最佳脱胶菌,在此基础上通过单因素和正交实验确定了在初始pH为6.0时产苎麻脱胶酶的最佳发酵条件为:10g/L果胶为碳源,0.8g/L NH4Cl为氮源,在170 r/min下发酵84 h,在此条件下所产果胶酶酶活为215.64 U/μg、木聚糖酶酶活为73.15U/μg,苎麻失重率达到43.88%。
关键词:苎麻脱胶;黑曲霉;发酵;果胶酶;木聚糖酶
苎麻是荨麻科苎麻属植物,别名为中国草,是植物来源最好的天然纤维之一,具有诱人的光泽、较强的韧性以及良好的抗菌性[1],被广泛应用于轻工业生产当中[2]。苎麻原麻中含有65%~75%的纤维素以及20%~30%的非纤维素物质,这部分非纤维素物质被称为胶质,不同地域的苎麻中纤维素和胶质含量略有差别,苎麻中的胶质主要是由15%左右的半纤维素,5%左右的果胶以及1%左右的木质素构成[3]。苎麻原麻通过脱胶工艺去除胶质后才能用于轻工业生产[4],而传统的苎麻脱胶工艺需要在高温高压条件下使用大量的碱液以及其他的危险性化学品,不仅安全性和经济效益欠佳,生产过程中排放的气体还会对环境造成严重的危害[5]。
随着生态环境问题被不断重视,生物脱胶方法因其高效、节能、降耗、减排等优点已成为目前轻工业的研究热点以及重要发展趋势[6]。苎麻生物脱胶技术主要包括酶法脱胶和微生物脱胶。酶法脱胶是将高效酶制剂异源表达后对苎麻原麻进行脱胶,但因酶制剂高昂的生产成本,很少有企业愿意将其应用于实际生产中。自1953年学界首次证实微生物具备纤维脱胶能力以来,相关菌种资源研究持续取得突破,不同研究团队陆续报道了多种高效脱胶菌株的筛选与应用成果[7-9],为苎麻脱胶菌种资源的筛选与利用奠定了基础。微生物脱胶主要是利用微生物的新陈代谢以及产酶机制从而对苎麻胶质进行生物转化达到去除胶质的目的,而微生物脱胶因其具有节约成本、能耗低以及对苎麻纤维损害较小的优点常常作为生物脱胶中的首选方案[10]。
基于此,本研究团队前期从麻田表层土、苎麻厂附件原土渗滤液中筛选分离到7株苎麻脱胶菌株,经鉴定为黑曲霉。本文以果胶酶酶活、木聚糖酶酶活和苎麻失重率作为评价指标[11],对这7株菌株进行复筛,并在此基础上对脱胶条件进行优化。
1 材料与方法
1.1 材料与试剂
苎麻:经刮青和晒干处理后的苎麻原麻,由达州市全畅麻业提供;麸皮,市售;D-半乳糖醛酸(分析纯)、D-木糖(分析纯)、蛋白胨、琼脂,北京索莱宝科技有限公司;果胶、木聚糖,均为食品级,永顺食品配料有限公司;其他试剂均为国产分析纯。
脱胶菌株(黑曲霉):TJ01、TJ02、TJ03、TJ04、TJ05、TJ06、TJ07,中国工业微生物菌种保藏中心西南站。
基础培养基:12°Bx米曲汁培养基[12],121℃灭菌30 min,用于菌株培养。
筛选培养基:0.8g果胶、0.04g NH4Cl、0.2g MgSO4·7H2O、0.1 g K2HPO4、0.001 g FeSO4·7H2O、100mL超纯水,pH为6.0,121℃灭菌30 min。
发酵培养基:8g果胶、0.6g NH4Cl、2g MgSO4·7H2O、1g K2HPO4、0.01g FeSO4·7H2O、1L超纯水,pH为6.0,121℃灭菌30 min。
1.2 仪器与设备
TU-1810紫外可见光分光光度计,北京普析通用仪器有限责任公司;SPX-250B-2型生化培养箱,上海博迅有限公司;YP402N电子天平,上海精密科学仪器有限公司;SW-CI-2F超净工作台,苏州安泰空气技术有限公司;KMCJ-20超纯水机,成都浩纯仪器设备有限责任公司。
1.3 方法
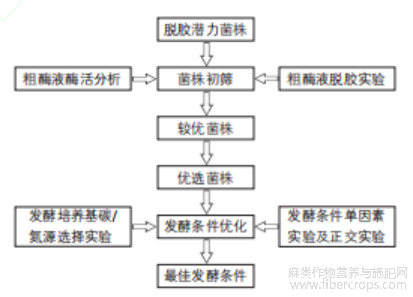
苎麻脱胶菌种复筛及最佳发酵条件研究流程如图1所示。
图1 苎麻脱胶菌种复筛及最佳发酵条件研究流程
1.3.1 粗酶液酶活检测及脱胶实验
将7株脱胶斜面菌株接种于基础培养基,在温度28℃、湿度80%条件下进行继代培养;当培养至菌落占培养皿80%时,挑取一个接种环孢子接种于200mL筛选培养基中进行发酵,发酵条件为28℃、130r/min,发酵48h和72h时分别取发酵液,将发酵液在4000r/min离心15min后取上清液得到粗酶液,测定粗酶液中苎麻失重率和果胶酶酶活,确定较优菌株。
取较优菌株,按上述方法再次发酵48h和72h后制备粗酶液,将苎麻原麻与粗酶液按1∶20(m/m)进行混合,在28℃下脱胶4h后,从粗酶液中过滤出苎麻。用清水将滤出的苎麻进行清洗,随后在烘箱中烘干至恒重,从而得到脱胶后苎麻质量,以苎麻失重率衡量脱胶效果;将经过3min煮沸灭活的粗酶液对苎麻原料重复上述脱胶操作,作为对照组,计算苎麻失重率,判断粗酶液脱胶效果,得到最优脱胶菌株。
1.3.2 最优脱胶菌株发酵培养基碳/氮源选择实验
分别选择果胶、木聚糖、麸皮和果胶+木聚糖(1∶1,m/m)为备选碳源,添加量均为8 g/L,其他组分同“发酵培养基”的要求,发酵条件为:发酵温度28℃、转速130 r/min、发酵时间48 h,以果胶酶酶活和木聚糖酶酶活作为评价标准,确定最佳发酵碳源。
分别选择NH4Cl、(NH4)2SO4和蛋白胨为备选氮源,添加量均为0.6 g/L,碳源为“1.3.2”确定的最佳碳源,其他组分同“发酵培养基”的要求,发酵条件为:发酵温度28℃、转速130r/min、发酵时间48 h,以果胶酶酶活和木聚糖酶酶活作为评价标准,确定最佳发酵氮源。
1.3.3 单因素实验
选择果胶为碳源,添加量为8 g/L,NH4Cl为氮源,添加量为0.6 g/L,其他组分同“发酵培养基”的要求,发酵条件为:发酵温度28℃、转速130 r/min、发酵时间48 h,发酵初始pH为6.0。以果胶酶酶活和木聚糖酶酶活作为评价标准,分别研究果胶添加量(2、4、6、8、10 g/L)、NH4Cl添加量(0.2、0.4、0.6、0.8、1.0 g/L)、发酵时间(24、48、72、96、120 h)、转速(110、130、150、170、190 r/min)对脱胶效果的影响。
1.3.4 正交实验优化
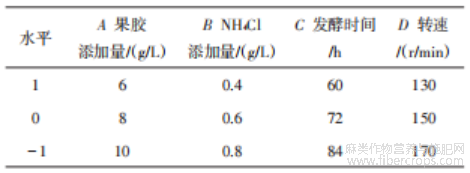
以果胶添加量(A)、NH4Cl添加量(B)、发酵时间(C)、转速(D)为变量,以果胶酶酶活、木聚糖酶酶活和苎麻失重率为评价标准进行四因素三水平的正交实验,实验因素水平见表1。
1.4 指标检测
1.4.1 粗酶液果胶酶酶活测定
标准溶液配制:精确称取D-半乳糖醛酸和D-木糖各0.05g,分别用蒸馏水定容至50mL,其浓度均为1.0mg/mL。
表1 正交实验表
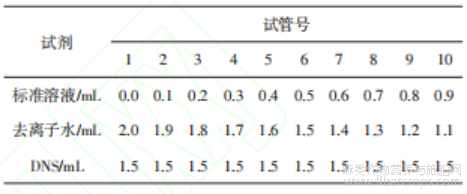
表2 糖标准溶液的配制
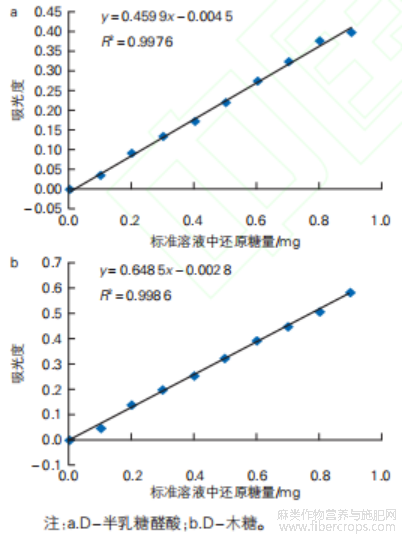
标准曲线绘制:按表2配制得到含还原糖0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mg的标准系列溶液;D-半乳糖醛酸和D-木糖分别在540nm处进行吸光度测试,取三次检测平均值,制得二者的标准曲线。
酶活测定:在50℃、初始pH 7.0条件下,每1mL酶液每1min产生1μg还原糖所需的酶量为一个U(酶活单位)。用DNS法对酶活进行测定。取适合稀释倍数的粗酶液0.5mL,加入0.5 g反应底物(果胶/木聚糖),摇匀后在50℃水浴中反应10min,取出后于沸水浴中加热至灭活。加入1.5mL DNS试剂迅速在沸水浴中加热5 min显色;然后稀释到10mL,在分光光度计中于540nm处检测吸光度。用0.5mL灭活发酵液为对照组。参照标准曲线,带入待测样品的吸光度(y)计算出反应液中的还原糖含量(x),通过公式(1)换算成对应的酶活[13]。
式中:U——脱胶酶活,U/μg;
0.5——取适合稀释倍数的粗酶液0.5mL;
10——反应时间10 min;
1000——换算系数;
A——吸光度值在标准曲线上对应的还原糖含量,mg;
N——酶液稀释倍数。
1.4.2 苎麻失重率的计算
式中:X——苎麻失重率,%;
M——脱胶前苎麻经清洗后烘干至恒重的质量,g;
m——脱胶后苎麻经清洗后烘干至恒重的质量,g。
1.5 数据处理
采用Excel 2019进行数据处理和图表绘制,采用SPSS 18.0进行正交实验数据分析。
2 结果与分析
2.1 菌株发酵产脱胶酶酶活分析
尽可能去除苎麻原麻胶质中的果胶和半纤维素是苎麻脱胶工艺的主要目的,因此要求菌株发酵产的脱胶酶具有高果胶酶酶活和高木聚糖酶酶活。本研究采用DNS法检测7株脱胶菌株产果胶酶和产木聚糖酶的能力。D-半乳糖醛酸和D-木糖分别在540 nm处进行吸光度测试,得到二者的标准曲线(见图2)。
图2 标准曲线
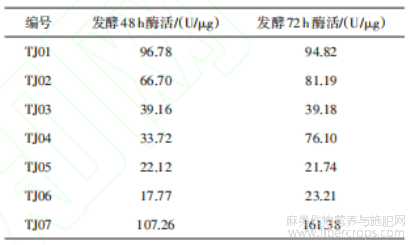
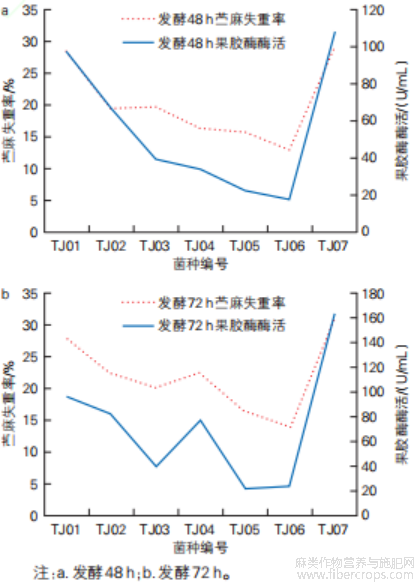
将7株菌分别发酵48 h和72 h后的粗酶液进行果胶酶酶活检测。具体结果见表3。TJ01、TJ02和TJ07的果胶酶酶活相对较高,发酵48 h时分别为96.78、66.70、107.26 U/μg,发酵72 h时分别为94.82、81.19、161.38 U/μg。由图3可知,粗酶液的脱胶能力与果胶酶酶活呈一定的正相关趋势,基于此初步判定TJ01、TJ02和TJ07为较优菌株。
2.2 粗酶提取液脱胶实验结果
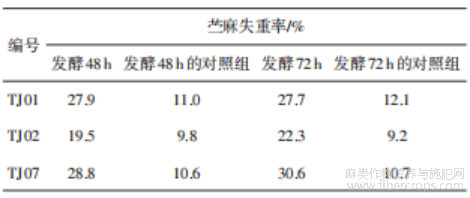
将3株较优菌株发酵48 h和72 h后得到的粗酶液在28℃下进行苎麻脱胶4 h,以相应的灭活粗酶液为对照组,实验结果见表4。实验组整体脱胶效果优于对照组,说明菌株发酵粗酶液能够在脱胶中起到促进作用,其中TJ07失重率最高,脱胶能力最强,综合菌株酶活测定结果,优选TJ07作为后续研究菌株。
表3 果胶酶酶活检测结果
图3 各菌株发酵后的苎麻失重率与果胶酶酶活图
表4 粗酶液脱胶实验结果
2.3 碳/氮源选择实验结果
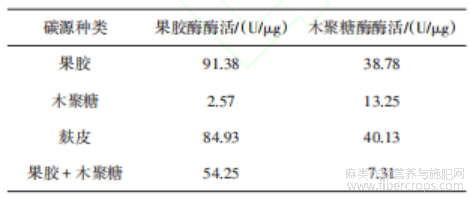
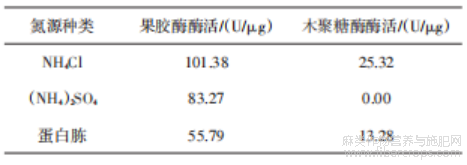
以TJ07为研究对象,进行碳/氮源选择实验,结果见表5、6。选用果胶作为碳源时,果胶酶酶活最高,达到91.38 U/μg,以麸皮作为碳源时,木聚糖酶酶活最高,达到40.13 U/μg。果胶酶和木聚糖酶均具有脱胶作用,但研究表明果胶酶比木聚糖酶更能去除胶质[14],果胶降解在苎麻脱胶中占据核心地位,是促进苎麻韧皮胶质降解的关键步骤[15],综合考虑选用果胶作为碳源。选用NH4Cl作为氮源时,两种酶活均明显高于其他实验组,因此将NH4Cl作为氮源进行后续研究。
表5 碳源选择实验结果
表6 氮源选择实验结果
2.4 单因素实验结果
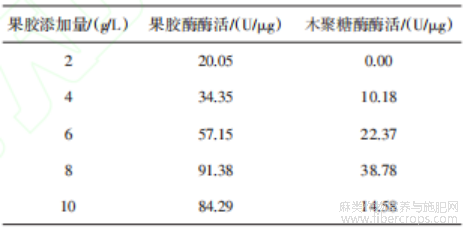
由表7可知,果胶添加量从2 g/L增加至8 g/L时,果胶酶酶活与木聚糖酶酶活分别从20.05 U/μg和0.00 U/μg提升至91.38 U/μg和38.78 U/μg,表明果胶作为诱导型碳源对黑曲霉TJ07的产酶能力具有明显促进作用。当果胶添加量进一步增加至10 g/L时,两种酶活分别下降至84.29 U/μg和14.58 U/μg。推测其原因可能是高浓度果胶导致培养基黏度明显升高,降低了溶氧效率与底物扩散速率,限制菌体对碳源的摄取;也有可能是果胶分子在过饱和状态下易发生胶体凝聚或沉淀,导致部分底物无法被菌株有效利用。此外,碳源过量可能通过碳分解代谢物阻遏效应,抑制产酶相关基因的表达[16]。因此,选择果胶添加量为8 g/L进行后续实验。
表7 果胶添加量实验结果
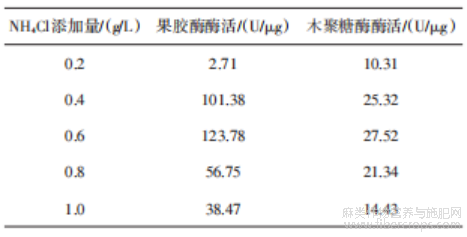
表8 NH4Cl添加量实验结果
由表8可知,当NH4Cl添加量为0.6 g/L时,果胶酶酶活(123.78 U/μg)和木聚糖酶酶活(27.52 U/μg)均达到最高值。这一现象可能与氮源浓度对菌体代谢的调控作用密切相关。氮源是微生物合成胞外酶的关键营养因子,添加适量的NH4Cl可促进黑曲霉TJ07的菌丝生长及产酶相关基因的表达。但当NH4Cl添加量超过0.6 g/L时,酶活明显下降,推测可能是由于高浓度NH4+引起的离子抑制效应或培养基渗透压升高,抑制了菌体的生理活性。此外,过量的氮源可能通过碳氮代谢失衡导致微生物优先利用氮源进行菌体增殖而非产酶,这与前人研究中黑曲霉产酶受碳氮比调控的结论一致[17]。因此,选择NH4Cl添加量为0.6 g/L进行后续实验。
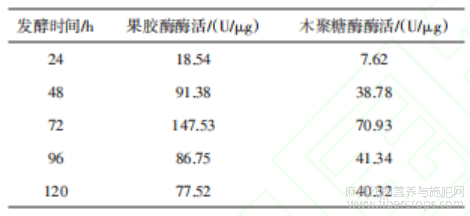
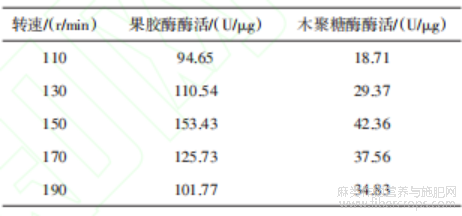
由表9可知,当发酵时间为72 h时,果胶酶酶活(147.53 U/μg)和木聚糖酶酶活(70.93 U/μg)均达到最高值,表明此阶段为TJ07菌株的产酶高峰。之后酶活下降,这可能与底物耗尽、产物反馈抑制或酶蛋白的自身降解有关。此外,长时间发酵可能引发菌体自溶,释放胞内蛋白酶破坏酶活性。因此,选择发酵时间为72 h进行后续实验。由表10可知,当转速为150 r/min时,果胶酶酶活(153.43 U/μg)和木聚糖酶酶活(42.36 U/μg)均达到最高值。转速直接影响溶氧水平与混合效率,适当提高转速可增强气液传质效率,为好氧型黑曲霉提供充足的氧气,促进其呼吸代谢与产酶过程。然而,转速过高可能导致剪切力增大,破坏菌丝体结构或干扰酶的分泌机制,进而抑制酶活。此外,高转速下培养基泡沫增多可能影响菌体与底物的接触效率。因此,选择转速为150 r/min进行后续实验。
表9 发酵时间实验结果
由表10可知,当转速为150 r/min 时,果胶酶酶 活(153.43 U/μg)和木聚糖酶酶活(42.36 U/μg)均达 到最高值。转速直接影响溶氧水平与混合效率, 适当提高转速可增强气液传质效率,为好氧型黑 曲霉提供充足的氧气,促进其呼吸代谢与产酶过 程。然而,转速过高可能导致剪切力增大,破坏菌 丝体结构或干扰酶的分泌机制,进而抑制酶活。 此外,高转速下培养基泡沫增多可能影响菌体与 底物的接触效率。因此,选择转速为 150 r/min 进 行后续实验。
表10 转速实验结果
2.5 正交实验结果
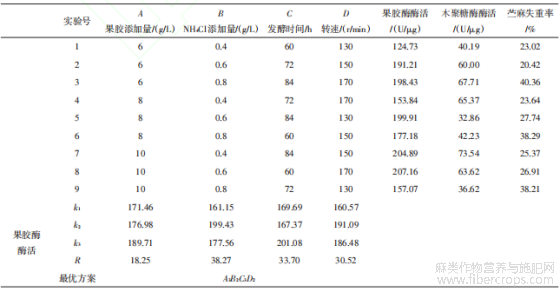
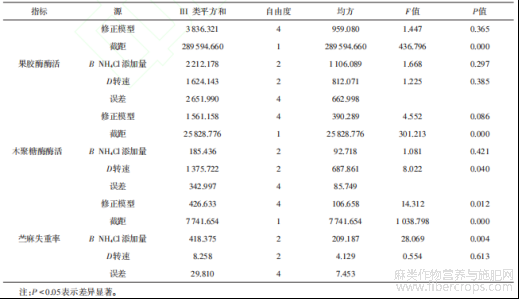
由表11可知,因素A(果胶添加量)与因素C(发酵时间)的最优水平均稳定为A(3 10 g/L)和C(3 84 h)。为探究其他因素对果胶酶酶活、木聚糖酶酶活和苎麻失重率的显著性影响,本研究基于混合效应模型,将因素A、C作为随机效应因子(Random Effects),以表征其水平选择的非系统性变异;同时将因素B(NH4Cl添加量)和因素D(转速)作为固定效应因子(Fixed Effects),重点考察其主效应,对正交实验数据进行方差分析验证因素B、D对目标指标的显著性贡献(P<0.05),正交实验结果方差分析见表12。
表11 正交实验结果
表12 正交实验结果方差分析
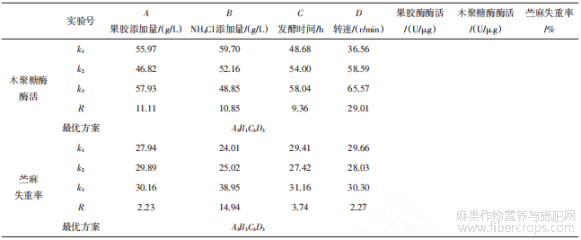
采用综合平衡法确定TJ07脱胶菌株发酵条件的最优方案。由表11可知,以果胶酶酶活为指标,因素的主次顺序为B>C>D>A,最优方案为A3B2C3D2;以木聚糖酶酶活为指标,因素的主次顺序为D>A>B>C,最优方案为A3B1C3D3;以苎麻失重率为指标,因素的主次顺序为B>C>D>A,最优方案为A3B3C3D3。由表12可知,以果胶酶酶活为指标,因素B、D影响均不显著;以木聚糖酶酶活为指标,因素D影响显著,且木聚糖酶酶活和苎麻失重率均在D3更优,因此选取D3;以苎麻失重率为指标,因素B影响显著,且苎麻失重率在B3条件下更优,因此选取B3。综上所述,确定最优组合为A3B3C3D3,即果胶添加量为10 g/L、NH4Cl添加量为0.8 g/L、发酵时间84 h、转速170 r/min。将最优组合进行3次验证实验,得到果胶酶酶活215.64 U/μg、木聚糖酶酶活73.15 U/μg、苎麻失重率为43.88%。
3 结论
本文以前期从麻田表层土、苎麻厂附近原土渗滤液中筛选分离用于苎麻脱胶的7株黑曲霉为研究对象,对这7株菌的产脱胶酶能力进行研究,根据脱胶实验结果确定黑曲霉TJ07为性能优良的脱胶菌,能有效地进行苎麻脱胶。对TJ07产脱胶酶的发酵条件通过单因素实验和正交实验优化后,确定TJ07在发酵初始pH为6.0时的最佳工艺条件为:10 g/L果胶作为碳源、0.8 g/L NH4Cl作为氮源、发酵温度28℃、发酵时间84 h、转速170 r/min,在此条件下得到的果胶酶酶活为215.64 U/μg、木聚糖酶酶活为73.15 U/μg、苎麻失重率为43.88%。
参考文献
[1]JOSE S,RAJNA S,GHOSH P.Ramie fibre processing and value addition[J].Asian Journal of Textile,2017,7(1):1-9.
[2]JIANG W,SONG Y,LIU S Y,et al.A green degumming process of ramie[J].Industrial Crops and Products,2018,120:131-134.
[3]LI Z F,LI Z L,DING R Y,et al.Composition of ramie hemicelluloses and effect of polysaccharides on fiber properties[J].Textile Research Journal,2016,86(5):451-460.
[4]ZHENG Y G,ZHANG Z,LUO Z W.Optimizing the complex formulation of boiling-off liquor for ramie chemical degumming[J].Textile Research Journal,1988,58(11):663-666.
[5]ZHENG L S,DU Y M,ZHANG J Y.Degumming of ramie fibers by alkalophilic bacteria and their polysaccharide-degrading enzymes[J].Bioresource Technology,2001,78(1):89-94.
[6]SHEN M,WANG L,LONG J J.Biodegumming of ramie fiber with pectinases enhanced by oxygen plasma[J].Journal of Cleaner Production,2015,101:395-403.
[7]SHU T,BAI Y,WANG Y W,et al.A high-efficiency and eco-friendly degumming process for ramie fibers[J].Journal of Cleaner Production,2020,276:124217.
[8]CHENG L F,DUAN S W,FENG X Y,et al.Ramiedegumming methodologies:a short review[J].Journal of Engineered Fibers and Fabrics,2020,15(1):1-7.
[9]王岱笠,康建平,马德武,等.苎麻脱胶研究进展[J].纺织科技进展,2023(4):1-5,31.
[10]杨琦,段盛文,彭源德.苎麻微生物脱胶技术的研究进展[J].中国麻业科学,2018,40(1):36-42.
[11]陈其国.三株苎麻脱胶菌的筛选[J].武汉职业技术学院学报,2016,15(1):85-87.
[12]宋萍.工业微生物菌种目录(2014版)[M].成都:四川科技出版社,2014:138.
[13]蒋世琼.果胶酶酶活的简便测定方法[J].化学世界,1995,36(10):553-555.
[14]DUAN S W,LIU Z C,FENG X Y,et al.Diversity and characterization of ramie-degumming strains[J].Scientia Agricola,2012,69(2):119-125.
[15]杨琦,成莉凤,冯湘沅,等.近三年麻纤维生物脱胶技术研究进展[J].中国麻业科学,2022,44(4):245-252.
[16]林文娜,李亮,王瑞,等.细菌碳代谢抑制作用的研究进展[J].中国农业科技导报,2011,13(2):46-52.
[17]郑毅,陈接锋,吴松刚.黑曲霉(Aspergillus niger)产β-葡聚糖酶固态发酵优化的研究[J].食品与发酵工业,2001,27(12):7-10.
文章摘自:廖云生,冯霞,张蓓蓓,等.苎麻脱胶优势菌种筛选及最佳发酵条件研究[J/OL].食品与发酵科技,1-8[2025-05-22].http://kns.cnki.net/kcms/detail/51.1713.TS.20250425.1030.002.html.