摘 要:大麻在中国被称为“五谷”之一,可纤用、油用、药用以及用于宗教活动等,在社会生活中发挥着重要的作用。由于早期大麻果实易腐烂灰化、不易保存,因此建立大麻的植硅体鉴定标准,对揭示其起源、驯化和传播过程具有重要意义。本研究对大麻、红麻、(大麻槿)黄麻、青麻(苘麻)、亚麻、苎麻等6种麻类作物的果实或种子进行了系统的植硅体形态研究,探寻具有鉴定意义的特征植硅体类型,为研究其起源、驯化和传播提供新的方法。将每份样品解剖出不同的部位,采用湿式灰化法对每个部位分别进行植硅体提取,并在光学显微镜和扫描电镜下分别进行观察分析。结果表明,发育植硅体的部位有:大麻的苞片和果皮、苎麻的果被和果皮、黄麻种皮以及青麻种皮,未见植硅体的部位有:红麻和亚麻的种子。仅有大麻果皮中存在典型形态特征的植硅体,如不规则多边疣粒板型(单体或聚合形态)、不规则多边平滑板型(单体或聚合形态)、双层嵌套板型。分析表明,大麻的不规则多边板型(包括不规则多边疣粒板型及不规则多边平滑板型)植硅体形态大小稳定,种内差异较小,且与木本植物、草本植物中形态类似的植硅体区别明显。综上,不规则多边板型植硅体为大麻特有的植硅体类型,可用于鉴定大麻的种属。其中,不规则多边疣粒板型植硅体形态特征更明显且产量更丰富,平均1g大麻果实的不规则多边疣粒板型植硅体产量可达10.2±0.4×106粒,可作为鉴定大麻种属的主要特征植硅体,其主要特征为:1)单体为边缘棱角分明、正面具若干小型疣状突起、背面具0~3个大小相近的乳突的多裂片式不规则多边形板状结构,长度为15.4±2.3μm,宽度为10.8±1.7μm,厚度为6.2±1.0μm;2)由若干形态相同、大小相近的单体通过边缘裂片间隙拼合为片状平面拼图结构;3)与不规则多边平滑板型植硅体(长度为27.9±4.5μm,宽度为18.6±3.1μm,厚度为10.0±1.4μm)形成双层嵌套结构。进一步分析表明,大麻不同品种间不规则多边疣粒板型植硅体在形态大小上细微的差异与品种间果实形态大小差异以及气候条件无直接关系,推测其形态的种内差异可能是受局地土壤环境影响所致。
关键词:大麻;麻类作物;植硅体;植物考古;形态研究
1引言
大麻是大麻科大麻属一年生草本植物,世界各地均有广泛的栽培[1]。大麻被认为是世界上最古老的栽培植物之一[2],而中国是世界上栽培利用大麻历史最悠久的国家[3],在新石器时代晚期就已在中国北方黄河流域开始种植[4],之后向周边地区传播,诗经时代已成为普遍栽种的大田作物[5]。大麻在中国被称为“五谷”之一[6],除纤用、油用、药用外,还可用于造纸和建材以及宗教活动[4,7]。过去关于大麻的起源和驯化研究,主要是通过历史文献记录和考古实物出土两种方法。其中历史文献的方法[3,5,8],如《尚书》、《诗经》等,成书距今仅有两千多年,书中记载的大麻使用历史仅可追溯到夏商时期[8],再则有人工记载的主观性、不确定性、古今异名等因素,往往考证较难。考古实物出土表明,新石器时代晚期和早期青铜时代,黄河流域的先民开始对大麻进行驯化、栽培和利用[4]。然而考古出土实物较少,新石器时代的内蒙古通辽哈民忙哈史前聚落遗址仅出土了3粒大麻,年代为5500~5000aB.P.[9];陕西靖边庙梁遗址出土了2粒龙山时期的大麻[10];河南荥阳官庄遗址出土了1粒周朝的大麻[11];较早的麻布可追溯到5600aB.P.,出土于河南荥阳青台遗址[12],表明大麻的驯化和利用应该更早。但早期的大化石易腐烂灰化,形态特征破坏严重,保存难度大且辨认较难。因此,过去的研究方法对于研究大麻起源、驯化和传播造成了一定困扰,限制了研究的准确性;因而本文找到一种新的方法来有效解决这一问题。
植硅体是植物通过根系从土壤中吸收水溶性的硅,经维管束传送,在细胞内或细胞间形成难溶的以水合硅(SiO2·nH2O)形式出现的硅酸状态[13];植硅体的形态与植物细胞形态及细胞所在位置有关[13],因而不同植物形成的植硅体形态存在差异,同一植物不同部位形成的植硅体形态亦有不同。另外,相对于大植物化石遗存,植硅体具有产量高、抗风化、抗高温等特征,在植物腐烂、分解、搬运、埋藏过程中能够较完好地保存下来[13~14]。部分植物体内会形成并长期存在具有特定形态或参数特征的植硅体,可用于鉴定和区分其种属关系。因此植硅体在植物考古研究中具有重要作用[13,15~22]。目前利用植硅体进行植物考古,主要应用在人类赖以生存的粮食作物的遗存鉴定上,如水稻[23~26]、粟和黍[27~31]、玉米[32~34]、小麦和大麦[35~38]等,植硅体形态学已成功用于主要农作物的起源和驯化[39~40]。但是与人类生产生活息息相关的经济作物,目前仍缺少系统的植硅体形态学研究,在植物考古研究中较为罕见。本研究以大麻植硅体形态分析为例,尝试将其与常见的红麻、黄麻、青麻、亚麻、苎麻等麻类作物进行区分,对这6种麻类作物进行系统的植硅体形态研究,尝试建立大麻及其他麻类作物的植硅体鉴定标准,为植物考古工作提供新的手段和方法。
2材料和方法
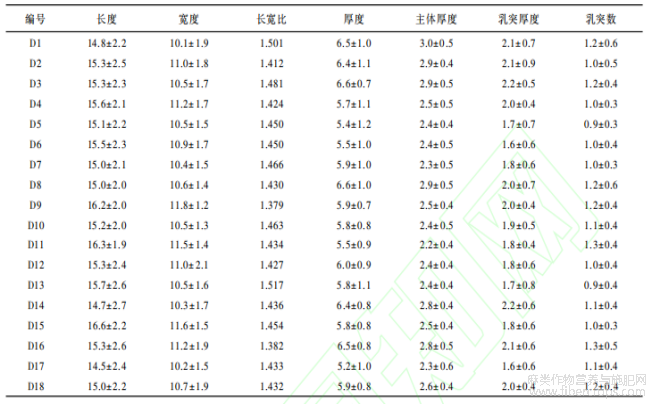
本研究所用材料为来自全国18个不同产地的大麻果实(编号为D1~D18)、6个不同产地的红麻(大麻槿)种子(编号为HO1~HO6)、8个不同产地的圆果黄麻种子(编号为HU1~HU8)、9个不同产地的青麻(苘麻)种子(编号为Q1~Q9)、10个不同产地的亚麻种子(编号为Y1~Y10)和1个产地的苎麻果实(编号为Z)(见表1)。这6种麻类作物来自不同的科属,大麻是大麻科大麻属一年生草本植物,红麻(大麻槿)是锦葵科木槿属一年生草本植物,黄麻是椴树科黄麻属一年生草本植物,青麻(苘麻)是锦葵科苘麻属一年生草本植物,亚麻是亚麻科亚麻属一年生草本植物,苎麻ea是荨麻科苎麻属多年生草本宿根植物[39]。其中大麻是大麻科大麻属的唯一一个种,分为北亚种和南亚种两个亚种,二者的主要区别在于四氢大麻酚(THC)的含量不同,北亚种的THC含量低于0.3%,在我国称为工业大麻,又称汉麻、线麻、寒麻、火麻等,多为纤维用或籽或油用,南亚种的THC含量高于0.3%,多为药用[39~42]。THC能使人形成瘾癖,具有致幻作用,含量高于0.3%的大麻具有滥用倾向,长期吸食易产生精神依赖性,故被列为严厉打击的对象[40~42]。南亚种因受到管制,其种质样品较难获取。因此本研究使用的18个地方品种的大麻均为北亚种。本研究使用的种质资源均由国家科技资源共享服务平台国家作物种质资源库(htpps:∥www.cgris.net/)麻类分库提供,样品图版见图1。6种麻类作物植株图片(图2)来自中国植物图像库(htpp:∥ppbc.ipiant.Cn/)。
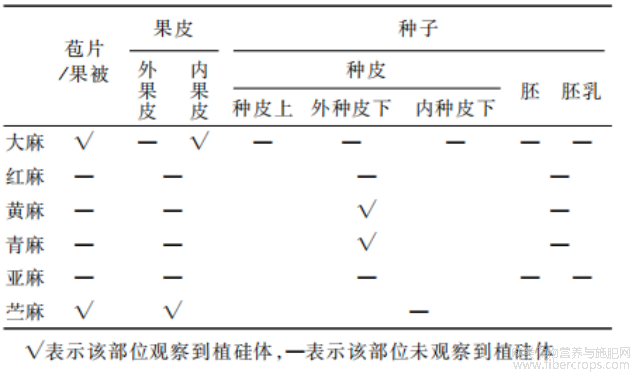
以大麻果实为例,对每种样品进行解剖,分离出不同的部位(图3)。大麻果实外带有苞片,其果实由外膜和一粒种子组成,外膜紧紧包被种子,故在生产上通常将果实作种子用[39]。将大麻解剖为苞片、外果皮(果皮外部角质膜)、内果皮(去角质膜的果皮)、外种皮下部(深绿色种皮)、内种皮下部(透明薄膜)、种皮上部(棕褐色帽状角质)、胚、胚乳这8个部分。苎麻果实外带有具刺毛的淡褐色膜质果被(即宿存花被)[+5],解剖为果被、果皮、种子3个部分,因种子体积极小、种皮较难分离,故
不继续解剖。亚麻解剖为种皮、胚、胚乳3个部分,红麻、黄麻和青麻的胚和胚乳较难分离,均解剖为种皮、胚+胚乳两个部分。实验采用湿式灰化法[44],对6种麻类作物不同解剖部位分别进行植硅体提取分析,具体步骤如下:1)将样品放入试管中,用超声波清洗仪多次清洗直至洗净;2)向试管中加入适量浓硝酸,水浴加热加速氧化,待溶液变澄清,样品颜色变透明,有机质全部被氧化;3)氧化结束后向试管中加入蒸馏水,放入离心机离心(3000r/min,5min),将试管上部液体用吸管吸取后丢弃,再次加入蒸馏水离心,如此重复清洗3次,直至溶液中硝酸被除去,再加入无水乙醇离心洗涤两次;4)搅拌溶液使其均匀分布,用吸管吸取少许溶液滴在载玻片上,用酒精灯加热使乙醇全部蒸发,部分样品在载玻片上滴1~2滴加拿大树胶,盖上盖玻片制成固定片,部分样品进行镀金、粘贴导电胶带;5)固定片采用LeicaDM750光学显微镜观察样品,对代表性植硅体进行拍照和参数测量统计,镀金片采用ZeissGemini450扫描电子显微镜对代表性植硅体进行微观形貌观察和元素高精度扫描分析。
另外采用湿式灰化法,对完整的大麻果实颗粒进行植硅体提取和计数,与上述步骤不同的是:各组取若干粒完整的大麻果实样品并计量称重;浓硝酸水浴加热去除有机质后加入石松孢子示踪剂;每组样品在光学显微镜下观察统计植硅体400粒以上,根据石松孢子与植硅体的数量比例结合每组大麻果实计量称重数据计算1g大麻果实的植硅体产量。
表1 麻类作物样品名录

2结果
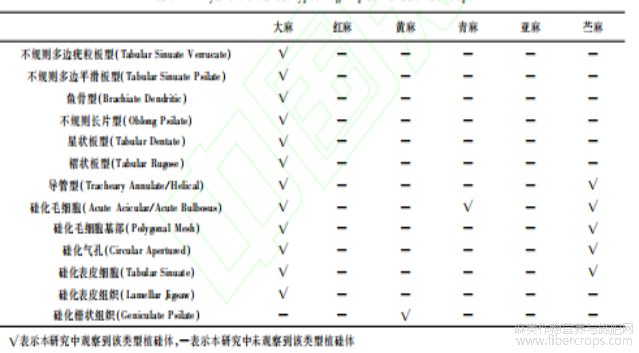
本研究提取了大麻、红麻、黄麻、青麻、亚麻、苎麻等6种麻类作物果实或种子不同部位的植硅体进行分析,分别在光学显微镜和扫描电子显微镜下对其进行微观形貌观察。结果显示存在不规则多边疣粒板型、不规则多边平滑板型、不规则长片型、鱼骨型、星状板型、褶状板型、导管型、硅化毛细胞、硅化毛细胞基部、硅化气孔、硅化表皮细胞、硅化表皮组织、硅化栅状组织等各类型疑似植硅体的物质,命名依据国际植硅体命名法规[45]。其中硅化表皮细胞为果皮或种皮的表皮细胞,硅化表皮组织为表皮细胞层的组合,硅化栅状组织为表皮层下的栅状细胞层。对观察到的各类型物质进行多次电子探针元素高精度扫描分析,结果显示各类型物质主要组成元素为O和Si,其中O元素原子数量占全部组成元素原子数量总和的62.8%~66.7%,Si元素原子数量占全部组成元素原子数量总和的26.1%~33.3%,两者数量比约为2:1,即证明其主要成分为SiO2,为植硅体(图4)。各麻类作物果实或种子中存在的植硅体类型归纳于表2,各麻类作物果实或种子不同解剖部位植硅体发育情况见表3。
表2 麻类作物种质植硅体类型调查情况
表3 麻类作物各解剖部位植硅体发育情况
2.1大麻果实植硅体
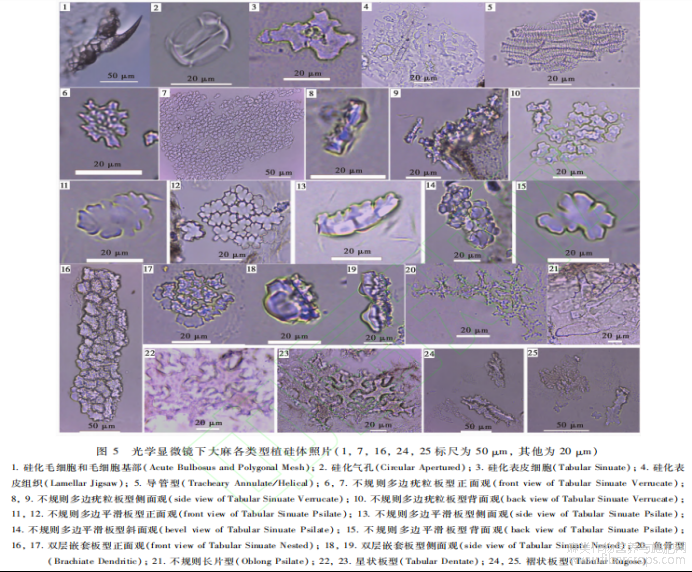
对带苞片的大麻果实的8个部位分别采用湿式灰化法提取植硅体,结果显示仅在大麻苞片和内果皮中发现有植硅体存在(图5和6)。大麻苞片中存在硅化毛细胞(图5-1;图6-11)、硅化毛细胞基部(图5-1;图6-2)、硅化气孔(图5-2;图6-1,3),内果皮中存在硅化表皮细胞(图5-3)、硅化表皮组织(图5-4)、导管型(图5-5;图6-4)、不规则多边疣粒板型(图5-6,7,8,9,10;图6-5,6,7)、不规则多边平滑板型(图5-11,12,13,14,15;图6-7,8,9)、双层嵌套板型(图5-16,17,18,19;图6-10,11,12,13,14)、鱼骨型(图5-20;图6-15)、不规则长片型(图5-21)、星状板型(图5-22,23;图6-16)、褶状板型(图5-24,25)等多种类型的植硅体。上述各类型植硅体按果实结构由外向内存在位置排序。下面按各类型形态特征明显程度、数量多寡即反映其鉴定意义或利用价值大小依次展详细描述。不规则多边疣粒板型,其植硅体的单体呈多裂片式不规则多边状结构,边缘棱角分明(图5-6;图7-1)。正面具覆盖表面的若干小型疣状突起(图5-6;图6-5,7;图7-1);背面具0~3个大小相近的乳突(图5-10;图6-6);侧面观主要由三部分构成,中间主体部分呈不规则矩形,表面可见裂片纹饰具凹凸感,正面一侧具若干小型疣状突起,背面一侧具0~3个小型乳突(图5-8;图7-2)。不规则多边疣粒板型植硅体聚合形态为若干数量的单体通过边缘裂片间拼合为片状平面拼图形结构(图5-7;图6-5,7),侧面观则为链状分布(图5-9)。对18个品种大麻的不规则多边疣粒板型植硅体各量取100粒,平均长度为14.4~16.6μm,平均宽度为10.1~11.8μm,平均厚度为5.2~6.6μm,平均主体厚度为2.2~3.0μm,平均乳突厚度为1.6~2.2μm,平均乳突数为0.91~3个。所有参与测量的不规则多边疣粒板型植硅体长度为15.44±23μm,宽度为10.8±1.4μm,厚度为6.2±1.0μm。各品种不规则多边疣粒板型植硅体的长度、宽度、厚度、主体厚度、乳突厚度、乳突数在误差范围内均无显著差异。在大麻果实各类型植硅体中,不规则多边疣粒板型植硅体的产量最为丰富,平均1g大麻果实的不规则多边疣粒板型植硅体单体的产量可达10.2±0.4×106粒。各品种大麻的不规则多边板型植硅体形态参数介绍见图7,不规则多边疣粒板型植硅体详细参数见表4。不规则多边平滑板型,其植硅体的单体亦呈多裂片式不规则多边形板状结构,边缘较为圆润平滑(图5-11,15;图7-3)。正面观呈不规则花瓣状,整体较为平滑,边缘呈花瓣状凸出(图5-11;图6-7;图7-3);背面观呈不规则花瓣状,表面具1个较大突起或平滑(图5-15;图6-9,12);侧面观主要由三部分构成,中间主体部分呈不规则矩形,表面可见裂片纹饰具凹凸感,正面一侧具若干突起,背面一侧具0~1个大型乳突(图5-13;图7-4)。不规则多边平滑板型植硅体聚合形态也是由若干数量的单体通过边缘裂片间隙拼合为片状平面拼图形结构(图5-12;图6-8,9),与不规则多边疣粒板型聚合形态不同的是,因不规则多边平滑板型数量相对较少且体积相对较大,在光学显微镜下很少观察到侧面链状分布。因观察到的不规则多边平滑板型植硅体数量较少,对18个品种的大麻共统计不规则多边平滑板型植硅体正、背面观100粒,其长度为27.9±4.5μm,宽度为18.6±3.1μm。对各品种的大麻共统计不规则多边平滑板型植硅体侧面观50粒,其厚度为10.0±14μm。不规则多边平滑板型植硅体参数统计见表5。鱼骨型植硅体状似鱼骨,具多个发散状分枝,分枝粗细程度不均,表面具若干颗粒状纹饰(图5-20;图6-15);不规则长片型呈薄片状不规则长矩形(图5-21);星状板型呈星芒状,各分支较短且不明显,表面光滑或具若干颗粒状纹饰(图5-22,23;图6-16);褶状板型植硅体其形态为不规则板状表面具棘皮状纹饰(图5-24,25);硅化表皮细胞为边缘弯曲扁平片状(图5-3),硅化表皮组织为若干未完全硅化的表皮细胞如拼图状组合在一起(图5-4)。这些类型的植硅体发育较差、观察到的数量较少,鉴定意义较小,因此并未做参数统计。另外,硅化毛细胞(图5-1;图6-1)、硅化毛细胞基部(图5-1;图6-2)、硅化气孔(图5-2;图6-1,3)、导管型(图5-5;图6-44)等类型的植硅体均未进行参数统计。
2.2其他麻类作物种质植硅体
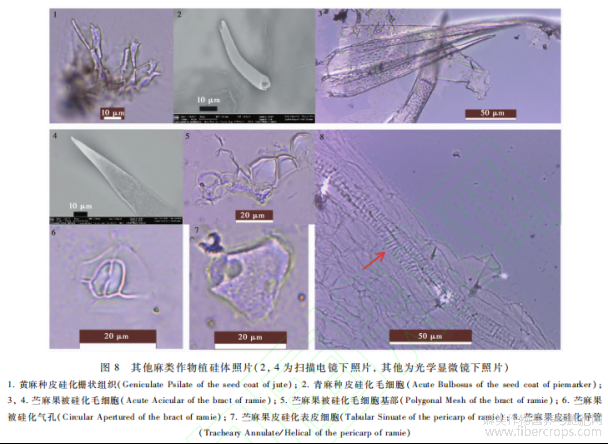
在红麻、亚麻种子各部位均未发现植硅体,但在黄麻种皮中发现有硅化的栅状组织(图8-1),无固定形态,不具有鉴定特征,胚和胚乳中未发现植硅体。青麻种皮中发现有硅化毛细胞(图8-2),不具有鉴定意义,胚和胚乳中未发现植硅体。苎麻果被中发现有硅化毛细胞(图8-3,4)、硅化毛细胞基部(图8-5)、硅化气孔(图8-6),果皮中发现有硅化表皮细胞(图8-7)、硅化导管(图8-8),均无鉴定意义,种子中未发现植硅体。
表4 不规则多边疣粒板型植硅体参数统计(单位:μm)
表5 不规则多边平滑板型植硅体参数统计(单位:μm)
3讨论
3.1不规则多边板型植硅体与类似植硅体的区别
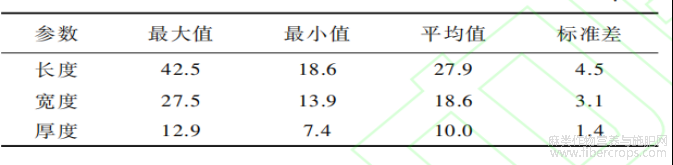
前人在一些木本植物和草本植物中发现有与大麻不规则多边板型植硅体形态类似的植硅体(图9),如在木本植物桦木科、壳斗科、豆科的叶片中发现有硅化的拼图状表皮细胞[46~47](图9-1,2,3),在木本植物槭树科、木樨科、椴树科、榆科、蔷薇科、豆科、鼠李科、虎耳草科中发现有边缘弯曲扁平状植硅体(图9-4,5),在草本植物木贼科、凤尾蕨科、蹄盖蕨科、鳞毛蕨科、菊科、伞形科、蔷薇科十字花科、茜草科中发现有边缘弯曲扁平状植硅体[48](图9-6,7)
这几种类型的植硅体与大麻不规则多边板型有着部分相近的形态特征,如均为不规则的多边形,有着相似的拼图状结构等,但它们在形态上仍与大麻不规则多边板型有着显著的差异,可以进行准确硅体表面覆盖数量众多的不规则疣粒,且与不规则多边平滑板型植硅体形成方向固定的双层嵌套结构,而其他木本和草本的类似植硅体表面是平滑的,且单层发育或仅与纤维层一同硅化。另外,在植硅体参数特征和发育部位上,大麻不规则多边板的区分。最大的区别是大麻不规则多边疣粒板型植型植硅体与木本植物、草本植物的类似植硅体也有显著区别。在参数特征上,大麻不规则多边疣粒板型的平均长度为15.4μm,平均宽度为10.8μm,大麻不规则多边平滑板型的平均长度为27.9μm,平均宽度为18.6μm;而木本植物边缘弯曲扁平状植硅体的平均长度为44.91μm,平均宽度为28.99μm;草本植物边缘弯曲扁平状植硅体的平均长度为70.03μm,平均宽度为41.49μm[48]。在发育部位上,本研究的样品为大麻果实,大麻不规则多边板型植硅体发育于果皮厚壁细胞层的石细胞,而前人研究的样品为木本植物和草本植物的叶片,硅化的拼图状表皮细胞、边缘弯曲扁平状植硅体等发育于叶片的表皮细胞[46~48]。另外,大麻果皮本身也具有硅化的拼图状表皮细胞(图5-3,4),整体形态与木本植物硅化的拼图状表皮细胞(图9-3)相近,但硅化数量较少,发育较差,与大麻不规则多边板型植硅体差异显著,不易混淆。
在过去的植物学分类中,大麻曾被分在桑科下,根据Wallis[49]、葛勇等[50~51]对桑科植物植硅体的研究,结果表明桑科植物叶片主要的植硅体类型为硅化毛细胞和毛细胞基部,另外有少量边缘平直的多边板型、棒型、具瘤点的圆锥型。此外,前人曾在俄罗斯哈巴罗夫斯克边疆区的大麻叶片、茎秆、花序中发现硅化毛细胞、毛细胞基部、椭圆型等植硅体[52]。这些植硅体形态与本研究在大麻果皮中发现的不规则多边板型植硅体形态差异显著。
3.2大麻植硅体形态参数分析
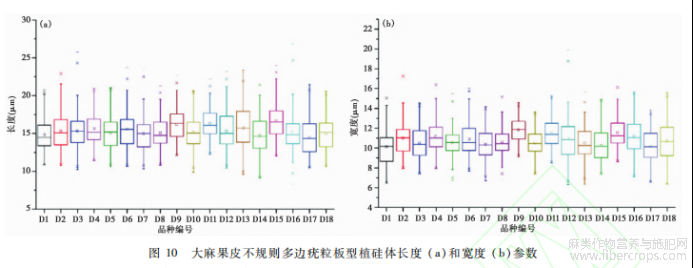
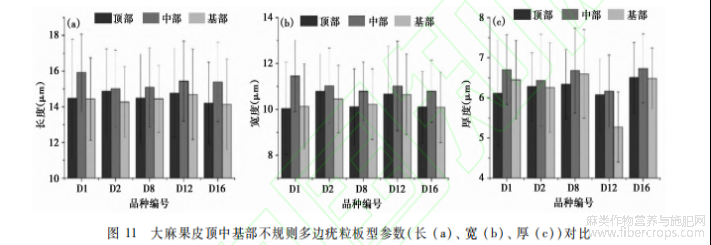
大麻各类型植硅体中,不规则多边平滑板型、不规则多边疣粒板型、鱼骨型、星状板型、褶状板型形态较为典型。为了了解植硅体产生的位置,我们调查并解剖观察了大麻果皮的结构,由外向内依次是角质膜、表皮层、厚壁细胞层、薄壁细胞层;另外,我们进行了多次不同程度的湿式氧化,当氧化程度较浅时,可以保留植物部分有机组织或纤维,可以观察到植硅体的原位保存状态,进而确定其存在的位置。不规则多边疣粒板型和不规则多边平滑板型植硅体发育于大麻果皮中木质化的栅栏状厚壁组织细胞层,由石细胞硅化而成,是果实最坚硬的部分,具支撑作用。在果皮碎片边缘通常能借助光学显微镜观察到不规则多边疣粒板型植硅体呈链状分布,我们推测其形成原因为果皮破裂时受力导致碎片边缘发生90°翻折,使得原本的片状平面拼图形翻折到侧面,呈现出链状分布。鱼骨型、星状板型、不规则长片型、褶状板型植硅体发育于薄壁细胞层。薄壁细胞常常处于被挤扁的状态,其形态多样,可分化为臂状、分枝、星芒等,因此其硅化后可形成多种形态的植硅体。果皮的厚壁细胞层与薄壁细胞层分层分布,因此不规则多边疣粒板型、不规则多边平滑板型、鱼骨型、星状板型、不规则长片型、褶状板型等各类型植硅体呈三层分布结构,不规则多边疣粒板型和不规则多边平滑板型植硅体呈方向固定的双层嵌套结构。不规则多边疣粒板型在最上层呈平面拼图状分布,不规则多边平滑板型位于第二层呈平面拼图状分布,不规则多边疣粒板型背面乳突与不规则多边平滑板型正面凹槽嵌套(图5-16,17,18,19;图6-10,11)。鱼骨型、星状板型、不规则长片型和褶状板型为薄壁细胞发育的不同形态,同为第三层,但硅化完全的个体数量极少,大都发育较差。在实际观察鉴定中,通常仅能观察到不规则多边板型植硅体双层嵌套结构。不规则多边疣粒板型和不规则多边平滑板型植硅体是大麻特有的、形态最为典型、产量最为丰富的植硅体类型,不规则多边疣粒板型植硅体产量尤为丰富。大麻不同品种的不规则多边疣粒板型植硅体,其形态和大小稳定,均无显著差异(图10)。D1、D2、D8、D12、D16这5个品种原产地分别为青海、山西、江苏、黑龙江、云南,地理位置相距较远,气候环境差异显著,可代表不同的区域和气候带。因此,以这5个品种为例,对同一品种果皮的顶部、中部、基部的不规则多边疣粒板型植硅体的长度、宽度、厚度进行对比分析,结果图11表明,大麻果皮中部的不规则多边疣粒板型植硅体的长度、宽度、厚度均略大于果皮顶部和基部不规则多边疣粒板型植硅体的长、宽、厚。统计结果表明,果皮中部不规则多边疣粒板型植硅体的长度平均比顶部和基部不规则多边疣粒板型植硅体的长度大0.9μm,果皮中部不规则多边疣粒板型植硅体的宽度平均比顶部和基部的大0.7μm,果皮中部不规则多边疣粒板型植硅体的厚度平均比顶部和基部的大0.3μm,但在误差范围内无显著差异,顶部和基部的植硅体大小无明显差异。我们推测果皮不同位置植硅体大小的差异可能与果实本身的生长特性有关。大麻的不规则多边疣粒板型植硅体,其本身的长度、宽度、厚度、主体厚度、乳突厚度、乳突数等参数呈线性正相关关系,也就是说不规则多边疣粒板型越大,厚度越厚,乳突越厚越多。
以上特征表明,大麻的不规则多边板型植硅体形态稳定,大小在误差范围内无显著差异不影响鉴定,其鉴定特征明显,不会与其他麻类作物植硅体混淆,不会与木本植物、草本植物中的植硅体以及其本身的硅化表皮组织混淆。虽然本研究仅采用了大麻北亚种,未对南亚种进行植硅体研究,但二者在生物学分类上为同属同种。一般认为,相同种属植物的植硅体形态相同或相近,如粟与其祖本青狗尾草同属不同种,有着形态相近的Ω植硅体[28],黍与其祖本野黍同属不同种,有着形态相近的η植硅体[31],籼稻与粳稻同属同种,均为稻的亚种,有着形态相近的水稻扇形植硅体[26]。虽然粳稻和籼稻的扇形植硅体在长、宽、厚、扇柄长、扇面长等形态参数上有着细微差异[24,53~59],但不影响利用水稻扇形植硅体鉴定稻的种属关系。因此,我们认为,大麻南亚种与北亚种的植硅体形态相近、无显著差异,不规则多边板型植硅体为大麻特有的植硅体类型,可作为鉴定大麻种属的特征植硅体,其中不规则多边疣粒板型植硅体产量尤为丰富,可作为鉴定大麻种属的主要特征植硅体。其主要鉴定特征为:(1)以下为大麻不规则多边疣粒板型3个典型的形态特征:i)单体为边缘棱角分明、正面具若干小型疣状突起、背面具0~3个大小相近的乳突的多裂片式不规则多边形板状结构(图5-6,10);ii)由若干形态相同、大小相近的单体通过边缘裂片间隙拼合为片状平面拼图形结构(图5-7,10;图6-5,7);iii)与不规则多边平滑板型植硅体形成双层嵌套结构(图5-16,17,18,19;图6-10,11)。(2)结合不规则多边疣粒板型植硅体参数特征,单体长度为15.4±2.3μm,宽度为10.8±1.7μm,厚度为6.2±10μm,可进一步确定其为大麻不规则多边疣粒板型植硅体。(3)若观察到表面呈不规则花瓣状、边缘圆润平滑呈花瓣状凸出、中部凹陷具褶皱状纹饰的多裂片式不规则多边形板状结构,且由若干形态相同、大小相近的单体通过边缘裂片间隙拼合为片状平面拼图形结构,单体长度为27.9±4.5μm,宽度为18.6±3.1μm,厚度为10.0±1.4μm,可鉴定其为大麻不规则多边平滑板型植硅体(图5-11,12,13,14,15.图6-7,8,9)。
3.3大麻植硅体形态大小的影响因素分析
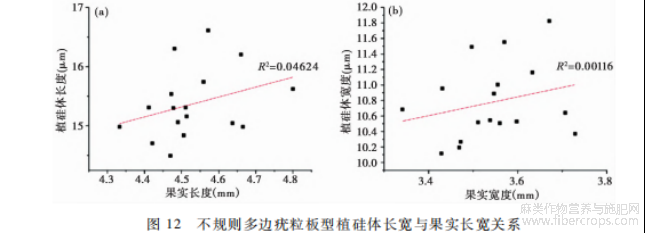
种子或果实颗粒的大小对植硅体的大小有一定影响,如粟和青狗尾草颗粒大小不同导致表皮长细胞大小不同,进而导致Ω型植硅体存在差异[28]。我们对18种大麻的果实进行参数测量,结果显示D16果实长度、宽度均最大,长宽比最小,其他17个品种的果实大小形态在误差范围内均无显著差异。由上文大麻植硅体形态参数分析可知,各品种大麻的不规则多边疣粒板型植硅体大小在误差范围内亦无显著差异。图12为去除异常值D16外,其他各品种的大麻果实长、宽与不规则多边疣粒板型植硅体长宽的关系,结果表明不规则多边疣粒板型植硅体的长宽与果实的长宽并无明显线性相关关系。图12不规则多边疣粒板型植硅体长宽与果实长宽关系气候环境的差异也会对植硅体的形态大小产生一定影响,如热带粳稻具有典型β型植硅体,温带粳稻具有中间型,但变异范围重叠[24]。本研究采用的18个品种的大麻样品其原产地遍及全国各地,包含17省、自治区,最东、最北可达黑龙江,最西可达新疆,最南可达广西,几乎囊括了中国全部的气候带。18个原产地的地理位置相距甚远,年降水量范围为150~1600mm,年均温范围为-23~24.8℃,气候环境差异显著。各品种大麻的不规则多边疣粒板型植硅体形态大小差异较小,其中长宽
相对较大的有D9、D11和D15,原产地分别为新疆、辽宁和广西巴马;长宽相对较小的有D1、D14和D17,原产地分别为青海平安、陕西和安徽六安,但仍在误差范围内。因此,植硅体形态大小与原产地的气候条件并无直接关系。在土壤及地层中所见到的植硅体经常有被溶蚀的现象,出现这种现象的因素是多方面的,如土壤的环境要素(温度、水分、pH值等)和土壤的化学成分[13]。土壤理化性质对植物生长发育同样会产生重大影响[60~61]。因此我们推测,大麻不同品种间植硅体大小的细微差异可能是受局地土壤环境影响所致。不同的土壤环境影响了大麻的生长和体内植硅体的发育,从而导致不同品种间植硅体在大小上存在细微差异。
4结论
本研究对大麻、红麻、黄麻、青麻、亚麻、苎麻等麻类作物的果实或种子进行了系统的的植硅体形态学研究,结果表明仅大麻果皮中存在形态特征明显且具有鉴定意义的植硅体,即不规则多边疣粒板型(长度为15.4±2.3μm,宽度为10.8±1.7μm,厚度为6.2±1.0μm)、不规则多边平滑板型(长度为27.9±4.5μm,宽度为18.6±3.1μm,厚度为10.0±1.4μm)和双层嵌套板型,均发育于大麻果皮厚壁细胞层。不规则多边疣粒板型植硅体的单体呈多裂片式不规则多边板状结构,边缘棱角分明。正面具覆盖表面的若干小型疣状突起;背面具0~3个大小相近的乳突;侧面观主要由三部分构成,中间主体部分呈不规则矩形,表面可见裂片纹饰具凹凸感,正面一侧具若小型疣状突起,背面一侧具0~3个小型乳突。不规则多边疣粒板型植硅体聚合形态为若干数量的单体通过边缘裂片间隙拼合为片状平面拼图形结构,侧面观则为链状分布。不规则多边平滑板型植硅体的单体亦呈多裂片式不规则多边形板状结构,边缘较为圆润平滑。正面观呈不规则花瓣状,整体较为平滑,边缘呈花瓣状凸出;背面观呈不规则花瓣状,表面平滑或具1个较大突起;侧面观主要由三部分构成,中间主体部分呈不规则矩形,表面可见裂片纹饰具凹凸感,正面一侧具若干突起,背面一侧具0~1个大型乳突。不规则多边平滑板型植硅体聚合形态也是由若干数量的单体通过边缘裂片间隙拼合为片状平面拼图形结构。不规则多边疣粒板型背面乳突与不规则多边平滑板型正面凹槽嵌套,形成方向固定的双层嵌套板型。大麻果皮的不规则多边板型植硅体,与木本植物、草本植物以及大麻不同部位的类似形态的植硅体差异显著,不易混淆。大麻不同品种间的不规则多边板型植硅体形态大小在误差范围内无显著差异,与不同品种的果实形态大小及气候条件无明显关系。另外大麻属仅有大麻一个现存种,两个亚种的不规则多边板型植硅体形态相近、无显著差异,其种内差异较小,形态大小稳定,可作为大麻的特征植硅体用以鉴定其种属,其中不规则多边疣粒板型植硅体形态特征更明显且产量更丰富,平均1g大麻果实的不规则多边疣粒板型植硅体产量可达10.2±0.4×106粒,可作为鉴定大麻种属的主要特征植硅体。在实际鉴定中,若观察到边缘棱角分明、表面具若干小型疣状突起的多裂片式不规则多边形板状结构,且由若干形态相同、大小相近(长度为15.4±2.3μm,宽度为10.8±1.7μm,厚度为6.2±10μm)的单体通过边缘裂片间隙拼合为片状平面拼图形结构,可鉴定其为大麻不规则多边疣粒板型植硅体。这一成果将为研究大麻起源、驯化和传播等植物考古工作提供新的手段和方法。
参考文献
[1]王群,杨佩文,李家瑞.大麻育种现状[J].中国麻业,2002,24(3):4-7.
[2]Russo E B.History of Cannabis and its preparations in saga.science, and sobriquet [J1. Chemistry & Biodiversity, 2007,4(8):1614-1648.
[3]孙安国.中国是大麻的起原地[J].中国麻作,1983,(3):45-48.
[4]孙永刚.大麻栽培起源与利用方式的考古学探索[J].农业考古,2016,(1):16-20.
[5]陈清奇.我国麻类作物栽培起源和栽培技术的发展[J].中国麻作,1984,(1) :39-40+21.
[6]甘在利,王明强.本草大麻当为古代五谷之麻考J.中医学报,2021.36(6):1347-1349.
[7]Ren M, Tang Z H, Wu X H. et al. The origins of Cannabissmoking:Chemical residue evidence from the first millennium BCE in the PamirsJ1. Science Advances,2019,5 (6). doi:10.1126/sciadv.aaw1391.
[8]戴蒂瑨.中国大麻起源、用途及其地理分布[J].西南师范大学学报(自然科学版),1989.(3):114-119.doi:10.13718/j. enki.xsxb.1989.03.021.
[9]付萍,孙永刚.哈民忙哈遗址生业方式研究--以植物考古学为中心[J1.农业考古,2015.(4):1-5.doi: enki:sun: nose.0.2015-04-003.
[10]傅文彬,邸楠,邵品,等.陕北靖边庙梁遗址浮选结果与分析J].第四纪研究,2022,42(1):119-128.
[11]唐丽雅,郑越,朱津,等.郑州地区周代农作物资源利用研究;以荥阳官庄为例[J].第四纪研究,2022,42(1):129-143.
[12]张松林,高汉玉.荥阳青台遗址出土丝麻织品观察与研究[J].中原文物,1999.(3):10-16.
[13]王永吉,吕厚远.植物硅酸体研究及应用[M].北京:海洋出版社,1993:1-228.
[14]Piperno D R.Phytolyth Analysis:An Archaeological and GeologicaPerspectiveM1.Amsterdam:Elsevier1988:1-277.
[15]吕厚远,刘东生,吴乃琴,等.末期间冰期以来黄土高原南部植被演答的植物硅酸体记录[J].第四纪研究,1999,(4):336-349.
[16]昌厚远.中国史前农业起源演化研究新方法与新进展[J].中国科学:地球科学,2018,48(2):181-199.
[17]张健平,吕厚远,葛勇,等.粟类作物稃片植硅体形态研究回顾与展望[J].第四纪研究,2019,39(1):1-11.
[18]Pearsall D M.Paleoethnobotany:A Handbook of Procedures(3rd)[M].Walnut Creek:Routledge2015:1-513
[19]邵孔兰,张健平,丛德新,等.植物微体化石分析揭示阿敦乔鲁遗址古人生存策略[J].第四纪研究,2019,39(1):37-47. Shao Konglan,
[20]Pearsall D M.Phytolith analysis:Application of a new paleoethnobotanicaltechniqueinarchaeologyJ.AmericanAnthropologist198284(4).862-871
[21]杨玉璋,黄程青,姚凌,等.湖北荆门屈家岭遗址史前农业发展的植硅体证据[J].第四纪研究,2020,40(2):462-471. Yang
[22]吕颖,张健平,唐淼,等.植硅体分析揭示成都平原先秦农业发展及其环境背景分析--以宝墩和三星村遗址为例[门].第四纪研究2021.41(5):1475-1488.
[23]Pearsall D M,Piperno D R,Dinan E H,et al. Distinguishing rice(Oryza-Sativa Poaceae) from wild Oryza species through phytolith analysis-results of preliminary research[J]. Economic Botany,1995, 49(2):183-196.
[24]Sato YI,Fujiwara H,Udatsu T. Morphological differences insilica body derived from motor cell of indica and japonica in rice[ J].Japan Journal of Breed,1990,40(4):495-504.
[25]Zhao Z J,Pearsall D M,Benfer RA,et al.Distinguishing rice(Oryza sativa poaceae)from wild Oryza species through phytolith analysisI:Finalized method[J].Economic Botany,1998,52(2):134-145.
[26]王灿,吕厚远.水稻扇型植硅体研究进展及相关问题[J].第四纪研究,2012.32(2):269-281.
[27]Lu H Y, Zhang J P. Wu N O, et al. Phytoliths analysis for thediscrimination of foxtail millet( Setaria italica)and common millet(Panicum miliaceum)[J].PLoS One,2009, 4(2):e4448. doi:10.1371/journal.pone.0004448.
[28]Zhang J PLu H Y, Wu N Q, et al. Phytolith analysis for differentiating between foxtail millet(Setaria italica) and greer foxtail( Setaria viridis)[J1. PLoS One,2011. 6 (5):e19726 doi:10.1371/journal.pone.0019726.
[29]Madella M,Lancelotti C,Garcia-Granero J J. Millet microremains-An alternative approach to understand cultivation and use ofcritical crops in prehistory[J]. Archaeological & Anthropological Sciences2013, 8(1):17-28.
[30] Weisskopf A RLee G A.Phytolith identification criteria for foxtailand broomcorn millets:A new approach to calculating crop ratios[J]Archaeological and Anthropological Sciences,20168(1):29-42.
[31]Zhang J P, Lu H Y,Liu M x, et al. Phytolith analysis for differentiating between broomcornmillet(Panicum miliaceum)and its weed/feral type(Panicum ruderale) [J]. Scientific Reports,2018. 8(1):13022.doi:10.1038/s41598-018-31467-6
[32]Mulholland S C,Rapp G,Ollendorf A L. Variation in phytoliths fromcorn leaves[J].Canadian Journal of BotanyRevue Canadienne De Botanique,1988,66(10);2001-2008.
[33]Piperno D R,Pearsall D M. Phytoliths in the reproductive structuresof maize and teosinte:Implications for the study of maize evolution[J]. Journal of Archaeological Science,1993,20(3):337-362
[34]Holst I,Moreno J E,Piperno D R.Identification of teosinte, maizeand Tripsacum in Mesoamerica by using pollen, starch grains,and phytoliths[J]. Proceedings of the National Academy of Sciences of the United States of America2007104(45):17608-17613
[35]Parry D WSmithson F.Opaline silica in the inflorescences of some Britishgrassesand cereals[J]. Annals of Botany,1966,30(3):525-538.
[36]Tubb H J,Hodson M J,Hodson G C.The inflorescence papillae of the Triticeae: A new tool for taxonomic and archaeologica research[J]. Annals of Botany1993,72(6):537-545
[37]Ball T B,Gardner J s,Anderson N.Identifying inflorescence phytoliths from selected species of wheat(Triticum monococcum T.dicoccon,T.dicoccoides,and T.aestivum)and barley(Hordeum vulgare and H.spontaneum)(Gramineae)[J]. American Journal of Botany,1999,86(11):1615-1623.
[38]Ball T B,Gardner J S,Anderson N. An approach to identifying inflorescence phytoliths from selected species of wheat and barley[M]//Meunier J D,Colin Feds.Phytoliths:Applications in Earth Science sand Human History.Leiden:A Balkema Publishers.2001:289-301.
[39]方嘉禾,常汝镇.中国作物及其野生近缘植物--经济作物卷[M].北京:中国农业出版社,2007:368-381.
[40]张桂琳,裴盛基,杨崇仁.大麻的分类与毒品大麻[J].中国麻作, 1991,(2):7-9.doi:cnki:sun:zgmz.0.1991-02-002.
[41]卢延旭,董鹏,崔晓光,等.工业大麻与毒品大麻的区别及其可利用价值[J].中国药理学通报,2007.(8):1112-1114. doi:103321/i.issn:1001-19782007.08.031.
[42]AvicoU.Pacifici R.Zuccaro P.Variations of tetrahydrocannabinol content in Cannabis plants to distinguish the fiber-type from drug type plants[J].Bulletin on Narcotics, 1985, 37(4):61-65
[43]胡久清.苎麻形态学研究(六)--籽实的形态结构和种子结实率[J].湖南农学院学报,1983,(1):53-57.doi:enki:sun: hnnd.0.1983-01-007.
[44]王永吉,吕厚远,衡平.植物硅酸体的分析方法[J].植物学报,1994,36(10):797-804.
[45]Neumann K,Stromberg C A E,Ball T,et al. International Codefor Phytolith Nomenclature(ICPN)2.0[J]. Annals of Botany2019, 124(2):189-199.
[46]Lisztes-Szabo Z,Braun M,Csik A,et al.Phytoliths of six woody species important in the Carpathians:Characteristie phytoliths in Norway spruce needles[J].Vegetation History and Archaeobotany2019,28(6) :649-662
[47]Mercader J, Bennett T, Esselmont C, et al. Phytoliths in woody plants from the Miombo woodlands of Mozambique[J].Annals of Botany,2009. 104(1):91-113.
[48]胡木兰,左丽,介冬梅,等.东北地区草本植物和木本植物植硅体的形态特征鉴别分析[J].微体古生物学报,2018.35(2):122-139.
[49]Wallis L. An overview of leaf phytolith production patterns in selected Northwest Australian flora[J]. Review of Palaeobotany and Palynology,2003, 125(3-4);201-248.
[50]Ge Y,Lu H Y, Wang C, et al. Phytoliths in selected broad leavedtreesinChina[J].ScientificReports,2020,10(1):15577.doi.10.1038/s41598-020-72547-w
[51]葛勇.中国常见现代植物植硅体形态研究及应用[D].北京;中国科学院大学博士学位论文,2016:109
[52]Golokhvast K S,Fedorov A V,Korobeev AI,et al.Microparticles of silica( phytoliths )found in Cannabis sativa from Khabaroysky Krai(Russia)[Jl.DefectandDiffusionForum2018.386:262-267.doi.10.4028/www.scientifc.ne/DDF.386.262
53]顾海滨.遗址水稻硅质体籼粳性质判别方法综述[J].湖南考古辑刊,2009,(0):268-276.
[54]张文绪,王莉莉.7个稻种叶片硅酸体的研究[J].中国农业大学学报,1998, 3(3):21-25.
[55]藤原宏志,佐佐木章.プラント?オパ-ル分析法の基础研究(2)-イネ(Oryza)属植物いおけ为机动细胞珪酸体の形状.考古学と自然科学,1978,(11):55-65.
[56]王才林,宇田津彻朗,藤原宏志,等.栽培稻机动细胞硅酸体的形态特征及其在籼、粳亚种间的差异[J].江苏农业学报,1997, 13(3) :2-11.
[57]王才林,藤原宏志,佐藤洋一郎,等.栽培稻机动细胞硅酸体形态性状的主成分分析[1].江苏农业学报,1998,14(1):2-9
[58]Zheng Y F,Dong Y J. Matsui A, et al. Molecular genetic basis ofdetermining subspecies of ancient rice using the shape of phytoliths[J].JournalofArchaeologicalScience,2003,30(10):1215-1221
[59]Wang C L,Udatsu T,Fujiwara H.Relationship between moto cell silica body sharp and grain morphological/physiological traits for discriminating indica and japonica rice in China[J].Japanese Journal of Breeding,1996,46(1):61-66.
[60]Cairns J EImpa S M,Price A H. Influence of the soil physical environment on rice(Oryza sativa L.) response to drought stress and its implications for drought research[J]. Field Crops Research2011. 121(3):303-310.
[61]胡华冉,刘浩,邓纲,等.不同盐碱胁迫对大麻种子萌发和幼苗生长的影响[J].植物资源与环境学报,2015,24(4):61-68 Hu Huaran,Liu Hao,Deng Gang,et al.Effects of different salt- alkaline stresses on seed germination and seedling growth of Cannabis sativa[J]. Journal of Plant Resources and Environment,2015, 24(4):61-68.
文章摘自:王聪,张健平,吕厚远.麻类作物植硅体形态研究[J/OL].第四纪究:1-17[2022-11-13].http://kns.cnki.net/kcms/detail/11.2708.p.20220929.0917.014.html