摘 要:亚麻(LinumusitatissimumL.)是世界上重要的纤维作物,赤霉素对亚麻的生长发育起着重要的调控作用。通过对亚麻赤霉素氧化酶基因GA2ox、GA3ox和GA20ox进行全基因组鉴定和序列分析,并运用转录组和实时荧光定量PCR技术分析亚麻快速生长期茎尖中GAoxs的表达水平。本研究从亚麻全基因组共鉴定出23个赤霉素氧化酶基因,其中GA2ox类11个、GA3ox类4个,GA20ox类8个,分布于除6、7、9号染色体外其他染色体上;亚麻赤霉素氧化酶基因包含2~4个外显子;蛋白质理论分子量在35.36~47.71kD之间;等电点为5.25~8.90;基因结构和保守结构域分析发现Motif1、Motif2、Motif3、Motif4、Motif5、Motif6、Motif9、Motif10是大部分基因所共有的,Motif8是GA2ox所特有的。系统发育分析将23个赤霉素氧化酶基因聚类在4个分支上。转录组结果表明,在高杆和矮杆亚麻快速生长期的茎尖中有6个基因差异表达,分别为4个GA2ox(LuGA2ox5,LuGA2ox6,LuGA2ox10,LuGA2ox11)和2个GA20ox(LuGA20ox5,LuGA20ox7)。结合各基因在亚麻组织中的特异性表达分析,表明在茎尖特异性表达的LuGA20ox7可能与营养生长期的株高形成相关。本研究为解析亚麻赤霉素氧化酶基因的结构特征及其在亚麻生长发育中的表达模式提供了理论参考。
关键词:亚麻;赤霉素氧化酶;基因家族;基因表达;株高
赤霉素(GAs)作为植物六大激素之一,参与植物生长发育的许多过程(Sun,2000),能够促进种子的萌发(Peng and Harberd,2002)、茎的伸长(Zhang et al.,2016)、叶的膨大(Nigel et al.,1991)、花的发育(Ameha et al.,1998)以及果实的成熟(Gomes et al.,2018)等。在高等植物中,赤霉素的合成途径和信号转导途径已经明确,其中关键成分也已被确定。由于赤霉素的重要作用,赤霉素氧化酶(GAoxs)在植物体内都是由多基因家族组成,在不同的发育阶段发挥不同的生物学作用。GAoxs属于2-酮戊二酸-双加氧酶(2OG-FeII_Oxy)超家族,通过不同的基因家族独立编码(Han and Zhu,2011)。GA2ox、GA3ox和GA20ox是GAs生物代谢中的三个关键酶,其中GA2ox是赤霉素的降解过程中的关键酶,可降解植物中有活性的赤霉素(黄桃鹏等,2015),从而对植物的生长起到一定的抑制作用;而GA3ox和GA20ox是赤霉素合成过程中的关键限速酶,且受到植物体内本身GAs水平的负反馈调节(Fleet and Sun,2005),决定植物体内活性赤霉素的含量。
植物株高与赤霉素水平和信号转导相关,与此相关的“绿色革命”极大的提高了作物的产量(陈子奇,2019;韩美玲等,2020)。GAoxs功能的鉴定为植物体内赤霉素的调控机制和GAs的复杂功能提供了更清晰的认识,调节GAoxs的表达可以调控某些植物体内源性的激素水平。番茄中SlGA2ox1和SlGA20ox1的过表达分别导致植物内源性赤霉素降低(Chen et al.,2016)和诱导单性结实(Oikawa et al.,2004)。南瓜CmGA3ox1的过表达会导致GAs过量表型(Radi,2006)。豌豆PsGA3ox1的过表达改变GAs生物合成和植物表型(Reinecke et al.,2013)。因此,通过基因工程等手段调控GAs水平的表达能够加速优良性状的改造并指导育种。
亚麻是人类最早使用的天然植物纤维,在世界范围内被广泛种植,然而种植密度、倒伏、茎粗等因素限制着亚麻纤维的产量。亚麻的植株高度与纤维产量品质密切相关。在所有激素中,赤霉素对调节植物高度至关重要(魏灵珠等,2012)。有研究表明在亚麻快速生长期叶面喷施赤霉素可增加植物的株高,纤维直径等指标,并能达到增产的目的(王学东等,2002)。适当浓度的赤霉素也有助于提高亚麻种子的发芽率和发芽势(刘栋等,2018)。在亚麻快速生长期,韧皮纤维的伸长与次生细胞壁的加厚是两个不同的发育阶段,在主茎上距离顶端5~7cm的分界点SP(Snap point)点处,之上为韧皮纤维细胞伸长阶段,之下为细胞壁加厚阶段(Gorshkova et al.,2005)。这两个不同的发育过程分别决定成熟亚麻的纤维长度和直径(江海霞等,2017)。同时,SP点之上的细胞伸长也是纤用亚麻株高形成的重要发育阶段。
赤霉素氧化酶基因家族成员的鉴定和生物学功能已在多个物种中有报道,如拟南芥(Ivo et al.,2007)、水稻(Lo et al.,2008)、黄瓜(Sun et al.,2018)、葡萄(He et al.,2019)等,但是关于亚麻GAoxs的鉴定及赤霉素与株高关系的研究还未见报道。本研究对亚麻GAoxs基因进行了鉴定并探究了SP点上部与赤霉素相关基因的表达,以期找出与亚麻株高相关的基因,为亚麻的分子育种提供参考。
1结果与分析
1.1亚麻LuGAox基因家族的鉴定
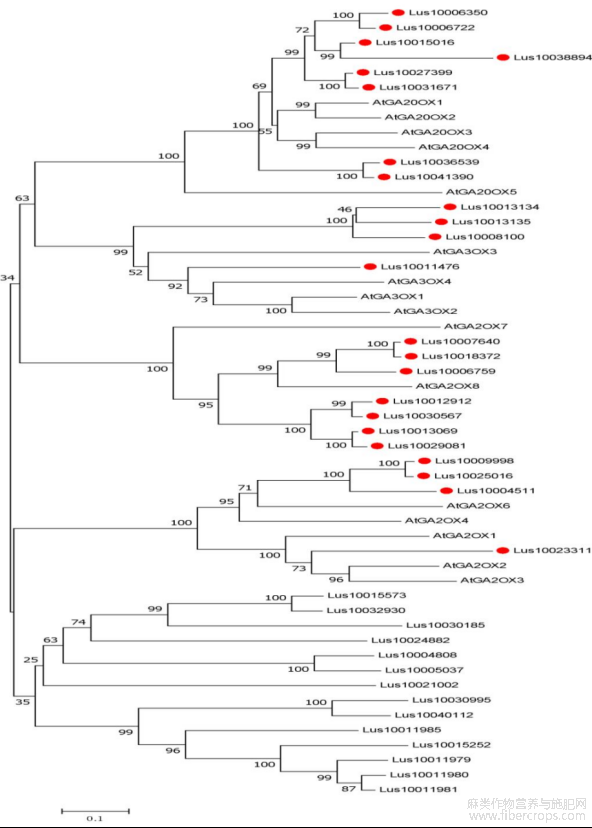
以拟南芥16个GAoxs蛋白序列在Phytozome数据库进行BLASTP检索,选取E值<10-5的基因,根据基因注释并通过Pfam和SMART在线软件进行进一步检索以确定2OG-FeII_Oxy(PF03171)和DIOX_N(PF14226)两个结构域的存在,共获得37个基因。利用上述获得的37个基因的蛋白序列和拟南芥的16个GAoxs蛋白序列构建了系统发育树(图1)。根据聚类结果分析确定了11个GA2ox、4个GA3ox、8个GA20ox,共计23个亚麻赤霉素氧化酶基因家族成员。根据它们在染色体上的顺序分别命名为LuGA2ox1~LuGA2ox11、LuGA3ox1~LuGA3ox4和LuGA20ox1~LuGA20ox8。这三类LuGAox基因分布于12条染色体上,其中11和15号染色体上分布最多,染色体1、2、4、5、13仅有一个基因分布,未有LuGAox基因定位于6、7、9号染色体(表1)。
图1 亚麻候选GAoxs基因的系统发育分析
1.2亚麻LuGAox基因家族理化性质分析
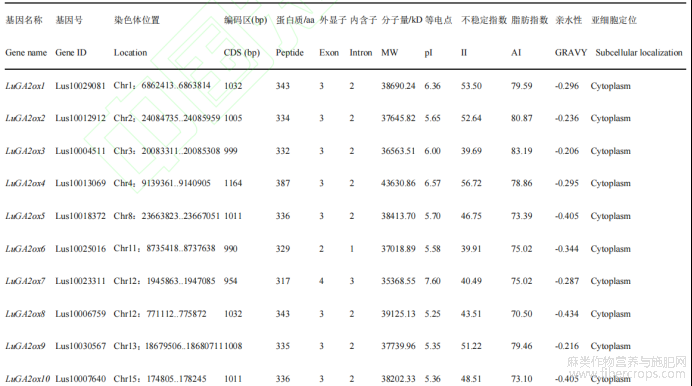
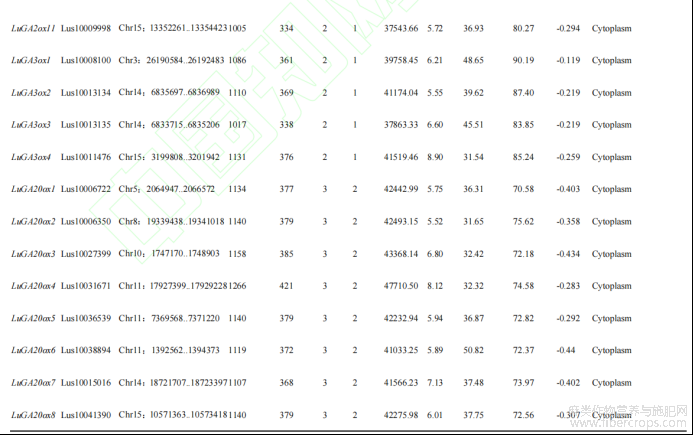
运用软件(ExPaSy)进行分析发现,LuGAox基因编码序列位于954bp(LuGA2ox7)~1266bp(LuGA20ox4)之间,编码317~421个氨基酸;外显子大都为2~4个不等,其中只有LuGA2ox7为4个外显子;三类LuGAox的分子量在35.36~47.71kD;蛋白质的等电点预测值在5.25~8.90,其中有4个蛋白(1个GA2ox,1个GA3ox,2个GA2ox)呈碱性,其余多数蛋白呈酸性;LuGA2ox中有72.7%(8个)、LuGA3ox中有50%(2个)的蛋白不稳定指数大于40,LuGA20ox蛋白只有12.5%(1个)不稳定指数大于40,表明LuGA2ox和LuGA3ox氧化酶稳定性强于LuGA20ox氧化酶;三类LuGAox脂肪指数在70.50~90.19;亲水性在-0.119~-0.44,均为亲水性蛋白。亚细胞定位预测显示,亚麻LuGAox基因均定位于细胞质(表1)。
表1 亚麻LuGAox基因理化性质分析
1.3亚麻LuGAox基因结构和蛋白保守结构域分析
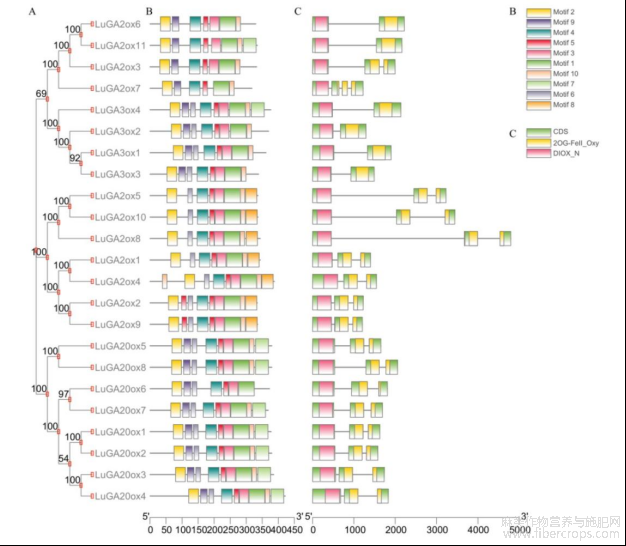
运用亚麻的23个LuGAox蛋白序列进行系统发育和结构分析。发现所有基因含有的Motif为7~9个不等,motif1、motif2、motif3、motif4、motif5、motif6、motif9、motif10是大部分基因所共有的,Motif8是LuGA2ox亚家族所特有的(图2B)。分析基因的保守结构域发现23个GAox基因均含有2OG-FeII_Oxy和DIOX_N两个保守结构域(图2C)。这三类赤霉素氧化酶基因长度大都在3kb以内,个别基因如LuGA2ox8达到5kb左右(图2C)。
图2 LuGAox保守基序、基因结构及结构域
注:A:LuGAox进化树;B:LuGAox保守基序及图注;C:LuGAox保守结构域及基因结构
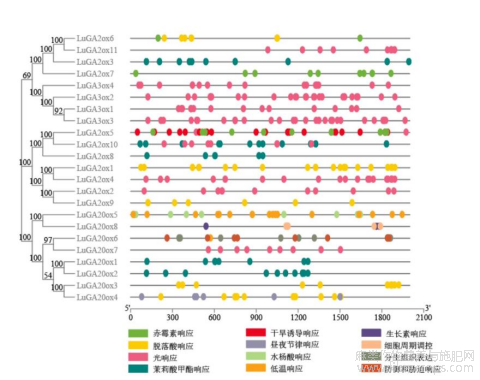
1.4亚麻LuGAox基因启动子顺式作用元件分析
为了进一步探究LuGAox的功能,运用PlantCare软件对LuGAox基因上游启动子元件进行预测,结果显示启动子区存在一些与激素、光周期信号、胁迫响应等相关的顺式作用元件(图3)。在这些LuGAox启动子上如赤霉素(GAs)、脱落酸(ABA)、茉莉酸甲酯(Me-JA)、水杨酸(SA)和生长素(IAA)等与激素相关的元件数量多分布广,而与逆境胁迫相关元件相对较少。有一些基因上仅含有一种响应元件,如LuGA2ox5、LuGA2ox6、LuGA2ox7基因仅含有赤霉素响应的元件;LuGA2ox1、LuGA2ox9和LuGA20ox3仅含有与脱落酸响应的元件。LuGA20ox5和LuGA20ox8则分别含有与水杨酸和生长素响应的元件,说明植物激素调节及相互作用可能通过这些氧化酶类起作用。LuGA2ox5、LuGA20ox6、LuGA20ox5分别含有与干旱、抵御胁迫、低温的响应元件,可能参与了植物抵御非生物逆境的胁迫。LuGA3ox1~4、LuGA2ox2、LuGA2ox4、LuGA2ox11和LuGA20ox7尽管属于不同的氧化酶亚家族,但都仅含有与光周期响应相关的元件,且数量也相似,可能参与日照长度、光质等调控GAs的合成。
图3 LuGAox启动子顺式作用元件
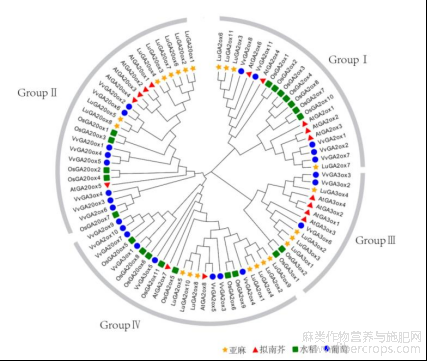
1.5亚麻LuGAox基因系统发育分析
根据进化关系,将亚麻(Lu)、拟南芥(At)、水稻(Os)、葡萄(Vv)的赤霉素氧化酶分为4个分支(图4)。分支Ⅰ由各家族的C19-GA2ox基因构成,大多数的GA20ox分布在分支Ⅱ中,分支Ⅲ由GA3ox类基因构成,分支Ⅳ则分布着各物种的C20-GA2ox基因和个别物种的GA20ox基因和GA3ox基因,如VvGA20ox7、OsGA20ox5、OsGA20ox6、OsGA20ox8及VvGA3ox5。从聚类分析的结果上看,亚麻的氧化酶总是能与葡萄的聚在一起,表现出较近的亲缘关系。
图4 亚麻,拟南芥,水稻,葡萄的赤霉素氧化酶的系统发育树
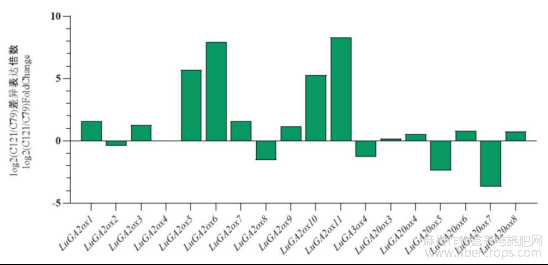
1.6亚麻LuGAox基因表达分析
对高杆品种C79和矮杆品种C121的SP点上部在快速生长期进行赤霉素氧化酶基因的差异表达分析(DEG)(图5),其中LuGA3ox1、LuGA3ox2、LuGA3ox3、LuGA20ox1、LuGA20ox2的FPKM值在高杆和矮杆中均为0。选取FDR<0.05及|log2FoldChange|≧2的基因作为差异表达基因,共获得6个DEGs,其中GA2ox居多,4个GA2ox(LuGA2ox5、LuGA2ox6、LuGA2ox10、LuGA2ox11)在矮杆材料中高表达,而2个GA20ox(LuGA20ox5、LuGA20ox7)在高杆材料中高表达,它们表达趋势与株高的变异一致,表明这些赤霉素氧化酶基因可能参与亚麻株高的形成。因GA2ox和GA20ox酶类分别是钝化和合成赤霉素的关键酶,选择其中差异最显著的LuGA2ox11和LuGA20ox7进行下一步分析。
图5 亚麻LuGAox差异表达基因分析
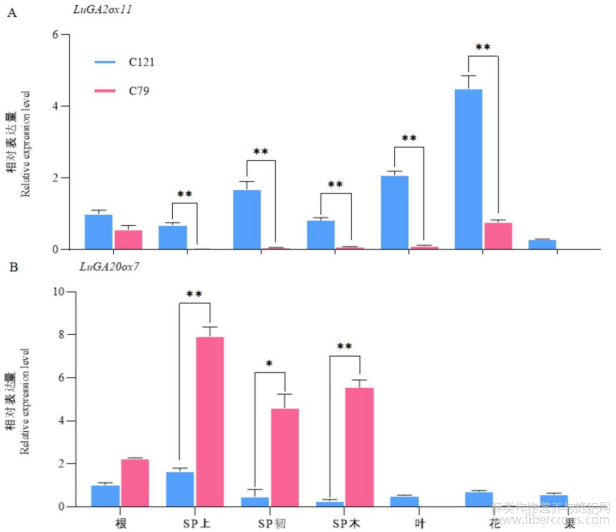
为了进一步探讨赤霉素氧化酶基因在亚麻茎尖伸长中的作用,我们分析了LuGA2ox11和LuGA20ox7在亚麻不同发育阶段和组织中的表达模式(图6)。结果表明,LuGA2ox11和LuGA20ox7基因在亚麻不同发育阶段的组织中均表达,其中LuGA2ox11基因表现为非组织特异性表达。LuGA2ox11在矮杆品种C121的主茎SP上部的表达量显著高于高杆品种C79,此处的结构与细胞伸长相关,即GAs含量较低,细胞的伸长受到了抑制,与C121较矮一致。同时LuGA2ox11基因在矮杆C121的SP韧、SP木、叶和花中的表达均高于高杆C79,可能与其早开花,同时细胞壁增厚和早熟有关,且C121无明显的快速生长阶段即进入花期促进成熟(图6A)。LuGA20ox7基因呈现茎秆特异性表达,在高杆C79的SP上、SP韧、SP木表达量均显著高于矮杆C121,特别是在快速生长期的SP上部,LuGA20ox7在高杆C79中的表达量远高于矮杆C121,表明LuGA20ox7在茎秆的发育中起着非常重要的作用,且与茎尖的伸长相关(图6B)。因此我们推测LuGA20ox7参与亚麻株高的形成,值得继续进行研究。
图6 LuGA2ox11和LuGA20ox7基因表达谱分析
注:A:LuGA2ox11表达谱;B:LuGA20ox7表达谱Note:A:LuGA2ox11expression profile;B:LuGA20ox7 expression profile
2讨论
赤霉素对植物生长发育至关重要,GAoxs是维持内源赤霉素水平的关键酶。本研究在亚麻中共鉴定出11个GA2ox、4个GA3ox、8个GA20ox共23个LuGAox成员。基因的保守基序分析发现,motif8是LuGA2ox亚家族所特有的,在水稻等物种中也有类似的保守基序的报道(Han and Zhu,2011),可能与它们本身基因功能不同相关。将系统发育树与基因结构及保守基序分析进行比较,发现在每一个亚家族中最密切相关的成员都具有相似的基因结构及基序组成,如LuGA20ox类基因。基因结构多样性和基序组成的模式表明每个亚家族的进化都是保守的,可以为多基因家族的进化关系提供重要证据(Babenko et al.,2004)。在鉴定的基因数目上,GA2ox基因较其他物种较多,或许是驯化选择所致。启动子顺式作用元件分析显示,这些LuGAox除了受赤霉素(GAs)调节之外,同样也受到茉莉酸甲酯(Me-JA)、水杨酸(SA)和生长素(IAA)、脱落酸(ABA)及光周期、胁迫等的调控,与苹果中的相关研究(董凤等,2018)一致。且发现虽然这三类属于GAoxs基因,但仅有LuGA2ox5、LuGA2ox6、LuGA2ox7基因含有赤霉素响应的元件,可能是这些基因受到赤霉素信号转导的组分的调节(Fukazawa et al.,2017)。亚麻(Lu)、拟南芥(At)、水稻(Os)及葡萄(Vv)的系统发育分析表明,不同于分支Ⅲ的均为GA3ox类基因,GA20ox和GA2ox则分布于其他几个分支中,说明GA3ox序列更为保守,而推测GA20ox和GA2ox在进化的过程中序列发生了变化,这种现象在水稻、芝麻中也有相似的报道(Han and Zhu,2011;盛晨等,2019)。
GA2ox和GA20ox分别是降解和合成赤霉素的关键酶,小麦TaGA2oxA9表达增加产生较矮表型(Ford et al.,2018),拟南芥中GA20ox1单核苷酸缺失导致侏儒表型(Luo et al.,2015),说明调控它们的表达有助于获得理想的株型。转录组分析中值得关注的是LuGA2ox11与LuGA20ox7是分别是GA2ox和GA20ox中表达量差异最为显著的两个基因,它们在水稻中的同源基因OsGA2ox6、OsGA20ox1也已被证明是影响水稻的节间的伸长(Oikawa et al.,2004)。实时荧光定量PCR分析发现LuGA2ox11基因呈现组成型表达模式,与C79(高)相比,C121(矮)无明显的快速生长阶段,开花早,其启动子顺式作用元件中仅含有与光周期响应的元件,推测LuGA2ox11在C121全生育期钝化活性GAs,抑制了植株生长(Ford et al.,2018)。LuGA20ox7基因的启动子上亦仅有与光周期响应的原件,且其在C79 (高)茎中具有组织特异性,结合LuGA20ox7在繁殖器官中表达较低,推测该基因主要在营养生长时期响应光信号促进GAs合成,从而加速茎的伸长(Jose and Gil,2002)。说明LuGA20ox7基因对亚麻株高的调控有重要的作用。本研究对LuGAox的分析将为理解LuGAox家族的相关基因提供理论依据。
3材料与方法
3.1试验材料
试验于2020年5月~9月在新疆乌鲁木齐市米东区实验田(43°96´E,87°68´N)进行。供试材料为亚麻高杆品种C79(株高120cm)和矮杆品种C121(株高27cm)。在亚麻快速生长期和对两个品种的主茎SP点上部(简称SP上)、主茎SP点下部韧皮部(简称SP韧)、主茎SP点下部木质部(简称SP木)、根、叶、花期的花、果共7个组织进行采样,每个样品设置3个生物学重复,液氮速冻并保存于-80℃冰箱。
3.2亚麻LuGAox基因的鉴定
从TAIR网站下载拟南芥GAoxs共16个基因的蛋白序列,在Phytozome数据库中对拟南芥中的16个GAoxs的蛋白质序列进行BLASTP检索,选取E值<10-5(盛晨等,2019)的基因并去除冗余序列,获得候选基因。通过SMART和Pfam在线软件进行检索确认候选基因中是否存在2OG-FeII_Oxy(PF03171)和DIOX_N(PF14226)两个结构域。
3.3亚麻LuGAox基因的生物信息学分析
利用ExPASy在线软件分析亚麻LuGAox基因的理化性质。Cell-PLoc2.0(Chou and Shen,2007)用于亚细胞定位的预测。MEME(Baliley et al.,2006)用于GAox蛋白质的保守基序结构分析。Pfam和SMART用于GAox蛋白的保守结构域的分析。使用TBtools(Chen et al.,2020)从进化角度分析基因结构、保守基序和保守结构域。利用PlantCare(Lamarca et al.,2002)网站进行顺式作用元件预测,并用TBtools进行顺式作用元件的可视化。根据文献获得了拟南芥(At)、水稻(Os)、葡萄(Vv)的GAox的蛋白序列,结合鉴定的亚麻(Lu)GAoxs的蛋白序列,利用MEGA7.0对4个物种构建系统发育树。
3.4亚麻LuGAox基因表达分析
亚麻茎尖组织RNA测序数据来源于本课题组先前的研究。从C79(高)和C121(矮)茎尖的转录组数据中选取亚麻GA2ox、GA3ox、GA20ox相关基因的表达数据,比较LuGAox基因在高杆和矮杆间的表达差异。根据表达差异倍数和P值挑选两个基因LuGA2ox11和LuGA20ox7进行组织特异性表达分析,对高杆亚麻C79和矮杆亚麻C121的根、茎(SP上,SP韧,SP木)、叶、花、果进行实时荧光定量PCR分析。用全式金RNA提取试剂盒进行总RNA提取,使用Thermo核酸定量仪进行RNA定量,参照abm第一链合成试剂盒说明书合成cDNA。以合成的cDNA为模板,LuETIF1为内参基因(Tanthanuch et al.,2008),使用ABIPRISM7500进行实时荧光定量PCR检测,反应条件为50℃2min,95℃30s;95℃5s,60℃30s,72℃30s,40个循环,相对表达水平用2-ΔΔCt方法进行分析。
参考文献
[1]Ameha M.,Skirvin R.M.,Mitiku G.,and Bullock D.,1998,In vitro tendril and flower development in cucumber (Cucumis sativus) may be regulated by gibberellins,J.Hort.Sci.Biotechnol.,73(2):159-163.
[2]Baliley T.L.,Nadya W.,Chris M.,and Wilfred W.L.,2006,MEME:discovering and analyzing DNA and protein sequence motifs,Nucleic Acids Res.,34(1):369-373.
[3]Babenko V.N.,Rogozin I.B.,Mekhedov S.L.,and Koonin E.V.,2004,Prevalence of intron gain over intron loss in the evolution of paralogous gene families,Nucleic Acids Res.,32(12):3724-3733.
[4]Chen S.,Wang X.J.,Zhang L.Y.,Lin S.S.,Liu D.C.,Wang Q.Z.,Cai S.Y.,Rania E.T.,and Gan L.J.,2016,Identification and characterization of tomato gibberellin 2-oxidases (GA2oxs) and effects of fruit-specific SlGA2ox1 overexpression on fruit and seed growth and development,Hortic.Res-England.,3(1):16059-16065.
[5]Chen C.J.,Chen H.,Zhang Y.,Thomas H.R.,Frank M.H.,He Y.H.,and Xia R.,2020,TBtools:An integrative Toolkit developed for interactive analyses of big biological data,Molecular Plant.,13(8):1194-1202.
[6]Chen Z.Q.,2019,Deactivation of endogenous GA leads to a semi-dwalf maize,Dissertation for Ph.D.,Harbin Normal University,Supervisors:HAO D.Y.,pp.13-14.(陈子奇,2019,利用钝化内源赤霉素策略创制半矮秆玉米,博士学位论文,哈尔滨师范大学,导师:郝东云,pp.13-14).
[7]Chou K.C.,and Shen H.B.,2007,Cell-PLoc:a package of Web servers for predicting subcellular localization of proteins in various organisms,Nature Protocols.,3(2):153-162.
[8]Dong F.,Zhang D.,Fan S.,Ma X.L.,Meng Y.,Zuo X.Y.,Liu X.J.,Li K.,Liu Z.,and Han M.Y.,2018,Genome-wide identification and expression analysis of GA2ox,GA3ox and GA20ox in apple,Yuanyi Xuebao (Acta Horticulturae Sinica),45(4):613-626.(董凤,张东,樊胜,马小龙,孟媛,左希亚,刘小杰,李珂,刘桢,韩明玉,2018,苹果赤霉素氧化酶基因GA2ox,GA3ox和GA20ox家族全基因组鉴定及表达分析,园艺学报,45(4):613-626.)
[9]Fleet C.M.,and Sun T.P.,2005,A DELLAcate balance:The role of gibberellin in plant morphogenesis,Curr.Opin.Plant Biol.,8(1):77-85.
[10]Ford B.A.,Foo E.,Sharwood R.E.,Havrankova M.,Vrana J.,Millan C.M.,Nichols D.S.,Steuernagel B.,Uauy C.,Dolezel J.,Chandler P.M.,and Spielmeyer W.,2018,Rht18 Semi-dwarfism in wheat is due to increased expression of GA 2-oxidaseA9 and lower GA content,Plant Physiol.,177(1):168-180.
[11]Fukazawa J.,Mori M.,Watanabe S.,Miyamoto C.,Ito T.,Takahashi Y.,and Note A.,2017,DELLA-GAF1 complex Is a main component in gibberellin feedback regulation of GA20 oxidase 2,Plant Physiol.,175(3):1395-1406.
[12]Gomes M.D.,Barro-Trastoy D.,Escoms E.,Saura-Sanchez M.,Sanchez I.,Briones A.,Vera-Sirera F.,Carrera E.,Ripoll J.J.,Yanofsky M.F.,Lopez-Diaz I.,Alonso J.,and Perez-Amador M.A.,2018,Gibberellins negatively modulate ovule number in plants,Development,145(1):163865-163876.
[13]Gorshkova T.A.,Ageeva M.,Chemikosova S.,and Salnikov V.,2005,Tissue-specific processes during cell wall formation in flax fiber,Plant Biosystems,139(1):88-92.
[14]Han F.,and Zhu B.,2011,Evolutionary analysis of three gibberellin oxidase genesin rice,Arabidopsis,and soybean,Gene,473(1):23-35.
[15]Han M.L.,Tan R.J.,and Chao D.Y.,2020,A new progress of green revolution:Epigenetic modification Dual-regulated by gibberellin and nitrogen supply contributes to breeding of high yield and nitrogen use efficiency rice,Zhiwu Xuebao (Chinese Bulletin of Botany),55(1):5-8.(韩美玲,谭茹姣,晁代印,2020,“绿色革命”新进展:赤霉素与氮营养双重调控的表观修饰助力水稻高产高效育种,植物学报,55(1):5-8.)
[16]He H.,Liang G.,Lu S.,Wang P.,Liu T.,Ma Z.,Zuo C.,Sun X.,Chen B.,and Mao J.,2019,Genome-Wide Identification and Expression Analysis of GA2ox,GA3ox,and GA20ox Are Related to Gibberellin Oxidase Genes in Grape (Vitis Vinifera L.),Genes,10(1):680-700.
[17]Huang T.P.,Li J.J.,and Wang R.,2015,Progress in Study of Gibberellins Biosynthesis and Signaling Transduction Pathway,Zhiwu Shengli Xuebao (Journal of Plant Physiology),51(8):1241-1247.(黄桃鹏,李媚娟,王睿,2015,赤霉素生物合成及信号转导途径研究进展,植物生理学报,51(8):1241-1247.)
[18]Ivo R.,Ruiz-Rivero O.,Fernandez-Garcia N.,Griffiths J.,and Stephen J.,2007,The gibberellin biosynthetic genes AtGA20ox1 and AtGA20ox2 act,partially redundantly,to promote growth and development throughout the Arabidopsis life cycle,Plant J.,53(1):488-504.
[19]Jiang H.X.,Guo D.L.,Li Y.H.,Yan W.L.,Yang L.J.,and Xie L.Q.,2017,The Expression of Genes Related to Cell Wall Formation at Fast Growth Stage in Flax (Linum usitatissimum L.),Zhongguo Nongye Kexue (Scientia Agricultura Sinica),50(13):2442-2450.(江海霞,郭栋良,李玉环,闫文亮,杨亮杰,2017,亚麻快速生长期细胞壁形成相关基因的表达分析,中国农业科学,50(13):2442-2450.)
[20]Jose G.M.,and Gil J.,2002,Light Regulation of Gibberellin Biosynthesis and Mode of Action,J.Plant Growth Regul,.20(4) :354-368.
[21]Lamarca A.,Brunette W.,Koizumi D.,Lease M.,and Borriello G.,2002,PlantCare:An Investigation in Practical Ubiquitous Systems,International Conference.,2002(1):316-332.
[22]Liu D.,Ma J.F.,Guo N.,Guo Y.J.,Xu M.,Yang Q.,and Li A.R.,2018,Effects of Different Hormone Treatments on Seed Germination Characteristics of Linum nutans Maxim,Anhui Nongye Kexue (Journal of Anhui Agricultural Sciences),46(35):26-27.(刘栋,马建富,郭娜,郭英杰,徐敏,杨茜,李爱荣,2018,不同激素处理对野生亚麻种子萌发特性的影响,安徽农业科学,46(35):26-27.)
[23]Lo S.F.,Yang S.Y.,Chen K.T.,Hsing Y.I.,Zeevarrt J.A.D.,Chen L.J.,and Yu S.M.,2008,A Novel Class of Gibberellin 2-Oxidases Control Semidwarfism,Tillering,and Root Development in Rice,Plant Cell.,20(10):2603-2618.
[24]Luo Y.,Dong X.,Yu T.,Shi X.,Li Z.,Yang W.,Widmer A.,and Karrenberg S.,2015,A Single Nucleotide Deletion in Gibberellin20-oxidase1 Causes Alpine Dwarfism in Arabidopsis,Plant Physiol.,168(3):930-937.
[25]Nigel E.J.,Appleford,and Lenton R.,1991,Gibberellins and leaf expansion in near-isogenic wheat lines containing Rht1 and Rht3 dwarfing alleles,Planta,183(2):229-236.
[26]Oikawa T.,Koshioka M.,Kojima K.,and Kawata M.,2004,A role of OsGA20ox1,encoding an isoform of gibberellin 20-oxidase,for regulation of plant stature in rice,Plant Mol.Biol.,55(5):687-700.
[27]Peng J.,and Harberd N.P.,2002,The role of GA-mediated signalling in the control of seed germination,Curr.Opin.Plant Biol.,5(5):376-381.
[28]Radi A.,2006,Ectopic Expression of Pumpkin Gibberellin Oxidases Alters Gibberellin Biosynthesis and Development of Transgenic Arabidopsis Plants,Plant Physiol.,140(2):528-536.
[29]Reinecke D.M.,Wickramarathna A.D.,Ozga J.A.,Kurepin L.V.,Jin A.L.,Good A.G.,and Pharis R.P.,2013,Gibberellin 3-oxidase Gene Expression Patterns Influence Gibberellin Biosynthesis,Growth,and Development in Pea,Plant Physiol.,163(2):929-945.
[30]Sheng C.,Zhang Y.X.,Yu J.Y.,Gao Y.,Li D.H.,Zhou R.,Zhang X.R.,and Wang L.H.,2019,Identification and expression analysis of GA related genes in sesame,Zhongguo Youliao Zuowu Xuebao (Chinese Journal of Oil Crop Science),41(3):399-408.(盛晨,张艳欣,于景印,高媛,黎冬华,周瑢,张秀荣,王林海,2019,芝麻赤霉素合成相关基因鉴定与表达分析,中国油料作物学报,41(3):399-408.)
[31]Sun H.,Pang B.,Yan J.,Wang T.,Wang L.,Chen C.,Li Q.,and Ren Z.,2018,Comprehensive Analysis of Cucumber Gibberellin Oxidase Family Genes and Functional Characterization of CsGA20ox1 in Root Development in Arabidopsis,International J.Mol.Sci.,19(10):3135-3151.
[32]Sun T.P.,2000,Gibberellin signal transduction,Curr.Opin.Plant Biol.,3(5):374-380.
[33]Tanthanuch W.,Chantarangsee M.,Maneesam J.,and Ketudat-Cairns J.,2008,Genomic and expression analysis of glycosyl hydrolase family 35 genes from rice (Oryza sativa L.),BMC Plant Biol.,8(1):84-84.
[34]Wang X.D.,Li M.,and Cui L.,2002,Effect of Gibberellin on Fibre Yield of Flax,Zhongguo Maye (Plant Fiber And Products),3(24):13-14.(王学东,李明,崔琳,2002,赤霉素对亚麻纤维发育及产量的影响,中国麻业,3(24):13-14.)
[35]Wei L.Z.,Cheng J.H.,Li L.,and Wu J.,2012,Regulation of plant height by gibberellins biosynthesis and signal transduction,Shengwu Gongcheng Xuebao (Chinese journal of biotechnology),(2):19-28.(魏灵珠,程建徽,李琳,吴江,2012,赤霉素生物合成与信号传递对植物株高的调控,生物工程学报,(2):19-28.)
[36]Zhang N.,Xie Y.D.,Guo H.J.Zhao L.S.,Xiong H.C.,Gu J.Y.,Li J.H.,Kong F.Q.,Sui L.,and Zhao Z.W.,2016,Gibberellins regulate the stem elongation rate without affecting the mature plant height of a quick development mutant of winter wheat (Triticum aestivum L.),Plant Physiol.Biochem.,107(2016):228-236.
文章摘自:高艳芳,江海霞,郭栋良,刘慧青,颜清成,薛敏,谢丽琼.亚麻赤霉素氧化酶基因家族鉴定及表达分析[J/OL].分子植物育种:1-19[2022-09-11].