摘 要:本发明提供一种农杆菌介导的亚麻高效遗传转化方法,包括以下步骤:制备带有荧光标记的基因编辑载体pCPB-35S-Colour-hspCas9质粒;将目的基因靶标片段构建入上述质粒,将其转化至农杆菌感受态细胞进行表达,扩大培养后制备农杆菌侵染液;将农杆菌侵染液侵染亚麻花蕾,继续种植收获亚麻种子;挑选有荧光信号的种子进行种植,对叶片DNA进行PCR鉴定,扩增出荧光标记基因序列的植株即为亚麻阳性植株。本发明避免了愈伤组织的培养及植株再生过程,且添加了易于选择的荧光标记,节约了时间和人力,提高了亚麻遗传转化工作的效率,使亚麻转化可以批量进行,为亚麻种质创制及品种改良奠定了基础。
技术要点
1.一种农杆菌介导的亚麻高效遗传转化方法,其特征在于:包括以下步骤:
(1)制备带有荧光标记的基因编辑载体pCPB-35S-Colour-hspCas9质粒;
(2)将目的基因靶标片段构建入基因编辑载体pCPB-35S-Colour-hspCas9质粒,将其转化至农杆菌感受态细胞进行表达,扩大培养后制备农杆菌侵染液;
(3)将步骤(2)得到的农杆菌侵染液侵染亚麻花蕾,继续种植收获亚麻种子;
(4)挑选有荧光信号的亚麻种子进行种植,然后提取亚麻植株叶片DNA进行PCR鉴定,扩增出荧光标记基因序列的植株即为亚麻阳性植株。
2.根据权利要求1所述的方法,其特征在于:步骤(1)中,将荧光标记基因表达框连接至pCPB-35S-hspCas9载体的PmeI和HindIII双酶切位点之间,连接产物转化至感受态细胞中进行表达,得到带有荧光标记的基因编辑载体pCPB-35S-Colour-hspCas9质粒。
3.根据权利要求1所述的方法,其特征在于:步骤(1)中,所述pCPB-35S-hspCas9载体的构建方法为:将pCPB-ZmUbi-hspCas9载体中的玉米ZmUbi启动子替换为在双子叶植物中高表达的35S启动子。
4.根据权利要求1所述的方法,其特征在于:步骤(1)中,所述荧光标记包括红色、绿色和黄色荧光标记。
5.根据权利要求1-4任一项所述的方法,其特征在于:步骤(1)中,所述质粒为带有红色荧光标记DsRed表达框的pCPB-35S-Red-hspCas9。
6.根据权利要求1所述的方法,其特征在于:步骤(2)中,所述扩大培养后,菌液的OD600达到0.7-1.0,离心后弃上清,加入蔗糖溶液使OD600在0.5-0.7之间,之后加入SilwetL-77,获得农杆菌侵染液。
7.根据权利要求1所述的方法,其特征在于:步骤(2)中,将构建后的质粒转化至农杆菌感受态细胞时,质粒的加入量为0.2-0.6μg/100μL农杆菌感受态细胞。
8.根据权利要求1所述的方法,其特征在于:步骤(3)中,将大田健康生长的亚麻植株在侵染前剪掉周围的叶片、过小的花蕾、已开放的花或是荚果,选择0.4-0.6cm的花蕾进行侵染。
9.根据权利要求1所述的方法,其特征在于:步骤(3)中,所述侵染是将亚麻花蕾完全浸入农杆菌侵染液中,不断摇晃侵染液侵染亚麻花蕾110s-130s,侵染过的亚麻花蕾套上黑色纸袋以保持湿度并提供暗培养条件,23-25h后去掉纸袋,正常生长直至亚麻成熟。
技术领域
本发明涉及一种农杆菌介导的亚麻高效遗传转化方法。
背景技术
亚麻是亚麻科一种重要的双子叶植物,因其油用和纤维价值被广泛种植。亚麻籽中的α-亚麻酸含量在55%以上,是人类从植物中获取ω-3脂肪酸的最好来源之一。此外,亚麻籽中含有蛋白质、维生素E、膳食纤维及木酚素等营养物质,这使得亚麻籽具有增强免疫力,增强智力,预防心脑血管疾病及癌症,减缓人体衰老等作用。亚麻纤维具有“纤维皇后”的美誉,是纺织工业非常重要的原材料。因此,基于亚麻重要的食用及纤用价值,提高亚麻产量并改善其品质对亚麻产业发展至关重要。
转基因技术是改良作物品质和研究基因功能的重要途径之一,在农业生产及作物基础研究中具有非常广泛的应用前景。植物遗传转化方法主要有基因枪法、花粉管通道法、农杆菌介导法及病毒侵染。目前转基因技术已经成功应用于小麦、玉米、大豆、油菜及水稻等多种重要作物。
通过花粉管通道法、基因枪法、农杆菌介导法、病毒侵染都有可能进行亚麻遗传转化。然而,这些方法存在一些缺陷,基因枪法需要愈伤诱导和较长时间的组织培养才能获得再生植株,而且操作复杂,成本较高,无法进行大规模转化。农杆菌介导法成本低、操作简单,但传统的农杆菌转化需要通过组织培养才能获得植株,周期较长,且转化效率低。此外,传统的农杆菌介导的花序侵染法,或是首先在添加了抗生素等筛选试剂的培养基中进行筛选,移栽后通过PCR检测再次确认阳性植株;或是全部种植后提取DNA通过PCR检测获得阳性植株,费事费力且成本较高。花粉管通道法不需要通过组织培养,但花粉管通道法需要相当丰富的经验,亚麻花较小,操作难度大,而且效率较低。病毒侵染虽不需要进行组织培养,但外源基因无法整合到染色体,无法遗传给后代,不适合进行外源基因的稳定表达,而且病毒载体自身不稳定,容易发生变异,可能会诱发病害及造成外源基因丢失,因此无法广泛应用。
发明内容
为了解决现有技术中存在的问题,本发明提供了一种农杆菌介导的亚麻高效遗传转化方法。本发明的方法不需要组织培养,操作简便,易于掌握,适合进行大规模转化;避免了愈伤组织诱导、分化和植株再生等人工培养过程,避免了对实验设备和操作技术的高要求,大大节约了试验时间和成本;转化速度快,可直接收获种子,当年即可获得转基因植株;添加了易于选择的荧光标记,可通过Ds-Red荧光对种子进行初筛,筛选后的种子种植后再进行PCR检测,节省了时间和人力。
为实现上述技术目的,本发明采用以下技术方案:
本发明提供一种农杆菌介导的亚麻高效遗传转化方法,包括以下步骤:
(1)制备带有荧光标记的基因编辑载体pCPB-35S-Colour-hspCas9质粒;
(2)将目的基因靶标片段构建入基因编辑载体pCPB-35S-Colour-hspCas9质粒,将其转化至农杆菌感受态细胞进行表达,扩大培养后制备农杆菌侵染液;
(3)将步骤(2)得到的农杆菌侵染液侵染亚麻花蕾,继续种植收获亚麻种子;
(4)挑选有荧光信号的亚麻种子进行种植,然后提取亚麻植株叶片DNA进行PCR鉴定,扩增出荧光标记基因序列的植株即为亚麻阳性植株。
在本申请中,对于步骤(2)所述的目的基因靶标片段不作限制,可以是为敲除任何亚麻内源基因而设计的特定靶标序列,只要最终能够获得带有荧光标记的转基因亚麻即可。
作为优选,步骤(1)中,将荧光标记基因表达框连接至pCPB-35S-hspCas9载体的PmeI和HindIII双酶切位点之间,连接产物转化至感受态细胞中进行表达,得到带有荧光标记的基因编辑载体pCPB-35S-Colour-hspCas9质粒。
作为优选,步骤(1)中,所述pCPB-35S-hspCas9载体的构建方法为:将pCPB-ZmUbi-hspCas9载体中的玉米ZmUbi启动子替换为在双子叶植物中高表达的35S启动子。
作为优选,步骤(1)中,所述荧光标记包括红色、绿色和黄色荧光标记。
本申请可以使用现有技术中的常用荧光标记,对于荧光标记的类型没有具体限制,比如可以使用红色荧光标记DsRed。
作为优选,步骤(1)中,所述质粒为带有红色荧光标记DsRed表达框的pCPB-35S-Red-hspCas9。
作为优选,步骤(2)中,所述扩大培养后,菌液的OD600达到0.7-1.0,离心后弃上清,加入蔗糖溶液使OD600在0.5-0.7之间,之后加入SilwetL-77,获得农杆菌侵染液。
作为优选,步骤(2)中,将构建后的质粒转化至农杆菌感受态细胞时,质粒的加入量为0.2-0.6μg/100μL农杆菌感受态细胞。
作为优选,步骤(3)中,将大田健康生长的亚麻植株在侵染前剪掉周围的叶片、过小的花蕾、已开放的花或是荚果,选择0.4-0.6cm的花蕾进行侵染。
作为优选,步骤(3)中,所述侵染是将亚麻花蕾完全浸入农杆菌侵染液中,不断摇晃侵染液侵染亚麻花蕾110s-130s,侵染过的亚麻花蕾套上黑色纸袋以保持湿度并提供暗培养条件,23-25h后去掉纸袋,正常生长直至亚麻成熟。
与现有技术相比,本发明具有以下有益效果:
本发明利用农杆菌介导的花序侵染转化方法,避免了愈伤组织的培养和植株再生过程,消除了组织培养过程中可能发生的微生物污染及体细胞变异的风险,而且操作简单、成本低、实验周期短。
本发明利用农杆菌介导的花序侵染转化方法,采用黑色纸袋进行暗培养,不受植株生长环境的限制,可在田间大规模操作。
本发明利用农杆菌介导的花序侵染转化方法,在分枝较少、开放花朵较少的植株中更容易操作,有利于追踪侵染过的花朵及成熟期种子的挑选,同时通过荧光检测先对阳性种子进行初筛,种植后再进行PCR检测,节省了时间和人力,提高了亚麻遗传转化工作的效率,使亚麻转化可以批量进行,为亚麻种质创制及品种改良奠定了基础。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1为pCPB-35S-hspCas9质粒图谱。
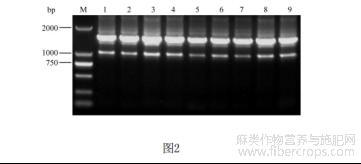
图2为DsRed连接至pCPB-35S-hspCas9载体的菌液PCR鉴定电泳图。其中,M:标准分子量DNA,1-9:9个大肠杆菌单菌落。
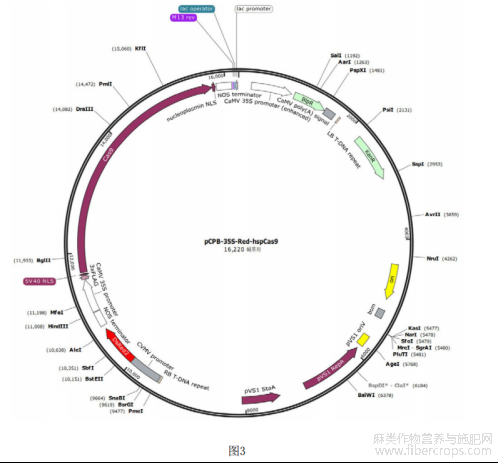
图3为pCPB-35S-Red-hspCas9质粒图谱。
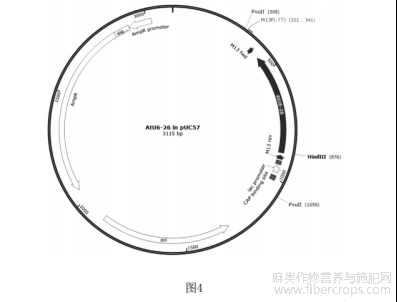
图4为AtU6-26质粒图谱。
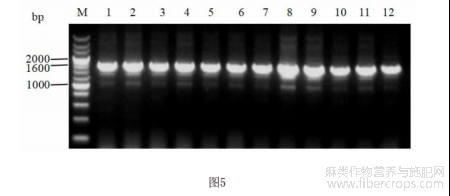
图5为农杆菌菌液PCR鉴定电泳图。其中,M:标准分子量DNA,1-12:12个农杆菌单菌落。
图6为亚麻转化的最佳状态。其中,图A展示待转化亚麻植株整体生长状态,图B展示待转化花蕾状态。
图7为T0代阳性种子DsRed检测。
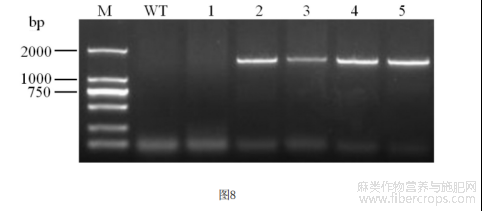
图8为阳性苗待选株PCR鉴定电泳图。其中,WT:野生型,1-5:阳性苗待选株。
图9为阳性苗生长状态。
具体实施方式
下面结合具体实施例对本发明的技术方案进行详细、完整的说明。需要说明的是,以下实施例仅用于帮助理解本发明,并不以任何形式对本发明进行限定。此外,在不脱离本发明构思的前提下,本领域普通技术人员可以做出一些变化和改进,这些都属于本发明保护的范围。
本发明所述的试验材料、设备,如无特殊说明,均为市售常规产品,本发明中所用实验方法,若为特殊说明,均为本领域常规方法。
实施例1
1亚麻转化受体的获取
以亚麻品种陇亚14号和陇亚15号为转化受体植株,3月25-31日将其种植在大田,在自然条件下生长,开花初期选择健康生长的植株进行遗传转化。
选择0.4-0.6cm的花蕾(图6B)用以转化,侵染前剪掉周围的叶片、过小的花蕾、已开放的花或是荚果。
注意:(1)花蕾太小,农杆菌侵染后容易导致花朵败育,为了保证转化效率并获得足够的转化种子,需选择合适大小的花蕾进行侵染;(2)侵染前剪掉周围的叶片、过小的花蕾、已开放的花或是荚果,一是为了保证待侵染的花蕾能充分接触侵染液,二是方便对侵染过的花蕾进行区分。
2荧光筛选载体构建
2.1pCPB-35S-hspCas9载体的构建:为本申请发明人依托华中农业大学保存的pCPB-ZmUbi-hspCas9载体(RNA-guided Cas9 as anin vivodesired-target mutator in maize中有该载体的构建方法;High-Throughput CRISPR/Cas9 Mutagenesis Streamlines Trait Gene Identification in Maize中提到了该载体),经过改造获得,将玉米ZmUbi启动子替换为在双子叶植物中高表达的35S启动子,以驱动Cas9基因在亚麻中高效表达。具体构建方法如下:
以中国农业科学院生物技术研究所保存的质粒CaMV 35S-Red(Genome-wide identification andfunctional characterization ofLEA genes during seed development process in linseed flax (LinumusitatissimumL.)中提到了这个载体,该载体由此文章发表单位构建)为模板,利用引物CRISPR-35S-F和CRISPR-35S-R扩增35S启动子,大小为572bp;同时用引物Cas9-F和PmlI-Cas9-R扩增pCPB-ZmUbi-hspCas9载体上Cas9起始位点和PmlI酶切位点之间的片段,大小为2944bp;最后以CRISPR-35S-F和PmlI-Cas9-R为引物,以前两个扩增产物为模板,扩增overlap片段,大小为3496bp。
PCR扩增体系如下:
总体系50μL
2×PCR buffer for KOD FX 25μL
dNTP(2mM)10μL
KOD FX聚合酶1μL
上游引物(10μM)1.5μL
下游引物(10μM)1.5μL
模板DNA(300ng/μL)1μL
ddH2O 10μL。
模板DNA分别为质粒CaMV 35S-Red和pCPB-ZmUbi-hspCas9。
其中的引物序列为:
上游引物CRISPR-35S-F:
CGACGGCCAGTGCCAAGCTTGATCCCATGGAGTCAAAGATTCAAA(SEQ ID No.1);
下游引物CRISPR-35S-R:GGAATTCCCAGTCCCCCGTGTTCTC(SEQ ID No.2)。
上游引物Cas9-F:
CACGGgggactgGGAATTCCATGGACTATAAGGACCACGACGGAG(SEQ ID No.3)
下游引物PmlI-Cas9-R:TCCAGGATCTGTGCCACGTGCTTTGTGATCTGCCGGGTTTCCAC(SEQ ID No.4)
PCR扩增程序:94℃预变性2min;98℃变性10s;55℃退火30s,68℃延伸1kb/min,35个循环;72℃延伸10min,4℃结束。
引物CRISPR-35S-F和PmlI-Cas9-R扩增产物经1%琼脂糖凝胶电泳后,用AxyPrep TM DNA Gel Extraction Kit(AXYGEN,下同)进行回收,片段大小为3496bp。
用HindIII+PmlI对载体质粒pCPB-ZmUbi-hspCas9进行双酶切,经1%琼脂糖凝胶电泳后,采用AxyPrep TM DNA Gel Extraction Kit回收大小为11.4kb左右的条带。
HindIII+PmlI双酶切体系及条件如下:
总体系50μL
HindIII 1μL
PmlI 1μL
10×NEB Buffer2.1 5μL
质粒DNA 5μL
ddH2O 38μL
酶切程序:37℃24h。
用ClonExpress®MultiS One Step Cloning Kit同源重组连接试剂盒将CRISPR-35S-F和PmlI-Cas9-R扩增片段连接至pCPB-ZmUbi-hspCas9。
连接体系如下:
5×CE Multis Buffer 4μL
Exnase Multis 2μL
CRISPR-35S-F/PmlI-Cas9-R扩增产物1μL
pCPB-ZmUbi-hspCas9载体13μL
连接程序:37℃30min。
转化:将DH5α大肠杆菌感受态细胞置于冰上溶解10~15min,取上述连接产物10μL缓慢加入到感受态细胞中,轻轻吸打混匀,置于冰上静置30min;42℃水浴90s,之后立即置于冰上冷却5min;加入800μLLB液体培养基(不含抗生素);37℃,200rpm振荡培养45min;6000rpm,离心3min,吸掉700μL上清,用剩余液体重悬菌体涂于LB平板上(含50ug/mLKan);37℃倒置培养16h左右;挑取单克隆于37℃,200rpm振荡培养过夜(16h左右);用引物CRISPR-35S-F和PmlI-Cas9-R做菌液PCR检测,挑选阳性菌液保存菌液并送测序。挑选测序正确的菌液扩大培养,37℃,200rpm振荡培养过夜,利用AxyPrep TM Plasmid Miniprep Kit(AXYGEN,下同)提取质粒。将新载体命名为pCPB-35S-hspCas9,图谱见图1。
菌液PCR体系为:总体系25μL,包括PCR mix(2×)12.5μL、引物各0.5μL(0.2μmol/L)、模板2μL、水9.5μL;PCR程序为:95℃预变性10min,95℃变性30s,55℃退火30s,72℃延伸1kb/10s,35个循环,72℃延伸10min。
图1为pCPB-35S-hspCas9质粒图谱。
2.2DsRed表达框制备
本发明中红色荧光标记DsRed表达框(CVMV-DsRed-Nos)的序列通过设计引物从中国农业科学院生物技术研究所保存的质粒CaMV35S-Red中克隆获得。
以质粒CaMV35S-Red为模板,利用引物Red-F和Red-R扩增DsRed表达框,用KOD FX聚合酶对DsRed表达框进行扩增,扩增体系及程序同步骤2.1。凝胶回收后,利用ClonExpress®MultiS One Step Cloning Kit同源重组试剂盒,将扩增产物连接至pCPB-35S-hspCas9载体PmeI和HindIII双酶切位点间。其中上下游引物5’端均有14个核苷酸序列与载体相应连接位置重复,且含有与载体相对应的酶切位点,以便进行同源重组连接。
其中的引物序列为:
上游引物Red-F:
GTCAAACACTGATAGTTTAAACCTAGTAGAAGGTAATTATCCAAGATGTAGC(SEQ ID No.5);
下游引物Red-R:GACTCCATGGGATCAAGCTTCCCGATCTAGTAACATAGATGACACC(SEQ ID No.6)。
引物Red-F和Red-R扩增产物经1%琼脂糖凝胶电泳后,用AxyPrep TM DNA Gel Extraction Kit进行回收,片段大小为1568bp,即为DsRed表达框基因序列。
2.3DsRed筛选载体构建
用PmeI+HindIII对载体质粒pCPB-35S-hspCas9进行双酶切,经1%琼脂糖凝胶电泳后,采用AxyPrep TM DNA Gel Extraction Kit回收大小为14.7kb左右的条带,获得pCPB-35S-hspCas9的线性片段。
PmeI+HindIII双酶切体系及条件如下:
总体系50μL
HindIII 1μL
PmeI 1μL
10×NEB Buffer2.1 5μL
质粒DNA 5μL
ddH2O 38μL
酶切程序:37℃24h。
用ClonExpress®MultiS One Step Cloning Kit同源重组连接试剂盒将DsRed表达框连接至pCPB-35S-hspCas9。
连接体系如下:
5×CE Multis Buffer4μL
Exnase Multis2μL
DsRed表达框回收产物1μL
pCPB-35S-hspCas9载体13μL
连接程序:37℃30min。
将连接产物转化大肠杆菌DH5α,转化过程同步骤2.1,用引物Red-F和Red-R做菌液PCR检测(检测结果见图2),挑选阳性菌液保存菌液并送测序。菌液PCR体系及程序同步骤2.1。挑选测序正确的菌液扩大培养,37℃,200rpm振荡培养过夜,利用AxyPrep TM Plasmid Miniprep Kit提取质粒。将新载体命名为pCPB-35S-Red-hspCas9,图谱见图3。
图2为DsRed连接至pCPB-35S-hspCas9载体的菌液PCR鉴定电泳图。其中,M:标准分子量DNA,1-9:9个大肠杆菌单菌落。
图3为pCPB-35S-Red-hspCas9质粒图谱。
3CYP79敲除载体构建
本发明中的载体pCPB-35S-Red-hspCas9为基因编辑载体,可用于亚麻任何内源基因的编辑。
本实施例中以亚麻CYP79基因为例,构建CYP79基因的敲除载体,并转化亚麻。根据CYP79基因编码序列设计特异性靶标并进行扩增,凝胶回收之后利用ClonExpress®MultiS One Step Cloning Kit同源重组试剂盒连接至步骤2制备的pCPB-35S-Red-hspCas9载体的HindIII酶切位点。靶标扩增引物上下游引物5’端均有14个核苷酸序列与载体相应连接位置重复,且含有与载体相对应的酶切位点,以便进行同源重组连接。
3.1靶标设计与扩增
利用http://crispr.dbcls.jp/网站在线对CYP79基因进行靶标设计,共设计两个特异性靶标。靶标扩增过程如下:
3.1.1以AtU6-26F1和AtU6-26R做引物,本研究室构建的AtU6-26质粒为模板(将合成的AtU6-26启动子序列连接至pUC57载体的HindIII酶切位点,测序正确后将新载体命名为AtU6-26,图谱见图4),扩增第一个靶标的U6Promotor,大小为458bp;以AtU6-26F2和AtU6-26R做引物,AtU6-26质粒为模板扩第二个靶标的U6Promotor,大小为458bp;用KODFX聚合酶对两个靶标的promoter进行扩增,扩增体系及程序与步骤2.1相同。
图4为AtU6-26质粒图谱。
AtU6-26启动子序列如下:
CGTTGAACAACGGAAACTCGACTTGCCTTCCGCACAATACATCATTTCTTCTTAGCTTTTTTTCTTCTTCTTCGTTCATACAGTTTTTTTTTGTTTATCAGCTTACATTTTCTTGAACCGTAGCTTTCGTTTTCTTCTTTTTAACTTTCCATTCGGAGTTTTTGTATCTTGTTTCATAGTTTGTCCCAGGATTAGAATGATTAGGCATCGAACCTTCAAGAATTTGATTGAATAAAACATCTTCATTCTTAAGATATGAAGATAATCTTCAAAAGGCCCCTGGGAATCTGAAAGAAGAGAAGCAGGCCCATTTATATGGGAAAGAACAATAGTATTTCTTATATAGGCCCATTTAAGTTGAAAACAATCTTCAAAAGTCCCACATCGCTTAGATAAGAAAACGAAGCTGAGTTTATATACAGCTAGAGTCGAAGTAGTGATTG(SEQ ID No.7)
3.1.2以AtU6-26-CYP79-TargetF1和Red-gRR为引物,phU6-gRNA(上海昂羽生物技术有限公司)为模板扩增第一个靶标+SgRNA片段,大小为138bp;用AtU6-26-CYP79-TargetF2和Red-gRR为引物,phU6-gRNA质粒为模板扩增第二个靶标+SgRNA片段,大小为138bp;用KOD FX聚合酶对两个靶标+SgRNA片段进行扩增,扩增体系及程序与步骤2.1相同。
3.1.3以AtU6-26F1和Red-gRR为引物,将步骤3.1.1中扩增得到的第一个靶标的U6Promotor和步骤3.1.2中扩增得到的第一个靶标+SgRNA片段各稀释50倍后,作为模板共同加入到同一PCR反应体系中进行扩增,扩增体系及程序与步骤2.1相同。1%琼脂糖凝胶电泳后,用AxyPrep TM DNA Gel Extraction Kit进行回收,片段大小为577bp,测序确认序列正确后,得到靶标1插入片段,-20℃保存备用。
以AtU6-26F2和Red-gRR为引物,将步骤3.1.1中扩增得到的第二个靶标的U6-Promotor和步骤3.1.2中扩增得到的第二个靶标+SgRNA片段各稀释50倍后,作为模板共同加入到同一PCR反应体系中进行扩增,扩增体系及程序与步骤2.1相同。1%琼脂糖凝胶电泳后,用AxyPrep TM DNA Gel Extraction Kit进行回收,片段大小为577bp,测序确认序列正确后,得到靶标2插入片段,-20℃保存备用。
引物序列:
AtU6-26F1:CCATGGGATCAAGCTCGTTGAACAACGGAAACTCGACT(SEQ ID No.8)
AtU6-26F2:TGCTTTTTTTAAGCTCGTTGAACAACGGAAACTCGACT(SEQ ID No.9)
AtU6-26R:CAATCACTACTTCGACTCTAGCTGT(SEQ ID No.10)
AtU6-26-CYP79-targetF1:
TAGAGTCGAAGTAGTGATTGGCCATGAACACCTCCGACCGGTTTTAGAGCTAGAAATAGCAAGTT(SEQ ID No.11)
AtU6-26-CYP79-targetF2:
TAGAGTCGAAGTAGTGATTGAATGAAGGCGGTGGGTGTCGGTTTTAGAGCTAGAAATAGCAAGTT(SEQ ID No.12)
Red-gRR:CTAGATCGGGAAGCTTAAAAAAAGCACCGACTCG(SEQ ID No.13)。
3.2靶标连接
用HindIII对载体质粒CPB-35S-Red-hspCas9进行单酶切,经1%琼脂糖凝胶电泳后,采用AxyPrep TM DNA Gel Extraction Kit回收大小为16kb左右的条带,获得CPB-35S-Red-hspCas9的线性片段。
HindIII酶切体系及条件如下:
总体系50μL
HindIII 1μL
10×NEB Buffer2.1 5μL
质粒DNA 5μL
ddH2O 39μL
酶切程序:37℃2h。
用ClonExpress®MultiS One Step Cloning Kit同源重组试剂盒将靶标1回收片段连接至CPB-35S-Red-hspCas9载体。
连接体系如下:
5×CE Multis Buffer 4μL
Exnase Multis2μL
靶标1回收产物1μL
CPB-35S-Red-hspCas9载体13μL
连接程序:37℃30min。
将连接产物转化大肠杆菌DH5α,转化过程与步骤2.1相同,用引物Red-CRISPR-F和Red-CRISPR-R进行菌液PCR检测后保存菌液并送阳性菌液去测序,扩增片段大小为1022bp。菌液PCR体系及程序与步骤2.1相同。挑选测序正确的菌液扩大培养,37℃,200rpm振荡培养过夜,利用AxyPrep TM Plasmid Miniprep Kit试剂盒提取质粒。
引物序列:
Red-CRISPR-F:GAACTGTTCGCCAGTCTTTACGGC(SEQ ID No.14)
Red-CRISPR-R:TCACCTCCCACAACGAGGACTACA(SEQ ID No.15)。
连接靶标1后的质粒进行酶切回收,之后连接靶标2回收片段,菌液PCR检测后挑选阳性菌液测序,挑选测序正确的菌液扩大培养,提取质粒,所有程序与连接靶1相同,得到CYP79基因敲除载体质粒,菌液PCR扩增片段大小为1573bp。
4农杆菌转化及阳性克隆鉴定
4.1GV3101感受态制备
取2μL保存的农杆菌GV3101菌液于LB固体培养基(含50ug/mL Rif)划平板,28℃培养48h左右;挑取单克隆加入含有1mL LB(含50ug/mL Rif)的无菌离心管中,28℃培养过夜;吸取100μL菌液加入含有50mL LB(含50ug/mL Rif)的无菌三角瓶中,28℃培养过夜,至OD600=0.8-1.0;在超净工作台上将菌液转移至50mL无菌离心管中,并置于冰上;4℃4000rpm,离心10min,倒掉上清;用10mL100mMCaCl2溶液(-20℃预冷5min),轻轻悬浮菌体,冰浴30min。4℃4000rpm,离心10min,倒掉上清;加入4mL预冷的100mMCaCl2溶液与1mL75%的甘油(-20℃预冷5min),轻轻吸打混匀;快速分装于1.5ml的无菌离心管中,每管100μL,并立即于液氮中速冻,-80℃保存。
4.2农杆菌转化及鉴定
将冻存的100μL农杆菌GV3101感受态细胞于冰上融化,之后加入2μL(0.2-0.6μg)步骤3.2制备的CYP79基因敲除载体质粒,轻轻混匀后冰浴30min,液氮冷冻10min,之后立即于37℃水浴5min,取出后冰浴2min,加入800μL不含抗生素的LB液体培养基,28℃、200rpm振荡培养4h,6000rpm,离心3min后留100μL上清重悬菌体涂于含利福平(Rif)和卡那霉素(Kan)(利福平和卡那霉素浓度均为50ug/mL)的LB固体培养基,28℃倒置培养48h左右。
挑取若干单克隆分别加入含有1mL LB(含50ug/mL Rif和50ug/mL Kan)的2ml无菌离心管中,28℃,200rpm,培养过夜;取2μl菌液进行菌液PCR鉴定,所用引物、扩增体系及程序与连接靶标2后的菌液PCR鉴定相同。
从图5可以看出,挑取的12个单菌落在1600bp附近均具有目的条带,说明均为阳性克隆。
图5为农杆菌菌液PCR鉴定电泳图。其中,M:标准分子量DNA,1-12:12个农杆菌单菌落。
4.3制备农杆菌侵染液
将农杆菌阳性菌液接种于50mL新的LB液体培养基(含50ug/mL Rif和50ug/mL Kan)中,28℃、200rpm振荡培养15-20h,OD600达到0.7-1.0后,4000rpm离心10min后弃上清,用新鲜配制的灭菌的5%蔗糖溶液重悬菌体,使OD600在0.5-0.7之间,之后加入体积百分比0.05%Silwet L-77(Silwet L-77是一种高效有机硅表面活性剂,能够极大的降低水的表面张力,可湿润几乎所有植物组织的表面,相较于传统助剂,可以使农杆菌更加充分地覆盖花蕾),从而获得农杆菌侵染液。
菌液OD值对侵染效率至关重要,OD600在0.7-1.0之间农杆菌活性较高,侵染效率高。
4.4亚麻花序侵染
将适合侵染的亚麻花蕾完全浸入农杆菌侵染液中,不断摇晃侵染液,时间2min,侵染过的花蕾做好标记并套上黑色纸袋以保持湿度并提供暗培养条件,24h后去掉纸袋,正常生长直至种子成熟。转化后及时去除新长出的未转化的花序。
本发明中最佳侵染时间为2min,时间过短会影响转化效率,过长则容易对花蕾造成损伤,严重会导致花蕾败育,无法结实;本发明选择黑色纸袋保持湿度并提供暗培养条件,是因为本实施例是在大田进行侵染,且植株花蕾期正值高温,如果使用塑料袋或透气性差的其他材料,高温会导致花蕾损伤甚至枯萎;如果是在可以控制温度的人工气候室进行转化,则黑色纸袋、黑色塑料袋或其他可提供黑暗条件的材料皆可。
图6为亚麻转化的最佳状态。其中,图A展示待转化亚麻植株整体生长状态,图B展示待转化花蕾状态。
4.5亚麻阳性植株的获得
种子收获后,利用Hand-Held Lamp(LUYOR-3415RG)荧光装置观察DsRed荧光进行挑选,将有荧光信号的种子(图7)于温室中进行种植,幼苗期用CTAB法提取叶片DNA,用引物Red-CRISPR-JCF2和Red-CRISPR-JCR2进行PCR检测,可以扩增出目的条带(红色荧光标记基因)的植株即为阳性苗,条带大小为1526bp。PCR体系为:总体系25μL,包括PCR mix(2×)12.5μL、引物各0.5μL(0.2μmol/L)、模板2μL、水9.5μL;PCR程序为:95℃预变性5min,95℃变性30s,55℃退火30s,72℃延伸20s,35个循环,72℃延伸10min。
注:通过观察DsRed荧光初步挑选阳性种子,在很大程度上减少了阳性植株鉴定的工作量,提高了工作效率,而且可以降低检测成本。
图7为T0代阳性种子DsRed检测。
引物序列:
Red-CRISPR-JCF2:CTAGTAGAAGGTAATTATCCAAGATGTAGC(SEQ ID No.16)
Red-CRISPR-JCR2:CCCGATCTAGTAACATAGATGACACC(SEQ ID No.17)。
由图8看出,未转化野生型(WT)植株无目的条带,与理论一致;1号植株没有扩增出目的条带,不是阳性植株;除1号外,2-5号植株均能够扩增出目的条带,说明这些为阳性植株。
图8为阳性苗待选株PCR鉴定电泳图。其中,WT:野生型,1-5:阳性苗待选株。
图9为阳性苗生长状态。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
摘自国家发明专利,发明人:齐燕妮,李闻娟,张建平,王利民,谢亚萍,赵玮,党照,申请号:202211066001.7,申请日:2022.09.01