摘 要:研究以4份黄麻(圆果种和长果种各2份)为试验材料,采用黄麻组培苗的茎段为外植体,诱导胚性愈伤组织,建立植株再生体系。结果表明:利用均匀设计法进行培养基配制,圆果种黄麻愈伤组织诱导效果优于长果种黄麻,4个黄麻品种的排序为179>梅峰4号(M4)>尤溪长果(YC)>广巴矮(GBA)。4个黄麻品种的最佳培养基如下,179:MS+0.53mg/L 2,4-D+2.0mg/L 6-BA,愈伤组织诱导率100%;梅峰4号:MS+2.0mg/L TDZ+0.5mg/L 2,4-D,诱导率100%;尤溪长果:MS+2.0mg/L TDZ+2.0mg/L 6-BA,诱导率63%;广巴矮:MS+2.0mg/L TDZ+2.0mg/L 2,4-D+2.0mg/L 6-BA,诱导率52%。以生长良好的愈伤组织为材料,采用正交设计配制培养基进行不定芽和不定根诱导分化,结果表明,4个品种的诱导与再生能力差异显著,圆果种依然优于长果种,其诱导效果黄麻179>M4>YC>GBA。筛选出对4个品种都最佳的不定芽培养基9号,适合179的13号,适合M4和GBA的14号不定根培养基。黄麻179和M4获得再生植株,YC诱导出不定根,GBA只诱导出不定芽。
关键词:黄麻;愈伤组织;再生体系
黄麻是世界上种植规模仅次于棉花的重要纤维作物,其生产主要分布在亚洲的印度、孟加拉国等,是这些国家重要的经济作物。其主要的栽培品种有:“圆果种”(Corchorus capsularis L.)和“长果种”(Corchorus olitorius L.)。黄麻具有纤维产量高、质地柔软、吸湿性能好等诸多优点,广泛应用于商业、工业和建筑业领域。
植物组织培养经过百余年的发展,已经成为生物科学中一项不可或缺的技术,其对作物育种与遗传转化有重要的意义[1]。而构建植物组织的再生体系,尤其是植物愈伤组织的获得,更是原生质体融合、遗传转化、植株再生等的研究基础[2-3]。目前,国内外有关黄麻再生体系的研究报道较少,且多采用子叶和下胚轴作为离体培养的材料,同时存在愈伤组织易褐化,不定芽再生困难等问题[4-5]。目前已建立的黄麻再生体系的通用性仍然较差,建立稳定的黄麻再生体系十分必要。
本研究以不同基因型的黄麻幼茎为外植体,研究不同浓度的激素配比对黄麻愈伤组织的诱导,以及愈伤组织分化不定芽、不定根的差异,建立不同品种黄麻品种的再生体系,以期为进一步利用原生质体融合和遗传转化技术对黄麻种质资源进行改良奠定基础。
1材料与方法
1.1供试材料
试验种子为2份圆果种黄麻“梅峰4号”(以下称M4)、“179”,以及2份长果种黄麻“尤溪长果”(以下称YC)、“广巴矮”(以下称GBA),均由福建农林大学麻类作物遗传育种与综合利用实验室提供。
1.2仪器与试剂
仪器与设备:超净工作台、冰箱、光照培养箱、微波炉、高压蒸汽灭菌锅、烘干箱、pH计;
药品与试剂:无水乙醇、工业酒精、蒸馏水、次氯酸钠、氢氧化钠、蔗糖、琼脂粉等;
植物激素:噻苯隆(TDZ)、2.4-二氯苯氧乙酸(2,4-D)、6-苄氨基嘌呤(6-BA)、α-萘乙酸(NAA)、抗坏血酸(Vc)、吲哚丁酸(IBA)。
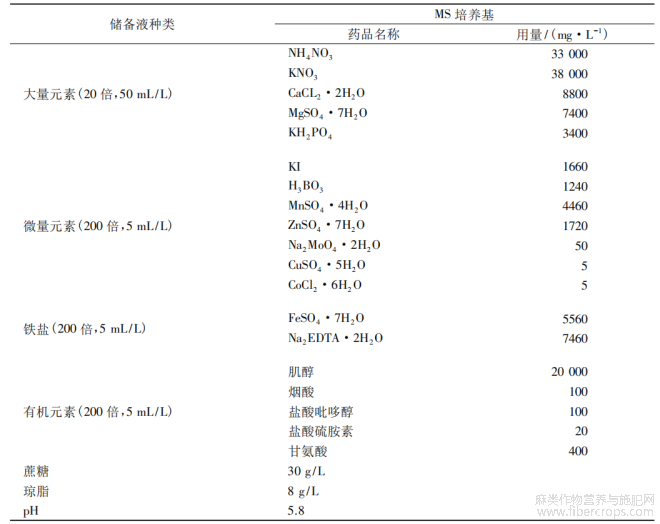
MS培养基见表1。
1.3试验方法
1.3.1黄麻无菌苗的获得
4个黄麻品种均选取籽粒饱满、大小一致的种子,用纯净水清洗半小时后晾干,备用。
(1)灭菌处理筛选
按照文献[6]的方法,在超净工作台上将准备好的黄麻种子进行灭菌处理,而后接种于3种MS培养基。3种培养基的配制方法参考文献[8-9]。
(2)培养条件
接种后,培养基置于光照培养箱,处理条件:光/暗交替16h/8h,温度25℃/20℃(白天/黑夜),光照强度为2000YC[6]。
表1 MS培养基配方
1.3.2愈伤组织的诱导
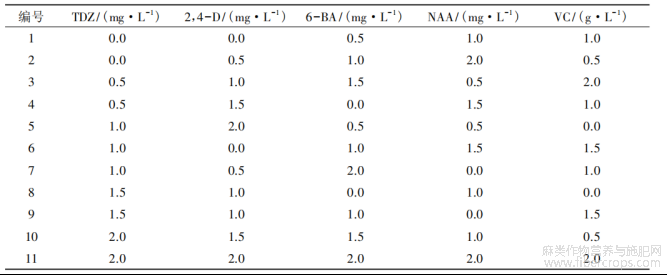
培养15d后,取无菌苗茎段,接种于MS培养基(不同激素配方)。15d转接一次,40d进行愈伤组织的诱导情况统计。每个激素组合处理20个茎段,4次重复。采用均匀设计法培养[7](表2)。
1.3.3不定芽诱导
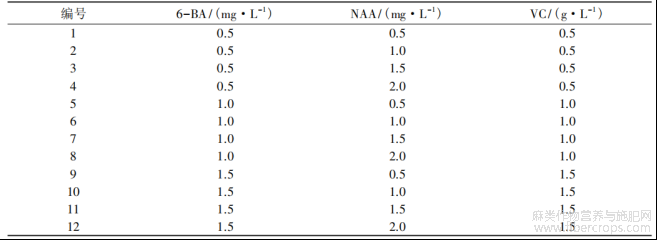
按表3的方案设计不定芽诱导MS培养基,愈伤组织切成小块,置于不同的培养基中,每个激素组合处理20个茎段,4次重复[6]。30d后统计分化率,40d后统计不定芽诱导率。
1.3.4不定根诱导
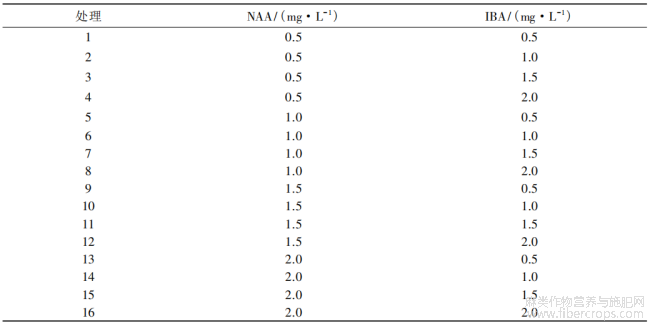
取4~5cm不定芽,置于不同激素组合的不定根诱导培养基中(表4),每个激素组合处理20个不定芽,4次重复[6],30d统计生根率。
1.3.5再生苗移栽
黄麻再生根3~4cm时,炼苗处理。3d后,移栽花盆炼苗。一个月后,移栽大田观察。
1.4数据处理
试验数据通过excel进行方差分析和多重比较;采用SPSS软件对不同激素组合对黄麻愈伤组织的诱导结果进行回归分析,以得出最优激素组合。
表2 愈伤组织诱导试验均匀设计表
表3 不定芽诱导试验正交设计表
表4 不定根诱导培养基试验正交设计表
2结果与分析
2.1预处理结果分析
2.1.1次氯酸钠处理
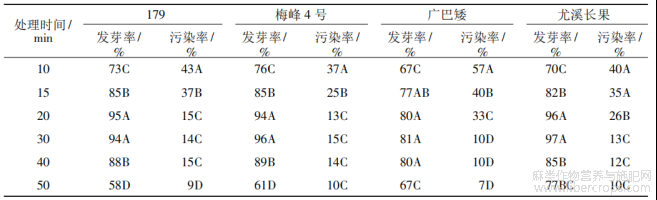
设置6种不同时间的次氯酸钠处理,考察其对黄麻种子发芽率和污染率的影响,结果表明(表5),次氯酸钠处理对不同黄麻品种的萌发率和污染率有极显著影响。所有品种的黄麻种子发芽率整体上均随处理时间增加而上升,处理20~30min时,发芽率达到最大,而后随着处理时间增加,发芽率开始下降;种子污染率则随处理时间增加而下降。
综合考虑污染率与发芽率,次氯酸钠处理的最佳时间为:黄麻179和梅峰4号20min,广巴矮和尤溪长果为30min。
表5 次氯酸钠处理对黄麻发芽率与污染率的影响
注:不同大写字母代表0.01显著水平。下同。
2.1.2不同培养基处理
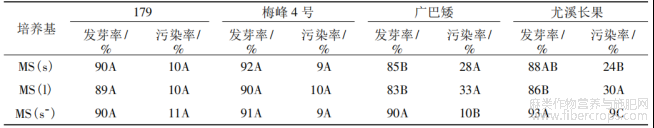
设计3种不同培养基,考察其对黄麻种子发芽率和污染率的影响,结果表明(表6),不同培养基对黄麻品种的影响差异较大。在3种培养基上,梅峰4号和179的发芽率均在89%以上,污染率10%左右,差异不明显。而长果种黄麻种子的发芽率和污染率却差异显著,2个长果种黄麻品种在MS(s-)培养基中的发芽率明显高于其他两种培养基,而污染率明显低于其他两种培养基。
综上,圆果种黄麻可采用普通的MS培养基,而长果种黄麻则以MS(s-)培养基为佳。
表6 不同培养基对黄麻发芽的影响
2.2愈伤组织诱导
采用均匀设计法进行愈伤组织诱导培养基激素组合试验,该方法通过少量组合,即可筛选出最优解,并确定出回归方程。结果表明,4种黄麻愈伤组织的诱导率差异明显(表7)。其中,在设定的激素组合中诱导,179的最高诱导率为90%,M4为70%,而长果种黄麻YC和GBA最高诱导率分别为45%和42%,其诱导效果为:179>M4>YC>GBA。
(1)179:采用SPSS软件对黄麻179的数据进行回归分析,以Y代表诱导率,X1代表TDZ,X2代表2,4-D,X3代表6-BA,X4代表NA,X5代表VC,得到回归方程:Y=0.71+0.39X12-0.77X1X2-0.17X1X3-0.02X1X4+0.28X22+0.2X2X3+α。说明4种激素对黄麻179愈伤组织的诱导率具有显著影响,而VC则无显著影响。
表7 不同激素组合对黄麻愈伤组织的诱导结果
上述回归方程中的α为随机误差项,对回归方程求解最大值,得到X1=0,X2=0.53,X3=2,X4=0。为验证该方程,将黄麻179茎段接种到MS+0.53mg/L 2,4-D+2.0mg/L 6-BA培养基中进行诱导,接种15d后,愈伤组织诱导率为100%,由此得出该培养基激素组合即为黄麻179的最佳愈伤组织诱导培养基。
(2)梅峰4号:方法同黄麻179。获得最优诱导培养基为MS+2.0mg/L TDZ+0.5mg/L 2,4-D,最大诱导率为100%。
(3)尤溪长果:方法同黄麻179。获得最优诱导培养基为MS+2.0mg/L TDZ+2.0mg/L 6-BA,最大诱导率为63%。
(4)广巴矮:方法同黄麻179。获得最优愈伤组织诱导培养基为:MS+2.0mg/L TDZ+2.0mg/L 2,4-D+2.0mg/L 6-BA,最大诱导率为52%。
从愈伤组织诱导率的结果分析,圆果种黄麻的诱导率显著高于长果种黄麻。
图1 不同黄麻品种的愈伤组织
2.3不同温度处理
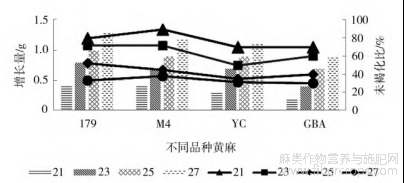
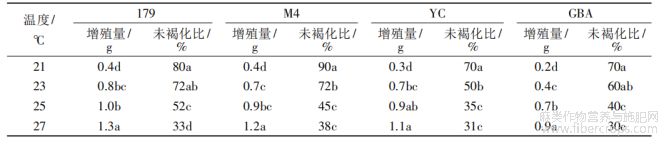
试验表明,培养温度为27℃时,4个黄麻品种愈伤组织的初代和二代培养均可快速增殖,且褐化程度低,但从第三代培养开始,褐化率明显提高。为此,设置不同温度处理进行第三代愈伤组织培养,统计其愈伤组织的增长量和未褐化比率。结果表明(图2),4种黄麻愈伤组织的增殖速度均随温度的升高而升高,但褐化率也随之升高。不同温度处理对愈伤组织褐化率具有显著影响(表8)。温度为21℃时,4种黄麻愈伤组织的增殖量都在0.1~0.5g,但褐化率小于等于30%。而温度为27℃时,增殖量都在0.9g以上,但褐化率高达62%~70%。综合愈伤组织的增殖量和褐化情况,确定黄麻的第三代愈伤组织在23℃培养。
图2 不同温度对黄麻愈伤组织的影响
表8 不同温度对黄麻愈伤组织褐化率的影响
注:不同小写字母代表0.05显著水平。
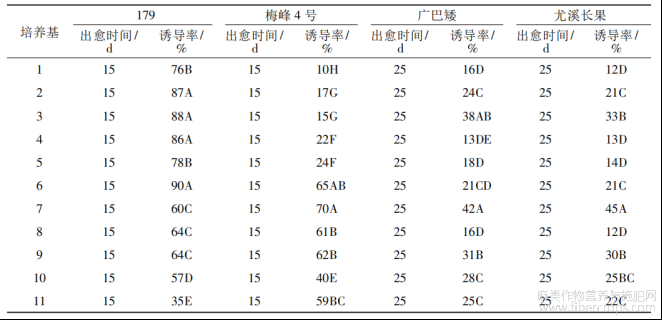
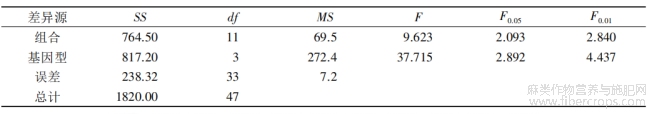
2.4不定芽诱导
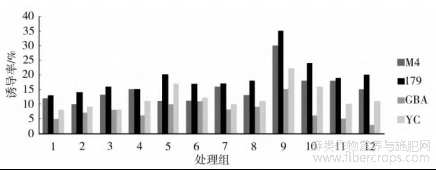
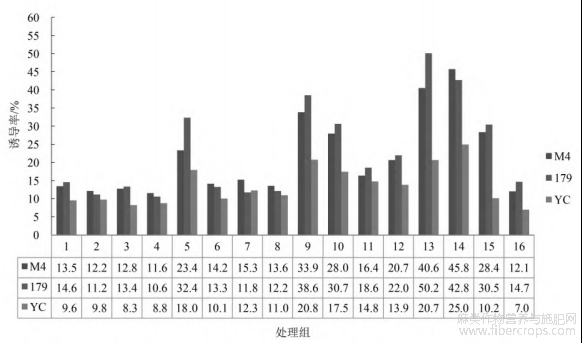
按照正交设计,配制了12组不定芽诱导MS培养基,方差分析表明,基因型间、激素组合间均存在极显著差异(表9)。从基因型差异分析,圆果种黄麻愈伤组织的不定芽诱导率明显优于长果种黄麻。其诱导效果排序为:179>M4>YC>GBA。从激素组合差异分析,4个品种愈伤组织不定芽
诱导率均呈现先升后降的趋势(图3)。在9号培养基中诱导分化,每个品种均表现为最高的不定芽诱导率,黄麻179为35.0%,梅峰4号30%,尤溪长果22.6%,广巴矮15%。
表9 黄麻愈伤组织不定芽诱导率的方差分析
图3 不同激素组合对黄麻不定芽的诱导结果
从分化的表型分析,愈伤组织前期形成颗粒状的生长点,中期继续生长的同时,褐化严重,后期仅少数生长点能长出健康的不定芽(图4)。而长果种黄麻广巴矮诱导出的不定芽随着愈伤组织褐化的加剧而全部死亡。
图4 诱导的黄麻不定芽
2.5不定根诱导
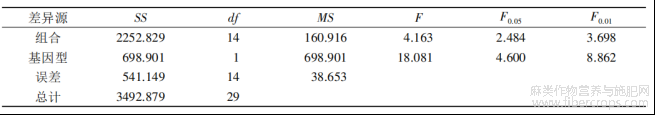
按照正交设计,配制了16组不定根诱导培养基,由于GBA的不定芽全部衰亡,因此,仅将分化出健康不定芽的3个黄麻品种接种到生根培养基上。方差分析表明,基因型间、激素组合间均存在显著差异(表10)。从基因型差异分析,圆果种黄麻愈伤组织的不定根诱导率也明显优于长果种黄麻,其诱导效果排序为:179>M4>YC(图5)。
表10 黄麻愈伤组织不定根诱导率的方差分析
图5 不同激素组合对黄麻不定根的诱导结果
从激素组合差异分析,黄麻179在13号培养基上的不定根诱导率最高,为50.2%,梅峰4号和尤溪长果在14号培养基中的诱导率达到最大,分别为45.8%和25.4%(图5)。
对不定根影响因子的分析表明,基因型和激素组合对黄麻不定芽的影响显著(表10)。试验中表现为(图6):圆果种黄麻的不定根诱导容易,不定根数量多且长势良好。而尤溪长果的不定根数量少,且多为主根,没有须根,不定根的长势较差,幼苗叶片逐渐脱落,死亡。
图6 黄麻的不定根
2.6再生苗的生长情况
选取具有健康不定根和不定芽的愈伤组织,经炼苗处理,转入外界培养,圆果种黄麻179和梅峰4号黄麻长势较好(图7)。而长果种黄麻尤溪长果虽然诱导出不定根,但不定根数量较少,不定芽长势极差,培养几天后,不定芽叶片脱落死亡,无法再生植株。
图7 再生的黄麻幼苗
3讨论与结论
3.1基本培养基对黄麻种子发芽的影响
基本培养基对植物离体培养植株再生有显著的影响,大多数文献报道的愈伤组织的诱导和芽的分化一般都是采用MS培养基[10]。Saha等[8]研究发现,对圆果种黄麻而言,液体培养基更适合于其种子发芽,且黄麻幼苗长势好、污染率低。本研究选用3种不同的基本培养基,发现圆果种黄麻种子的萌发基本不受培养基差异的影响,但3种培养基对长果种黄麻的发芽率有显著影响,其中不添加有机物质的MS培养基效果最好。这可能与长果种黄麻种子表面多“褶皱”,可能潜藏有较多的细菌和真菌有关。MS(s-)培养基由于不添加有机元素,不利于菌类的生长,可抑制其生长发育。
3.2激素对黄麻愈伤组织诱导和再生的影响
黄麻再生体系的研究多集中在外源激素对植株再生过程的调控作用。张高阳[6]研究表明,黄麻愈伤组织诱导需要植物激素TDZ、6-BA和IAA。Bharadwaj等[11]利用黄麻子叶在MS+0.5mg/L NAA+0.5mg/L BAP+36g/L蔗糖上成功诱导出不定芽。T.saha等[12]利用圆果种黄麻的子叶在MS+2.7mmol/L NAA+4.4mmol/L 6-BA上不仅诱导出不定芽,还成功诱导出不定根。本试验通过均匀设计选用不同的TDZ、6-BA、2,4-D和NAA激素组合,发现不同的激素组合对黄麻愈伤组织的诱导差异显著。长果种黄麻的不定芽和不定根诱导效率较差,说明植物组织再生的不同阶段对外源激素的敏感程度不同。这可能与不同激素的种类和浓度会引起植物细胞在不同发育阶段做出不同的反应有关。
3.3基因型的影响
基因型对作物组培效率的影响已经得到广泛证明。秦先超等[13]研究表明,福红992的不定芽诱导率最高,福红952最差。Saha等[8,12]在研究不同基因型的黄麻组织再生过程中,也发现了基因型差异导致的再生效率不同。苎麻研究中,基因型是苎麻外植体诱导愈伤组织和再生植株的决定因素,相同条件下绿芽诱导率湘苎6号>湘苎2号>芦竹青>湘苎3号>C5[14]。相同培养条件下,黄壳早、湘苎2号、巴西麻6号基因型适应性强,华苎1号适应性差[15]。Raoul等[16]对两种基因型玫瑰茄的愈伤组织诱导试验表明,两种基因型的差异明显。本研究的结果也表明,圆果种黄麻的诱导、分化及植株再生能力均高于长果种黄麻,尤其是在不定芽和不定根的分化及再生植株方面,长果种黄麻的高效再生体系还有待进一步的探索和完善。王晓玲等[15]认为基因型能控制外植体的状态,决定苎麻是否脱分化和愈伤组织增殖的状态,而基因型差异造成的黄麻诱导和分化能力差异的原因尚未明确。
3.4后续研究建议
本研究以4个黄麻品种为研究材料,研究了以黄麻幼茎为外植体构建的组培再生体系。构建的黄麻再生体系为今后的黄麻遗传转化研究奠定了基础。但是,由于研究中的长果种黄麻再生体系还不完善,只选用了尤溪长果和广巴矮两个品种,没有尝试更多的基因型和激素组合,需在此基础上做进一步研究。
参考文献
[1]秦先超,祁建民,方平平.麻类作物组织培养及遗传转化研究进展[J].植物遗传资源学报,2012,13(4):589-595.
[2]WANG Q M,WANG L.An evolutionary view of plant tissue culture:somaclonal variation and selection[J].Plant Cell Reports,2012,31(9):1535-1547.
[3]Sugimoto K,Meyerowitz E M.Regeneration in Arabidopsis Tissue Culture[J].Plant Organogenesis Methods in Molecular Biology,2013,959:265-275.
[4]Chattopadhyay T,Roy S,Mitra A,et al.Development of a transgenic hairy root system in jute with reporter gene through mediated co-transformation[J].Plant Cell Reports,2011,30(4):485-493.
[5]Bharadwaj P,Beena M R,Sinha M K,et al.Studies on Explant Regeneration and Protoplast Culture from Hypocotyl Segments of Jute,Corchorus capsularis L.[J].Journal of Plant Studies,2013,2(1):27-35.
[6]张高阳.黄麻再生遗传转化体系优化及UGPase、CesA1、CCoAOMT基因克隆与功能鉴定[D].福州:福建农林大学,2014.
[7]杨波涛.均匀设计和正交设计在微生物最佳培养基配方中的应用[J].渝州大学学报,2010,17(1):14-19.
[8]Saha T,Sen S K.Somatic embryogenesis in protoplast derived calli of cultivated jute,Corchorus capsularis L.[J].Plant Cell Reports,1992(10):633-636.
[9]祁永琼,许邦丽,李开云,等.植物组织培养中污染的原因分析及控制[J].云南农业科技,2010(4):62-64.
[10]马雄风,喻春明,唐守伟,等.苎麻组织培养和遗传转化研究进展[J].分子植物育种,2008,6(5):967-970.
[11]Bharadwaj,Pushyami,M,et al.In vitro regeneration and optimization of conditions for Agrobacterium mediated transformation in jute,Corchorus capsularis L.[J].Plant Biochem Biotechnol,2011(20):39-46.
[12]T Saha,M Ghosh,S K Sen.Plant regeneration from cotyledonary explants of jute,Corchorus capsularisL.[J].Plant Cell Reports,1999,18:544-548.
[13]秦先超,祁建民,方平平,等.红麻高效再生体系优化及双价抗虫基因遗传转化的初步研究[C]//中国遗传学会.中国遗传学会,2012:85.
[14]潘昌立,李树川,李育君,等.苎麻体细胞植株再生及其影响因素的研究[J].中国麻作,1995,17(1):1-6.
[15]王晓玲,彭定祥.不同基因型对苎麻愈伤组织诱导及分化的影响[J].长江大学学报(自科版),2005,2(8):64-66.
[16]RS Sié,Charles G,Sakhanokho H F,et al.Protocols for callus and somatic embryo initiation for Hibiscus sabdariffa L.(Malvaceae):Influence of explant type,sugar,and plant growth regulators[J].Australian Journal of Crop Science,2010,4(2):669-675.
文章摘自:方平平,王建勇,祁建民,陶爱芬,徐建堂,张立武.黄麻组培再生体系的研究[J].中国麻业科学,2022,44(03):133-142.