摘 要:工业大麻为雌雄异株植株,少数为雌雄同株,其性别表达影响着工业大麻纤维和药用产量等经济价值。因此,为建立工业大麻早期性别快速筛选及鉴定的方法,研究利用InDel标记筛选出与工业大麻性别连锁的两组标记物(Is-02和Is-08),将其PCR产物通过聚丙烯酰胺电泳和1%琼脂糖凝胶电泳后,发现两组标记物分别在多个大麻种质中扩增出(370bp或272bp)雌性单一带型,雄性中呈现双带型(370bp和199bp,272bp和100bp),且带型清晰,重复性好,准确性高;在大麻雌雄异株种质、全雌品系和雌雄同株种质中都得到了验证,检测准确性可达100%。结果表明,Is-02和Is-08适用于工业大麻幼苗期未知性别、花期已知性别植株及品种的快速鉴定。研究可为工业大麻早期性别鉴定提供技术支持,也为工业大麻分子标记辅助育种提供新的分子标记手段。
关键词:工业大麻;性别连锁;InDel标记;性别鉴定
大麻(Cannabis sativa L.)又称汉麻、火麻、线麻,是大麻科(Cannabinaceae)大麻属(Cannabis)一年生草本植物。大麻是二倍体(2n=20)双子叶植物,也是世界上最早和最广泛种植的作物之一,其根、茎、叶、花和果实都具有重要的经济利用价值,在纤维、油料、药物和特殊材质等领域都有广泛应用[1,2]。大麻的花叶中富含大麻二酚(Cannabidiol, CBD),可应用于药物和化妆品等领域;茎秆纤维具有吸湿透气、抗静电和抑菌的特点,常用于纺织业;杆芯可用于造纸、建筑材料、活性炭及新型材料等;籽粒富含膳食纤维以及人体必需氨基酸和脂肪酸,常用于功能饮料和食品的开发[3,4,5,6]。
大麻多为雌雄异株,少数为雌雄同株,其雌雄比例接近1∶1,而不同性别大麻植株在生长发育性状、成熟期及纤维品质上有各自的特点。雄性植株的纤维质量比雌株好,若作为纤维用,则需扩大雄性群体比例;而雌性植株的大麻素(CBD)含量比雄株高,若以提取大麻素(CBD)和收获种子为目的,则需扩大雌性群体比例[6]。不同性别的大麻成熟期不一致,不利于机械收割,增加了人工成本。雌雄同株大麻则成熟期一致,利于机械收割,但易受外界环境因素影响而使性别雌化或雄化。大麻性别在种子和幼苗期尚无准确鉴定的方法,在生产过程中,其性别表达常受到温度、湿度、激素、重金属盐、光周期和栽培条件等影响,只有在生殖器官(花器官)原基形成时才能从形态上准确判断植株性别,但雄性植株在开花后自然死亡,造成极大的生产损失[7]。因此,通过分子标记技术进行早期性别鉴定,克服环境因素对形态和生理生化指标的影响,调节田间雌雄比例,将有利于指导生产实践。
关于大麻性别,现在主要分为性状鉴定和分子鉴定。早期鉴定主要以性状鉴定为主,如《齐民要术》记载“凡种麻,用白麻子。止取实者,种斑黑麻子”,既色白、两头尖和较轻的是雄麻,而色黑、坚实饱满的是雌麻,古书《农政全书》和《图经本草》亦是这样记载[7]。但单从经验性结论来看,不足以科学地支撑其雌雄性别鉴定的准确性。分子标记能直接反映DNA水平遗传多样性,与其他形态学、细胞学等标记相比,更易于检测、节省时间,且准确性更高,还能提供更多的性别分化有益信息[8]。随着现代分子技术的不断更新与应用,DNA分子标记技术被认为是雌雄异株性别鉴定的准确且可靠的方法,因为其不受植物生长阶段的影响,还能打破传统育种的局限性。据报道,分子技术的进步为现代遗传育种提供了更多种类的分子标记技术,已广泛应用于大麻种质遗传多样性和性别相关标记研究中,如特别序列扩增(Sequence characterized amplified regions, SCAR)、随机扩增多态性DNA(Random amplified polymorphism of DNA,RAPD)、扩增片段长度多态性(Amplified fragment length polymorphism, AFLP)、简单序列重复(Simple sequence repeats, SSR)和单核苷酸多态性(Single nucleotide polymorphism, SNP)[8,9,10,11,12,13,14]。赵铭森等[9]利用3个雄性特异条带开发了6个SCAR标记,其MADC2-8性别检测鉴定准确率达98.34%;姜颖等[10]利用RAPD与SCAR标记,获得了一条869 bp的大麻雄性特异条带;吕淑珍等[14]利用AFLP分子标记获得了一条348 bp的雄性特异条带;Mandolino等[15]利用RAPD分子标记,获得了一条400 bp的雄性相关特异条带。研究表明,利用分子标记技术对工业大麻进行性别标记是可行的。
插入/缺失(Insertion-deletion, InDel)是指在近缘种或同一种物种不同个体之间基因组同一位点的序列发生了不同大小核苷酸片段的插入或缺失,及一个序列上某一位点相比同源的另一个序列插入或缺失一个或多个碱基[16,17]。InDel标记技术是基于PCR扩增技术发展起来的,其本质上属于长度多态性标记,但相较于其他分子标记技术而言,InDel标记在基因组中的分布更广、密度更大、数目也更多,具有稳定性更好、多态性高、分型系统简单、设备要求限制低和通用性强等特点[17]。目前InDel标记已应用于动植物群体遗传分析、分子辅助育种、纯度鉴定等领域[18,19,20,21,22,23],而InDel标记技术在大麻染色体中的标记报道较少。本文以大麻全基因组序列为基础,通过对InDel识别区域性染色体序列信息的筛选,构建InDel分子标记技术,探究工业大麻性别连锁标记,为大麻早期性别标记鉴定及性别表达研究奠定理论基础,研究结果将有助于工业大麻早期性别快速鉴定,且为今后大麻性别连锁标记的遗传结构信息和实际应用奠定基础。
1材料与方法
1.1试验材料
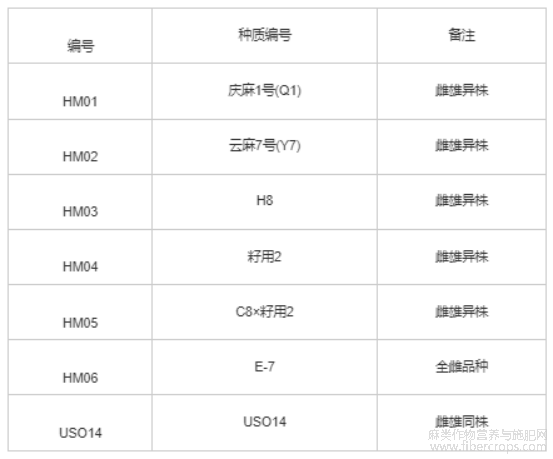
试验选择庆大麻1号(Q1)作为InDel标记的筛选材料,以H8、籽用2、E-7、云麻7号(Y7)、C8×籽用2的F2群体和雌雄同株USO14作为InDel标记的验证材料,7份工业大麻性别表型的鉴定材料如表1所示。试验所用工业大麻种质均由中国农业科学院麻类研究所一年生麻类育种研究室提供。
表1 7份大麻种质资源表
1.2试验方法
1.2.1大麻基因组总DNA的提取纯化及检测
利用植物基因组DNA提取(离心柱型)试剂盒(北京天根生物科技有限公司),对大麻叶片进行基因组总DNA提取,具体方法参见试剂盒说明书。用1%琼脂糖凝胶电泳进行DNA纯度检测,并使用NanoDrop 2000对提取DNA进行质量和浓度检测,暂存于-20℃冰箱。
1.2.2Indel标记引物设计
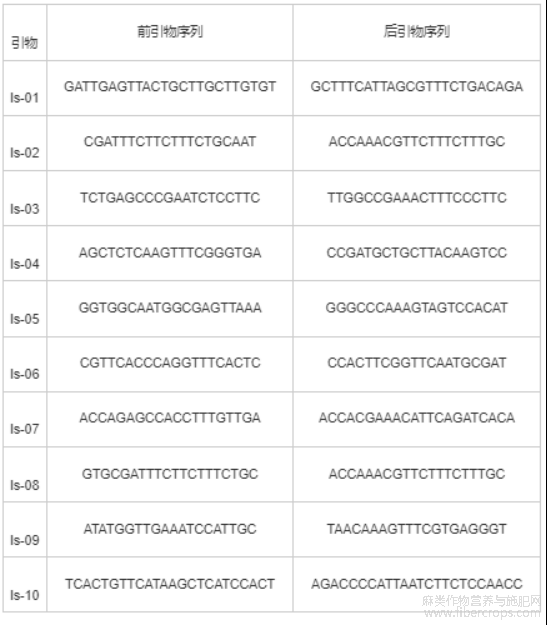
根据Prentout D等[24]公布的大麻性染色体位于1号染色体的报道,本研究通过NCBI下载大麻全基因组序列(https: //www.ncbi, nlm.nih.gov/bioproject/PRJNA73819),选择位于1号性染色体的序列信息,以每5 Mb的间隔选择沿染色体分布的10个InDel识别区域序列信息,利用Primer 5.0进行引物设计,依次命名为Is-01~Is-10,引物序列见表2。引物均由北京擎科生物科技有限公司(Tsingke Biotechnology Co.,Ltd.)合成。
表2 InDel引物及核苷酸序列(5′-3′)
1.2.3PCR扩增
使用2×Es Taq MasterMix(Dye)(康为世纪),PCR扩增反应总体积10μL。其中6μL的2×Es Taq MasterMixDye,1.5 μL的Template DNA(800 ng/μL),上下游引物(10μmol/L)为1.0μL,1.5μL的ddH2O。PCR反应循环程序为:预变性94℃、3 min,变性94℃、30s,退火55℃、30s,延伸72℃、1min,35个循环;延伸72℃、5min,反应结束后4℃冰箱保存。
1.2.4扩增产物的检测
使用聚丙烯酰胺凝胶电泳检测扩增产物,其中30%丙烯酰胺20mL,5×TBE溶液10 mL,超纯水48mL,10%AP溶液1200μL,TEMED溶液66 μL。DYY-10c型电泳仪设置程序:电压180V,电流300mA,定时70min。将凝胶放入0.4g AgNO3与400mL超纯水混合液中,银染6~8min,超纯水洗1次;将凝胶放入6g NaHO、400mL超纯水和4mL甲醛混合溶液中(可提前-20℃预冷5~10min),显影10~30min,超纯水洗7~9次。WD-9406型胶片观察灯下观察和拍照,保鲜膜封胶、贴标签留存。
使用1%琼脂糖凝胶电泳检测扩增引物,其中琼脂糖1g,1×TAE溶液100mL,核酸染料5~7μL,DYY-10c型电泳仪设置程序同上,定时25min,且标记所用Marker分子量标准均为GL DNA Marker 2000。将凝胶放入BIO-RAD凝胶成像仪中进行观察,并拍照留存。
1.2.5工业大麻植株表型鉴定
2020年将InDel标记筛选材料Q1播种于人工气候室(光照强度8000lux,长日照18h和65~70d后进行短日照8h处理,室温(25±5)℃,湿度60%~70%),待4对真叶完全展开后,采集大麻植株叶片,液氮速冻,并对采集植株挂牌标识。将样品利用植物组织研磨器(JXFSTPRP-24)粉碎,提取基因组总DNA,-20℃冰箱进行保存。待鉴定的6份资源材料同样种植于人工气候室,花期观察记录雌株与雄株性别,吊牌标识,并对每个品种雌雄株进行取样(3个重复),研磨后提取基因组DNA,暂存于4℃冰箱,用于性别表型验证。
2结果与分析
2.1大麻基因组总DNA的提取
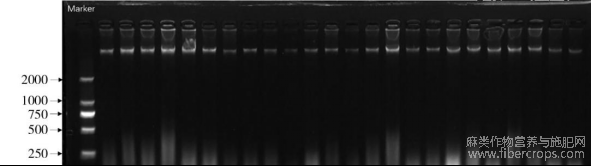
本试验利用植物基因组DNA提取(离心柱型)试剂盒(北京天根)提取大麻基因组DNA,由于大麻含酚类物质较多,在提取过程中相对延长了试验时间,步骤详见说明书。紫外分光光度法检测结果表明,基因组DNA的OD260/OD280值均在1.8~2.0,OD260/OD230值均在1.9~2.3,说明提取的DNA纯度较高,酚类物质污染较少,能够满足后续试验要求。1%琼脂糖凝胶电泳结果表明,大麻基因组DNA完整,带型整齐无弥散,完整性好(图1)。
图1 大麻基因组总DNA提取
2.2大麻性别连锁标记引物的筛选
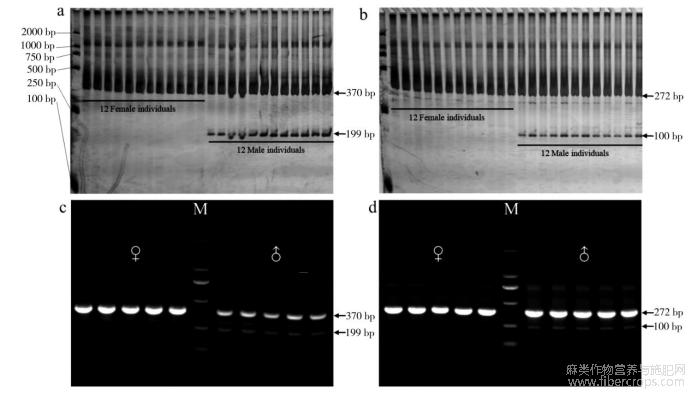
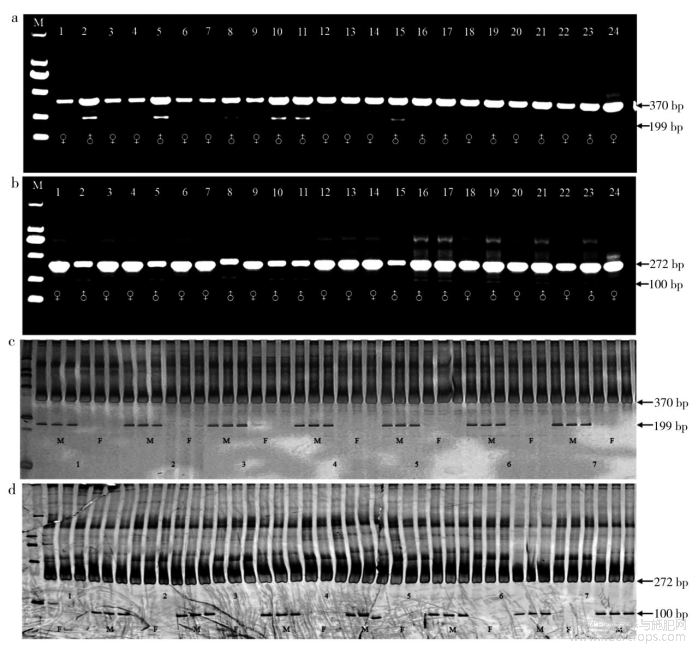
以Q1的雌雄单株DNA池为模板,分别对上述10对引物进行PCR扩增,扩增产物经聚丙烯凝胶电泳后进行引物筛选,经筛选后发现Is-02(5′-CGATTTCTTCTTTCTGCAAT-3′)和Is-08(5′-GTGCGATTTCTTCTTTCTGC -3′)能够对工业大麻雌(Female)、雄(Male)性别进行准确鉴定。Is-02在工业大麻雌株中扩增出一条约370bp的单一带型,在雄株中扩增出一条约370bp和199bp的雄性双带型(图2a);Is-08在工业大麻雌株中扩增出一条约272bp单一带型,在雄株中扩增出一条约272bp和100bp的雄性双带型(图2b),且出现的雌雄带型清晰,分区明显,雌雄单株重复的稳定性高。
此外,分别将Is-02和Is-08PCR扩增产物进行1%琼脂糖凝胶电泳后,发现Is-02和Is-08也分别能在工业大麻雌株中扩增出单一带型(370bp、272bp),在雄株中扩增出双带型(370bp和199bp,272bp和100bp)(图3 c、d)。结果表明,两份标记物在琼脂糖凝胶电泳中同样适用于工业大麻雌雄株的性别鉴定。
图2 Q1聚丙烯凝胶电泳
注:a、c为Is-02,b、d为Is-08。分子量标准GL2000 DNA ladder。
2.3与工业大麻雄性连锁的InDel标记引物的品种验证
2.3.1InDel分子标记检测工业大麻苗期性别
为验证Is-02和Is-08适用于工业大麻早期未知性别的鉴定,随机选取HM05(C8×籽用2)F2群体24株幼苗叶片进行DNA提取,以便于进行InDel标记。结果发现(图3a、b),PCR扩增产物经1%琼脂糖凝胶电泳后,HM30中2、5、8、10、11、15、16、17、19、21、23为雄株,其余均为雌株。利用该部分雌雄株DNA设置3个重复进行聚丙烯凝胶电泳(图3 c、d),试验结果与琼脂电泳一致,经核对相应编号HM30群体F2花期性别表型,发现性别表型与InDel标记结果一致。
2.3.2InDel分子标记检测工业大麻花期雌雄异株性别
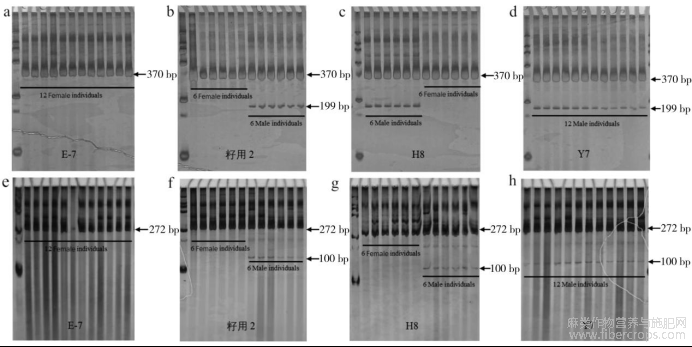
为验证Is-02和Is-08对工业大麻雌雄性别的鉴定,对H8、Y7、籽用2雌雄异株、E-7全雌品种等开花期叶片进行基因组DNA提取,设置不同样本重复(5雌×5雄、6雌×6雄、12雌×12雄)进行InDel标记鉴定,结果如图4所示。Is-02中籽用-2、H8、Y7中扩增出片段大小相差171bp的双带型,为雄株,其余未出现双带型,但仅在370bp处有单一带型的均为雌株;同理,在Is-08中扩增出片段大小相差172bp的双带型,为雄株,仅在272bp处出现单一带型的均为雌株。
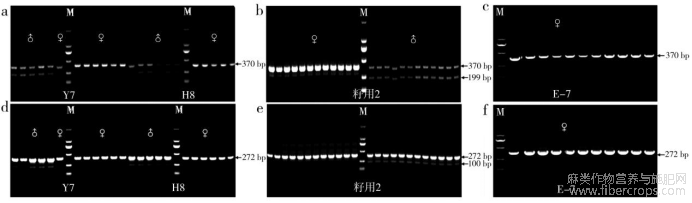
此外,为验证两份标记物的重现性与稳定性,将4份扩增产物经1%琼脂糖凝胶电泳后,结果表明(图5),两份标记物在电泳检测中都可对其进行性别快速鉴定,而鉴定结果均与花期表型一致。由此说明,两份标记物可以有效鉴定工业大麻幼苗期雌雄性别,且准确率可达100%。
图3 InDel标记物对HM30苗期性别检测结果
注:a、c为Is-02,b、d为Is-08。分子量标准GL2000 DNA ladder。
图4 工业大麻雌雄异株InDel标记聚丙烯酰胺凝胶鉴定结果
注:a、b、c、d为Is-02,e、f、g、h为Is-08。分子量标准GL2000 DNA ladder。
图5 工业大麻雌雄异株品种分析鉴定结果
注:a、b、c为Is-02,d、e、f为Is-08。分子量标准GL2000 DNA ladder。
2.3.3InDel分子标记在工业大麻雌雄同株中的利用
为验证在工业大麻雌雄异株中获得的两份标记物同样适用于雌雄同株工业大麻,随机选取12株雌雄同株USO14材料进行DNA提取,经PCR扩增后,结果表明(图6),两份标记物仅出现单一带型(370bp,270bp),表明两份标记物同样适用于雌雄同株材料的苗期雄化鉴定。
图6 雌雄同株USO14分子鉴定结果
注:a、c为Is-02,b、d为Is-08。分子量标准GL2000 DNA ladder。
3讨论与结论
工业大麻是一种雌雄异株植物,少数为雌雄同株,其全株具有重要的药用价值和经济价值,在生产过程中通常根据植株性别进行产业加工利用,但其性别在早期很难通过表型准确鉴别。随着分子标记种类和应用领域的不断扩大,SSR、RAPD、EST-SSR、ARFP等分子标记已广泛运用于芦笋[25]、番木瓜[26]、黄瓜[22]、野生大豆[27]、大麻[9,10,11,12,13,14,15],[18,28]和红麻[29]等性别鉴定、基因定位、分子育种与遗传多样性分析等领域中。目前,已有学者通过分子标记技术对大麻性别鉴定进行了相关报道,吕淑珍等[14]利用64对引物对10个大麻品种进行AFLP标记后,获得一条348bp的雄性特异性条带;姜颖等[10]利用42条RAPD引物在火麻一号中获得了一条869bp雄性特异条带,并命名为OPV-08,其合成的2条SCAR引物能够有效鉴定大麻早期性别;陈其军等[30]利用RAPD标记从30份引物中获得了一条约2.5kb雄性特异条带,命名为S401,并将其转化成重复性和特异性更好的SCAR标记。但它们在大麻性别连锁中的形成过程与作用机理未得到进一步验证,其中部分标记手段存在重现性、稳定性、特异性和分型等较差,缺乏功能性标记的开发,在一定程度上限制了分子标记在大麻遗传育种中的应用。与其他分子标记相比,基于功能性插入和缺失(InDel)位点开发的基因特异性标记,其准确性高、通用性强、稳定性好、带型清晰简单、产物分离效果好,且不受遗传背景影响,是分析标记辅助育种中理想的分子标记[8,17]。随着现代测序技术的发展与大麻基因组数据信息的公布,为InDel标记开发提供了很好的识别目标基因组区域,从而有助于加快基于图位克隆和性别标记的大麻分子辅助育种的选择。
工业大麻雌株药用成分好,雄株纤维质量高,种子可榨油、入药等。生产上,保持合适的雌雄比例,可提高生产效率和经济效益。在本研究中,利用Is-02和Is-08在自然群体中进行验证,结果表明,在雌雄异株中扩增出2条长度相差171bp或172bp的带型,则为雄株,而仅扩增出单一带型且片段大小与雄株中扩增带型较长的一条一致的为雌株,即雄株中可扩增出2条带型,雌株仅扩增出单一带型;在F2群体、全雌化和雌雄同株中再次验证其准确性和重现性,与预期结果一致。这与Pan等[18]通过InDel标记筛选出的Cs-I1-10和Cs-I1-15的雌雄带型相似,这表明可以通过InDel分子标记的方法鉴定出大麻性别,但在雌雄同株USO14的鉴定中,仅发现了单一带型(272 bp, 370 bp)雌性标记,表明所选植株性染色体均为XX型,这与姜颖等[10]在雌雄同株材料研究中的结果一致,均未找到雄性特异性带型(即XY型),后续还需对雌雄同株品种进行更多的种质资源鉴定。
在本研究中,筛选出的Is-02和Is-08可在工业大麻早期未知性别、雌雄同株和雌化植株中标记出单一带型(272bp,370bp)雌性标记,以及片段大小相差171bp或172bp的双带型雄性标记。结果表明,Is-02和Is-08作为一个与工业大麻雄性连锁紧密相连的标记物,在植株幼苗生长期就可对其进行早期性别鉴定,且鉴定准确率可达100%。筛选出的标记物被证明在广泛的扩增条件下,仍有极强的重现性,在退火温度为48~62℃时,都可清楚看到雌雄带型,不会因为热循环变化影响最终结果,这也证明筛选出的两对标记物稳定性较好,进一步表明本研究获得的两对标记物可为工业大麻遗传育种和生产提供准确的性别鉴定手段。
参考文献
[1]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:297.
[2]郭丽,王明泽,王殿奎,等.工业大麻综合利用研究进展与前景展望[J].黑龙江农业科学,2014(8):132-134.
[3]杨阳,张云云,苏文君,等.工业大麻纤维特性与开发利用[J].中国麻业科学,2012,34(5):237-240.
[4]杜光辉,邓纲,杨阳,等.大麻籽的营养成分、保健功能及食品开发[J].云南大学学报(自然科学版),2017,39(4):712-718.
[5]LIX P,WANGS Q,DU G B,et al.Manufacturing particleboard using hemp shiv and wood particles with low free formaldehyde emission urea-formaldehyde resin[J].Forest Products Journal,2014,64(5/6):187-191.
[6]张晓艳,孙宇峰,曹焜,等.纤用工业大麻雌雄株主要农艺性状的初步研究[J].中国农学通报,2020,36(20):1-6.
[7]崔丹丹,杨瑞芳,佘玮,等.工业大麻性别鉴定研究进展[J].中国麻业科学,2018,40(5):244-248.
[8]赵越,孙宇峰,韩承伟,等.分子标记技术在工业大麻性别分化研究中的应用进展[J].作物杂志,2019(3):20-23.
[9]赵铭森,方书生,陈瑶,等.籽用大麻性别连锁标记的验证及SCAR标记开发[J].热带作物学报,2019,40(10):2076-2082.
[10]姜颖,冯乃杰,王晓楠,等.工业大麻雄性相关RAPD和SCAR标记的筛选与鉴定[J].作物杂志,2019(3):66-72.
[11]张利国,张效霏,常缨,等.大麻ISSR反应体系的优化与引物的初步筛选[J].中国农学通报,2014,30(12):105-109.
[12]Rode J,In-Chol K,Saal B,et al.Sex-linked SSR markers in hemp[J].Plant Breeding,2005,124:167-170.
[13]Salvador S,Gramazio P,Figàs M R,et al.Genetic structure of Cannabis sativa var.indica cultivars based on genomic SSR (gSSR) markers:Implications for breeding and germplasm management[J].Industrial Crops and Products,2017,104:171-178.
[14]吕佳淑,赵立宁,臧巩固,等.大麻性别相关AFLP分子标记筛选[J].湖南农业大学学报(自然科学版),2010,36(2):123-127.
[15]Mandlino G,Carboni A,Forapani S,et al.Identification of DNA markers linked to the male sex on dioecious hemp(Cannabis sativa L.)[J].Theoretriacl and Applied Genetics,1999,98(1):86-92.
[16]Weber J L,David D,Heil J,et al.Human diallelic insertion/deletion polymorphisms[J].The American Journal of Human Genetics,2002,71(4):854-862.
[17]杨洁,赫佳,王丹碧,等.InDel标记的研究和应用进展[J].生物多样性,2016,24(2):237-243.
[18]PAN G,LI Z,HUANG S Q,et al.Genome-wide development of Insertion-deletion (InDel) Markers database for cannabis and its uses for genetic structure Analysis of Chinese germplasm and identification of sex-linked marker[J].BMC genomics,2021,22(1):595.
[19]ZHANG H M,XU W J,CHEN H T,et al.Transcriptomic analysis of salt tolerance-associated genes and diversity analysis using indel markers in yardlong bean (Vigna unguiculata ssp.sesquipedialis)[J].BMC Genomic Data,2021,22(1):34.
[20]沈秀芬,章炉军,张美彦,等.利用InDel标记分析中国香菇菌株的遗传多样性与群体结构[J].菌物学报,2021,40(9):2266-2281.
[21]潘磊,宋丽娟,高桐,等.菜豆种子遗传变异的InDel分子标记分析[J].江西农业大学学报,2020,42(2):250-258.
[22]卢霞,刘梦华,邓志军,等.基于InDel标记的黄瓜种质资源遗传多样性分析[J].江苏农业科学,2021,49(1):49-54.
[23]冯博,许理文,王凤格,等.玉米InDel标记20重PCR检测体系的建立[J].作物学报,2017,43(8):1139-1148.
[24]Prentout D,Razumova O,Rhoné B,et al.An efficient RNA-seq-based segregation analysis identifies the sex chromosomes of Cannabis sativa[J].Genome Research,2020,30(2):164-172.
[25]盛文涛.芦笋性别决定基因分子标记的筛选与开发[D].南昌:南昌大学,2010.
[26]郭霞,张艳,刘志勇.番木瓜性别连锁的AFLP及其SCAR标记的建立[J].中国农业科学,2009,42(3):967-973.
[27]于莉莉,关荣霞,邱丽娟.野生大豆(Glycine max L.)InDel标记的开发与利用[C].中国作物学会大豆专业委员会.第十届全国大豆学术讨论会论文摘要集.中国作物学会大豆专业委员会:中国作物学会,2017:36.
[28]方书生.籽用大麻种质资源亲缘关系分析及性别位点定位[D].福州:福建农林大学,2020.
[29]陈美霞.红麻遗传连锁图谱构建及重要性状基因定位与SCAR标记的开发[D].福州:福建农林大学,2011.
[30]陈其军,韩玉珍,傅永福,等.大麻性别的RAPD和SCAR分子标记[J].植物生理学报,2001(2):173-178.
文章摘自:陶杰,潘根,黄思齐,常丽,陈安国,唐慧娟,张翠萍,李德芳,李建军,赵立宁.工业大麻性别连锁Indel标记的筛选与鉴定[J].中国麻业科学,2022,44(03):143-150+164.