摘 要:本试验通过对盐胁迫下罗布麻的各项生命活动指标的研究,探究植物UWL与各项生理生化指标的相关性,从而解析植物UWL的可能激发机制,为进一步促进盐碱地改良,促进罗布麻资源的开发与利用以及UWL在抗逆性研究上的合理利用提供依据。结果表明:盐胁迫下,罗布麻叶片UWL强度随胁迫时间的延长而降低,且胁迫程度越重,UWL强度下降幅度越大。盐胁迫下,罗布麻叶片超氧阴离子含量随胁迫时间的延长上升,丙二醛(MDA)含量先降低后升高。超氧阴离子和MDA含量与UWL呈显著负相关。盐胁迫下,罗布麻叶片游离脯氨酸、可溶性蛋白、可溶性糖等渗透调节物质含量随胁迫时间的延长呈上升趋势,UWL强度与渗透调节物质呈显著负相关。盐胁迫下,罗布麻叶片SOD、POD、CAT活性随胁迫时间的延长呈现先升高后降低,SOD、POD、CAT与UWL均呈显著正相关。UWL强度随抗氧化系统活性的降低而下降。
关键词:罗布麻;盐胁迫;生理生化指标;超微弱发光
土地盐碱化的扩展,在极大程度上影响了农作物的正常生长。土壤含盐量过高会对植物产生毒害作用,引起土壤容重增大、孔隙度变差,还会影响土壤肥力,从而对农业生产产生影响(袁永等,2020,现代农业科技,(3):260-261)。对盐碱地的开发利用既能扩大可耕地面积,又能扩大绿化面积,改善生态环境和人类生活(侯蕊等,2011;张科等,2018,新疆农垦科技,41(2):14-15)。在现代农业中,耐盐作物的培筛选和培育尤为重要,一种良好的耐盐植物可以改良土壤,抑制盐碱的发展,还可以产生可观的经济效益(齐琪等,2020)。
生物的超微弱生物光子辐射又称为生物系统的超微弱发光(Ultraweakluminescence,UWL)现象,是时时刻刻在我们身边发生的,它是一种普遍的生命现象。全球盐碱地的治理工作迫在眉睫,虽然已经有许多方法和措施可以治理土地盐渍化,但仍需要我们努力钻研,总结经验。我们可以通过观察盐碱地中的植物的生长状况、生理指标等来判断盐害的严重程度,而植物的生长状况、生理指标等与其UWL强度又有着千丝万缕的关系(荆绮等,2020年),所以探究植物UWL强度与植物的生长状况、生理指标等的关系显得尤为重要。
罗布麻(Apocynum venetum L.)是夹竹桃科(Apocynaceae)罗布麻属直立半灌木,株高1.5~3m,体内有乳汁(叶菊等,2008)。罗布麻的耐寒、耐旱和耐盐碱等抗逆能力非常强,可大片的在盐碱地、风沙地、河滩地上生存,适于多种气候和土质(王雷等,2013,养殖技术顾问,(8):228-230)。目前对于罗布麻的研究,大多围绕其化学成分、纤维应用、药用保健及繁育技术等方面(王新丽等,2019;李涛等,2020;秦梅颂等,2020;赵雪艳等,2020)。但对于罗布麻的基础生理生化研究相对较少,尤其是对罗布麻成株的栽培与研究方面更是少之又少。为填补这一空缺,本文研究了盐胁迫下罗布麻生理生化指标与超微弱发光强度的变化,促进罗布麻资源的开发与利用以及UWL在抗逆性研究上的合理利用提供依据。
1结果与分析
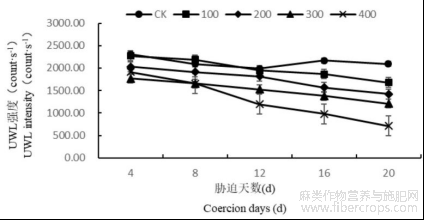
1.1盐胁迫对罗布麻叶片超微弱发光(UWL)的影响
随着胁迫时间的增长,CK的UWL强度变化不明显,不同盐胁迫下的罗布麻叶片UWL强度均呈现出下降趋势,且随着胁迫浓度的增大,罗布麻叶片UWL强度下降越明显,100mmol/L处理的罗布麻UWL强度下降缓慢,在20d时较CK下降了19.81%,200、300mmol/L处理的罗布麻UWL强度分别比CK降低了32.14%、42.32%,400mmol/L处理的罗布麻UWL强度急剧下降,比CK降低了66.04%(图1)。推测盐浓度过大,植株UWL的激发受到严重抑制。
图1 盐胁迫对罗布麻叶片超微弱发光(UWL)的影响
1.2盐胁迫下罗布麻叶片UWL与活性氧的关系
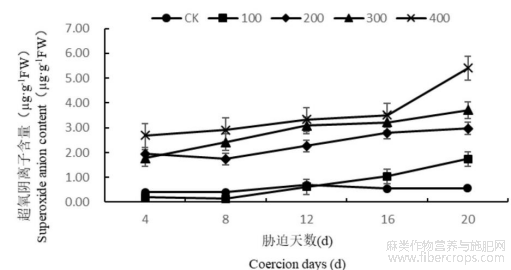
1.2.1盐胁迫对罗布麻叶片超氧阴离子含量的影响
经研究发现(图2),100mmol/L盐胁迫下罗布麻叶片内的超氧阴离子含量随着处理时间的增长呈现出先降低后升高的的趋势,在第8天达到最低与CK差异不显著,在第20天达到最大与CK差异显著,此时比CK高291.41%。在盐浓度为200、300、400mmol/L时,超氧阴离子含量随着处理时间的增长而增加,并在第20天时各处理间差异最为显著,此时三组处理分别比CK高445.15%、580.59%、890.29%。
图2 盐胁迫对罗布麻叶片超氧阴离子含量的影响
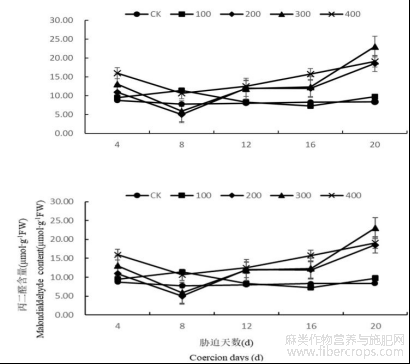
1.2.2盐胁迫对罗布麻叶片丙二醛(MDA)含量的影响
随着处理时间的增长,罗布麻叶片MDA含量总体呈现出先降低后上升的趋势,在第8天降到最低之后胁迫天数越长MDA含量越高。在盐浓度为100 mmol/L时,随着胁迫时间的延长叶片MDA含量先上升后下降,在第8天达到最大比同期CK高46.72%,说明罗布麻在遭受轻度胁迫时机体能迅速反应,抵挡逆境带来的伤害。在盐浓度为200、300、400 mmol/L时,罗布麻体内MDA含量随着胁迫时间的延长先降低后增高(图3)。
图3 盐胁迫对罗布麻叶片丙二醛(MDA)含量的影响
1.2.3超微弱发光与活性氧的相关性
CK组UWL与罗布麻叶片超氧阴离子呈中度负相关,与MDA呈中度正相关;100mmol/L处理下UWL与罗布麻叶片超氧阴离子呈显著负相关,与MDA相关性差异不显著;200mmol/L处理下UWL与罗布麻叶片超氧阴离子呈极显著负相关,与MDA呈中度负相关;300mmol/L处理下UWL与罗布麻叶片超氧阴离子呈极显著负相关,与MDA呈中度负相关;400mmol/L处理下UWL与罗布麻叶片超氧阴离子呈中度负相关,与MDA相关性差异不显著(表1)。以上相关性表明,罗布麻叶片UWL强度随活性氧含量的上升而下降,表明UWL与活性氧有一定相关性。
表1 盐胁迫下罗布麻叶片活性氧与UWL相关性
|
处理(mmol/L) Treatment (mmol/L) |
测定指标 Measurement indicators |
UWL回归方程 UWL regression equation |
相关系数R2 Correlation coefficient R2 |
|
CK |
超氧阴离子 Superoxide anion |
y = -708.03x + 2 496 |
0.512 3 |
|
MDA |
y = 241.55x + 140.31 |
0.619 5 |
|
|
100 |
超氧阴离子 Superoxide anion |
y=-349.61x+ 2 252.5 |
0.922 3** |
|
MDA |
y = 63.815x + 1 401.7 |
0.168 8 |
|
|
200 |
超氧阴离子 Superoxide anion |
y = -447.03x + 2 800 |
0.897 8* |
|
MDA |
y=-38.935x+ 2 204.7 |
0.559 4 |
|
|
300 |
超氧阴离子 Superoxide anion |
y=-282.71x+ 2 311.3 |
0.931 6** |
|
MDA |
y=-26.186x+ 1 854.4 |
0.534 2 |
|
|
400 |
超氧阴离子 Superoxide anion |
y = -389.9x + 2 683.4 |
0.733 5 |
|
MDA |
y=-77.702x+ 2 441.5 |
0.270 1 |
注:y:UWL强度(count/s);x:各指标;*,**:分别表示在P<0.05和P<0.01水平下的相关性显著和极显著;R2≥0.8为高度相关;0.5≤R2<0.8为中度相关;0.3≤R2<0.5为低度相关;R2<0.3表示基本不相关
1.3不同浓度盐胁迫下罗布麻叶片渗透调节物质与UWL的关系
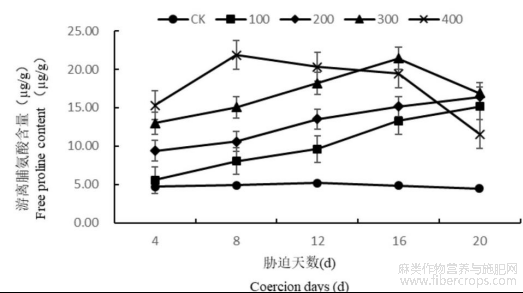
1.3.1盐胁迫对罗布麻叶片游离脯氨酸含量的影响
研究表明,不同浓度盐处理下罗布麻叶片游离脯氨酸变化差异较大。盐胁迫浓度为100、200mmol/L时,随着胁迫时间的增长罗布麻叶片内脯氨酸含量呈现出逐渐增高的趋势,在第20天达到最大,此时比同期CK各高239.69%、267.49%;盐胁迫浓度为300mmol/L时,随着胁迫时间的增长罗布麻叶片内脯氨酸含量呈现出先增高后降低的趋势,在第16天达到最大,此时比同期CK高342.36%;盐胁迫浓度为400mmol/L时,在4~8d罗布麻叶片内脯氨酸含量迅速增高并在第8天达到最大,此时比同期CK高347.03%,之后脯氨酸含量迅速降低(图4)。说明高浓度盐胁迫已经严重影响罗布麻叶片细胞的渗透调节能力,使游离脯氨酸迅速上升之后又迅速下降。
图4 盐胁迫对罗布麻叶片游离脯氨酸含量的影响
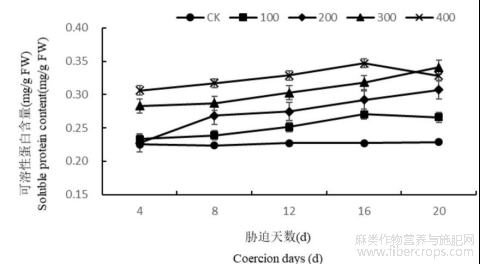
1.3.2盐胁迫对罗布麻叶片可溶性蛋白含量的影响
在不同浓度盐胁迫条件下,罗布麻叶片可溶性蛋白质的含量随着胁迫浓度的增大而增大(图5)。除CK随着胁迫天数的增长无明显变化外,其它浓度处理均随着胁迫时间的增长总体呈现出逐渐增加的趋势,且差异显著。在胁迫结束时,与CK相比当盐浓度为100、200、300、400mmol/L时,可溶性蛋白含量分别提高了16.42%、34.59%、49.33%、43.79%。由此可见不同浓度盐处理下叶片可溶性蛋白含量差异显著,且随着处理时间的增长而增加。
图5 盐胁迫对罗布麻叶片可溶性蛋白含量的影响
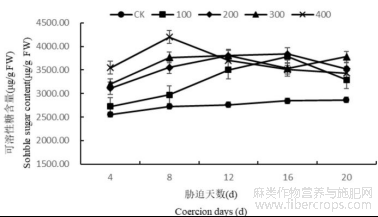
1.3.3盐胁迫对罗布麻叶片可溶性糖含量的影响
盐浓度为100、200mmol/L时罗布麻叶片中可溶性糖含量在第16天达到最大,此时较CK分别高33.13%、34.97%;盐浓度为300mmol/L时罗布麻叶片中可溶性糖含量在第12天达到最大,此时比CK高37.70%;盐浓度为400mmol/L时罗布麻叶片中可溶性糖含量在第8天达到最大,此时比CK高53.92%。在4~8d,随着胁迫的加深,叶片中可溶性糖含量明显上升,且差异显著;在12~20d,随着胁迫的加深,叶片中可溶性糖含量呈先增后降的趋势(图6)。
图6 盐胁迫对罗布麻叶片可溶性糖含量的影响
1.3.4罗布麻叶片渗透调节物质与UWL的相关性
CK组罗布麻叶片的游离脯氨酸、可溶性蛋白与UWL相关性差异不显著,可溶性糖与UWL呈低度负相关;100mmol/L处理下罗布麻叶片游离脯氨酸与UWL呈极显著负相关,可溶性蛋白与UWL呈显著负相关,可溶性糖与UWL呈中度负相关;200mmol/L处理下罗布麻叶片游离脯氨酸与UWL呈极显著负相关,可溶性蛋白与UWL呈显著负相关,可溶性糖与UWL相关性差异不显著;300 mmol/L处理下罗布麻叶片游离脯氨酸与UWL低度负相关,可溶性蛋白与UWL呈极显著负相关,可溶性糖与UWL相关性差异不显著;400 mmol/L处理下罗布麻叶片游离脯氨酸与UWL呈中度正相关,可溶性蛋白与UWL呈中度负负相关,可溶性糖与UWL相关性差异不显著(表2)。以上分析表明,罗布麻叶片UWL强度与渗透调节物质呈负相关。
表2 盐胁迫下罗布麻叶片渗透调节物质与UWL相关性
|
处理(mmol/L) Treatment (mmol/L) |
测定指标 Measurement indicators |
UWL回归方程 UWL regression equation |
相关系数R2 Correlation coefficient R2 |
|
CK |
游离脯氨酸 Free Pro |
y=-218.72x+ 3 182.7 |
0.257 9 |
|
可溶性蛋白 Soluble protein |
y= -18 632x + 6 344.3 |
0.092 8 |
|
|
可溶性糖 Soluble sugar |
y = -0.585x + 3 738.2 |
0.384 6 |
|
|
100 |
游离脯氨酸 Free Pro |
y=-60.273x+ 2 613.4 |
0.941 3** |
|
可溶性蛋白 Soluble protein |
y =-13 670x + 5 435.8 |
0.848 9* |
|
|
可溶性糖 Soluble sugar |
y = -0.417x + 3 348.6 |
0.522 2 |
|
|
200 |
游离脯氨酸 Free Pro |
y=-81.921x+ 2 815.3 |
0.936 9** |
|
可溶性蛋白 Soluble protein |
y=-7 674.9x+ 3 852.4 |
0.861 9* |
|
|
可溶性糖 Soluble sugar |
y=-0.434 6x+ 3 299.9 |
0.255 7 |
|
|
300 |
游离脯氨酸 Free Pro |
y=-44.867x+ 2 265.7 |
0.420 6 |
|
可溶性蛋白 Soluble protein |
y=-9 213.6x+ 4 330.9 |
0.980 9** |
|
|
可溶性糖 Soluble sugar |
y=-0.459 2x+ 3 167.8 |
0.283 5 |
|
|
400 |
游离脯氨酸 Free Pro |
y = 57.14x + 31.987 |
0.739 3 |
|
可溶性蛋白 Soluble protein |
y= -25 699x + 9 656.8 |
0.630 6 |
|
|
可溶性糖 Soluble sugar |
y = 0.8 064x - 1 673.2 |
0.256 2 |
1.4盐胁迫下罗布麻叶片抗氧化酶系统与UWL的关系
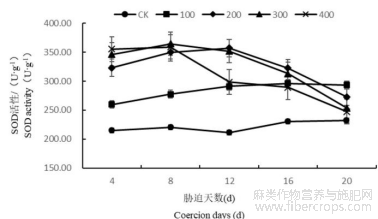
1.4.1盐胁迫对罗布麻叶片超氧化物歧化酶(SOD)含量的影响
随着胁迫时间的增长罗布麻叶片内SOD含量总体呈现出先增高后降低的趋势(图7)。在胁迫4~16d时,100、200、300、400mmol/L处理的罗布麻均与CK差异显著,盐浓度为100mmol/L时在第16天达到最大,与同期CK相比高28.32%;盐浓度为200mmol/L时在第12天达到最大,与同期CK相比高68.81%;盐浓度为300mmol/L时在第8天达到最大,与同期CK相比高65.43%;盐浓度为400mmol/L时在第8天达到最大,与同期CK相比高62.96%。在第20天时300、400mmol/L处理的罗布麻与CK差异不显著。
图7 盐胁迫对罗布麻叶片超氧化物歧化酶(SOD)含量的影响
1.4.2盐胁迫对罗布麻叶片过氧化物酶(POD)含量的影响
盐胁迫为100mmol/L时,罗布麻叶片内POD含量随着胁迫时间的增长先增高后降低,并在第12天达到最大,此时POD含量比CK高126.67%;盐胁迫为200mmol/L时,罗布麻叶片内POD含量随着胁迫时间的增长呈现出先升高后降低的趋势,并在第12天达到最大,此时POD含量比CK高124.44%,在第12天之后缓慢下降;盐胁迫为300mmol/L时,罗布麻叶片内POD含量随着胁迫时间的增长呈现出先升高后降低的趋势,并在第8天达到最大,此时POD含量比CK高180%,在第8天之后下降迅速;盐胁迫为400mmol/L时,罗布麻叶片内POD含量在第4天达到最大,随着胁迫时间的增长而迅速降低,并在第16天之后低于CK(图8)。

图8 盐胁迫对罗布麻叶片过氧化物酶(POD)含量的影响
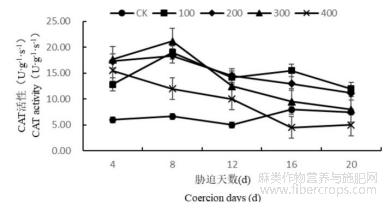
1.4.3盐胁迫对罗布麻叶片过氧化氢酶(CAT)活性的影响
随着胁迫时间的增长罗布麻叶片内CAT活性总体呈现出先增高后降低的趋势(图9)。在盐浓度为100、200mmol/L时,罗布麻体内CAT活性均在第8天达到最大,此时CAT活性比CK分别高184.86%、174.81%,并在第8天以后缓慢降低并略高于CK。盐胁迫浓度为300mmol/L时,罗布麻体内CAT活性在第8天达到最大,此时CAT活性比CK高217.39%,之后12~20d中CAT活性迅速降低。盐胁迫浓度为400mmol/L时,CAT活性在第4天达到最大,此时CAT活性比CK高147.17%,而且在8~16d活性迅速下降,并在16~20d低于CK,说明高浓度的胁迫已经超出罗布麻的调控范围对植物造成较大伤害。
图9 盐胁迫对罗布麻叶片过氧化氢酶(CAT)活性的影响
1.4.4罗布麻叶片抗氧化酶系统与UWL的相关性
CK组罗布麻叶片的SOD、POD、CAT与UWL相关性差异不显著;100mmol/L处理下罗布麻叶片SOD与UWL呈显著正相关,POD与UWL呈极显著负相关,CAT与UWL相关性差异不显著;200mmol/L处理下罗布麻叶片SOD与UWL呈中度正相关,POD与UWL相关性差异不显著,CAT与UWL呈显著正相关;300、400mmol/L处理下罗布麻叶片SOD、POD、CAT与UWL均呈显著正相关(表3)。表明罗布麻叶片UWL强度会随抗氧化系统的活性升高而增大。
表3 盐胁迫下罗布麻叶片抗氧化系统与UWL相关性
|
处理(mmol/L) Treatment (mmol/L) |
测定指标 Measurement indicators |
UWL回归方程 UWL regression equation |
相关系数R2 Correlation coefficient R2 |
|
CK |
SOD |
y=0.7532x+1962.2 |
0.0035 |
|
POD |
y=-13.865x+2695 |
0.2926 |
|
|
CAT |
y=24.014x+1970 |
0.0603 |
|
|
100 |
SOD |
y=-14.189x+6014.3 |
0.7759* |
|
POD |
y=-10.01x+3018.2 |
0.952** |
|
|
CAT |
y=35.611x+1467.6 |
0.1638 |
|
|
200 |
SOD |
y=5.342x+13.545 |
0.4977 |
|
POD |
y=1.7691x+1555.6 |
0.0129 |
|
|
CAT |
y=78.863x+577.43 |
0.8775* |
|
|
300 |
SOD |
y=4.3827x+79.574 |
0.7806* |
|
POD |
y=6.3047x+947.81 |
0.8831* |
|
|
CAT |
y=35.502x+1018.9 |
0.7922* |
|
|
400 |
SOD |
y=10.08x-1832.1 |
0.9406* |
|
POD |
y=10.47x+557.13 |
0.9894** |
|
|
CAT |
y=99.883x+353.23 |
0.9090* |
2讨论
盐胁迫下,胁迫天数的长短和盐浓度的高低对罗布麻UWL强度都有极显著影响,罗布麻叶片UWL强度随胁迫时间的延长而降低,且胁迫程度越重,UWL强度下降幅度越大。
孙聪(2021)研究发现盐胁迫会导致欧李叶片UWL强度下降,盐浓度越大UWL强度下降幅度越大,胁迫结束时低盐浓度处理比CK降低了35.93%,高盐浓度处理比CK降低了81.88%。闫宇彤(2017)研究发现德景天NaCl处理的UWL强度明显低于对照,胁迫结束时NaCl处理下德景天叶片UWL强度比CK低了32.81%,与本试验研究结果一致。
植物在生长发育过程中,时刻都在进行生理代谢活动,在其代谢过程中会产生许多活性氧,正常生长的植物体内活性氧的产生与清除处于动态平衡状态。而盐胁迫下植物体内的活性氧平衡状态被打破,导致植物体内活性氧大量积累会造成细胞膜稳定性下降、信号传导受阻、相关酶活性下降等严重危害,对植物的生长发育产生严重的毒害作用(朱杭申等,1994)。在人工老化对沙葱种子中活性氧与超微弱发光的影响中研究发现,在沙葱种子人工老化过程中,UWL强度与活性氧呈极显著相关,表明UWL强度随活性氧变化而变化(张东等,2019)。研究发现,巴旦水杏花在盛花期之后超氧阴离子与MDA迅速积累,而UWL强度衰减,表明超氧阴离子和MDA与UWL具有一定相关性(张新华等,2004)。活性氧是影响UWL强度的关键因素。
研究发现罗布麻叶片UWL强度随活性氧含量的积累而下降,盐胁迫时,活性氧积累破坏了细胞膜的结构和功能,产生MDA等有害物质,细胞功能遭到破坏,导致UWL强度下降。表明活性氧是影响UWL的重要因素,但并不是其直接激发来源。
可溶性蛋白、游离脯氨酸和可溶性糖等渗透调节物质与盐处理浓度呈正相关,当植物遭到逆境胁迫时脯氨酸会增加,清理积累的超氧阴离子,调节渗透压,保持细胞膜的结构和功能,渗透物质的增多往往代表着植物体生命状况的下降(李才生等,2008;张梦婕等,2021)。本试验研究发现,罗布麻叶片的UWL强度随渗透调节物质含量的升高而降低,呈显著负相关。表明渗透调节物质含量是罗布麻叶片UWL的重要调节因素。
植物通过增加POD、SOD、CAT等抗氧化酶的活性来抵抗和减少活性氧的积累(李彦等,2008)。本试验研究发现在短时间内,随着胁迫的加重罗布麻叶片内SOD、POD含量呈现逐渐增加的趋势,在胁迫到一定时间时高浓度盐碱处理的罗布麻叶片内SOD、POD含量呈现下降趋势,CAT在100、200、300mmol/L处理下随胁迫时间的增长呈先升后降的趋势,处理浓度为400mol/L时,随胁迫时间的增长呈现出逐渐降低的趋势,长期的盐碱胁迫环境,超过了罗布麻叶片细胞对活性氧自由基清除的阈值,罗布麻细胞膜系统遭到破坏(王建华等,1989)。沈徐悦(2020)研究发现,白玉兰、望春玉兰和乐昌含笑三种植物的抗氧化酶在不同的处理下均随着NaCl胁迫程度的增加和时间的延长呈先升后降趋势,与本研究结果一致。在对抗氧化酶系统和UWL相关性分析得出,盐胁迫下罗布麻叶片UWL强度随各种抗氧化酶活性的升高而升高,且不同抗氧化酶在各浓度下与UWL呈显著相关。
综上,盐胁迫下罗布麻体内各项生理生化指标变化明显,证实了UWL强度与活性氧、渗透调节物质、抗氧化酶等具有一定相关性,抗氧化系统的功能下降和系统损伤会导致UWL强度下降。抗氧化系统是UWL激发的重要因素。
3材料与方法
3.1试验材料
采用培育了两年的罗布麻植株,挑选生长状况相似的作为试验材料。
3.2试验方法
试验于2021年6月在内蒙古农业大学园艺与植物保护学院实验室进行。选生长状况相似的盆栽罗布麻(每盆装土2.5kg),底部垫有托盘,共75盆,分为5组处理,每组处理15盆。用混合胁迫的方法,将NaCl与Na2SO4按4:1比例混合,设置成0(自来水)、100、200、300、400mmol/L的氯化钠-硫酸钠的混合溶液。为避免盐分积累,每4d浇一次混合液,每次500mL,连续处理5次。每次处理后在第4天采集相应罗布麻叶片进行相关试验。
3.3生理生化指标的测定
(1)超氧化物歧化酶(SOD)测定方法采用氮蓝四唑法测定(史树德,2011,中国林业出版社,pp.128-130)。
(2)过氧化物酶(POD)的测定参考史树德(2011,中国林业出版社,pp.74-75)的方法测定。
(3)过氧化氢酶(CAT)采用高俊凤(2006,高等教育出版社,pp.142-144)的方法测定。
(4)丙二醛(MDA)的测定采用李玲(2009,农业出版社,pp.97-98)的方法测定。
(5)游离脯氨酸含量的测定参考张殿忠等(1990)的方法测定。
(6)可溶性糖与可溶性蛋白含量的测定用李合生(2000,高等教育出版社,pp.182-197)的方法。
3.4超微弱发光的测定
超微弱发光的测定使用超微弱发光测试系统(BPCL-2-SH),共测10次,以减去本底值的最大值的平均值表示罗布麻叶片的最终发光强度。
3.5数据分析
试验数据采用Excel 2016和IBM SPSS Statistics 26统计分析软件进行处理和分析。
参考文献
[1]Hou L., Zao B.H., Zhao J.C., and Pang B.L., eds., 2011, Effects and physiological responses of saline-alkali stress on the growth of dried robin, China Association for Science and Technology, Tianjin Municipal People's Government. Proceedings of the 16th Branch of the 13th Annual Conference of the Chinese Association for Science and Technology - Symposium on Coastal Ecological Construction and Urban and Rural Human Settlements, China Association for Science and Technology, Tianjin Municipal People's Government: Academic Department of the Society of China Association for Science and Technology, pp.6. (侯蕊, 曹帮华, 赵建诚, 庞丙亮, 编著, 2011, 盐碱胁迫对罗布麻干生长的影响及生理响应, 中国科学技术协会、天津市人民政府.第十三届中国科协年会第16分会场-沿海生态建设与城乡人居环境学术研讨会论文集, 中国科学技术协会、天津市人民政府:中国科学技术协会学会学术部, pp.6.)
[2]Li C.S., Ma H.L., and Huang P.F., 2008, The effect of Zn2+on rice seedling growth and cell membrane under salt stress, Anhui Nongye Kexue (Journal of Anhui Agricultural Sciences), (22): 9380-9381, 9427. (李才生, 马惠丽, 黄鹏飞, 2008, 盐胁迫下不同浓度锌对水稻幼苗生长及细胞膜的影响, 安徽农业科学, (22): 9380-9381, 9427.)
[3]Li T., Li C.J., Feng R.Q., Zhao Y.F., Lan Y.R., Wang L., and Huang J.F., 2020, Effects of three different organic fertilizers on growth traits ofApocynumvenetumin Altay, Zhongguo Caodi Xuebao (Chinese Journal of Grassland), 42(1): 38-42. (李涛, 李春杰, 冯润秋, 赵玉凤, 蓝艳茹, 王莉, 黄景凤, 2020, 3种有机肥对阿勒泰罗布麻生长性状的影响, 中国草地学报, 42(1): 38-42.)
[4]Li Y., Zhang Y.P., Sun M., and Gao B.M., 2008, Research advance in the effects of salt stress on plant and the mechanism of plant resistance, Zhongguo Nongxue Tongbao (Bulletin of Chinese Agricultural Sciences), (1): 258-265. (李彦, 张英鹏, 孙明, 高弼模, 2008, 盐分胁迫对植物的影响及植物耐盐机理研究进展, 中国农学通报, (1): 258-265.)
[5]Jing Q., Pang J.X., Yang M.N., Min L.Y., Zhou B.C., and Han J.X., 2020, The correlation and application between ultra-weakBioluminescenceandthecontent of reactive oxygen species in organisms, Shengwu Yixue Gongcheng Yanjiu (Biomedical Engineering Research), 39(3): 314-318. (荆绮, 庞靖祥, 杨美娜, 闵令圆, 周宝宸, 韩金祥, 2020, 生物超微弱发光与生物体内活性氧含量的相关性及应用, 生物医学工程研究, 39(3): 314-318.)
[6]Qi Q., Ma S.R., and Xu W.D., 2020, Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 18(8): 2741-2746. (齐琪, 马书荣, 徐维东, 2020, 盐胁迫对植物生长的影响及耐盐生理机制研究进展, 分子植物育种, 18(8): 2741-2746.)
[7]Qin M.S., Yu H., Zhang X.L., and Liu H.Z., 2020, Network pharmacologic analysis of the mechanism ofApocynivenetiFolium in the treatment of cardiovascular disease, Zhongyao Xinyao yu Linchuang Yaoli (Traditional Chinese Drug Research and Clinical Pharmacology), 31(5): 576-582. (秦梅颂, 俞浩, 张孝林, 刘汉珍, 2020, 罗布麻叶治疗心血管疾病作用机制的网络药理学分析, 中药新药与临床药理, 31(5): 576-582.)
[8]Shen X.Y., 2008, Comprehensive evaluation on salt tolerance ofMagnoliadenudata,Magnoliabiondii, andMicheliachapensisseedlings, Thesis for M.S., Zhejiang Agriculture and Forestry University, Supervisor: Jin H.X., pp.44-47. (沈徐悦, 2020, 白玉兰、望春玉兰和乐昌含笑幼苗的耐盐性评价研究, 硕士学位论文, 浙江农林大学, 导师: 金何仙, pp.44-47.)
[9]Sun C., 2021, The study on relationship between the excitation of ultraweak luminescence and the chloroplast and its function inCerasushumilis, Dissertation for Ph.D., Inner Mongolia Agricultural University, Supervisors: Guo J.L., and Li L.G., pp.14-15. (孙聪, 2021, 欧李叶片叶绿体及其功能与超微弱发光激发的关系, 博士学位论文, 内蒙古农业大学, 导师: 郭金丽, 李连国, pp.14-15.)
[10]Wang J.H., Liu H.X., and Xu T., 1989, The role of superoxide dismutase (SOD) in stress physiology and senescence physiology of plant, Zhiwu Shenglixue Tongxun (Plant Physiology Communication), (1): 1-7. (王建华, 刘鸿先, 徐同, 1989, 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用, 植物生理学通讯, (1): 1-7.)
[11]Wang X.L., Zhao H., and Wen X.H., 2019, Discussion on the key processing technology of Apocynum/cotton blended fabric, Fangzhi Keji Jinzhan (Advances in Textile Science and Technology), (12): 17-19. (王新丽, 赵慧, 温新惠, 2019, 罗布麻与棉混纺布加工关键技术探讨, 纺织科技进展, (12): 17-19.)
[12]Yan Y.T., 2017, Studies on the ultra weak luminescence and generation mechanism under salt stress in sedum plants, Thesis for M.S., Inner Mongolia Agricultural University. Supervisors: Guo J.L., and Jiang W., pp.8-9. (闫宇彤, 2017, 盐胁迫下景天植物的超微弱发光及其激发机制, 硕士学位论文, 内蒙古农业大学, 导师: 郭金丽, 姜伟, pp.8-9.)
[13]Ye J., Ji S.X., Lin P.C., and Bai S.J., 2008, Ethnobotany ofApocynumin west of China, Hebei Nongye Kexue (Journal of Hebei Agricultural Sciences), 12(8): 111-113, 117. (叶菊, 吉守祥, 林鹏程, 白世俊, 2008, 西部罗布麻的民族植物学研究, 河北农业科学, 12(8): 111-113, 117.)
[14]Zhang D., Zhang F.L., Hao L.Z., Yang Z.R., Wang J.Q., Zhao H.Y., and Ren X.Y., 2019, Effects of artistic aging on ROS and UWL in the seeds ofAlliummongolicum, Zhongzi (Seeds), 38(10): 1-5, 13. (张东, 张凤兰, 郝丽珍, 杨忠仁, 王佳琪, 赵宏宇, 任晓颖, 2019, 人工老化对沙葱种子中活性氧与超微弱发光的影响, 种子, 38(10): 1-5, 13.)
[15]Zhang D.Z., Wang P.H., and Zhao H.X., 1990, Determination of the content of free proline in wheat leaves, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), (4): 62-65. (张殿忠, 汪沛洪, 赵会贤, 1990, 测定小麦叶片游离脯氨酸含量的方法, 植物生理学通讯, (4): 62-65.)
[16]Zhang M.J., Wu X.L., Wei Y.Y., Geng Q.L., Harihashi Y.B.T., and Li Q.J., 2021, Effects of mixed saline and alkali on osmotic adjustment substances in cotton seedlings, Xinjiang Nongye Kexue (Xinjiang Agricultural Sciences), 58(11): 2011-2023. (张梦婕, 吴湘琳, 魏亚媛, 耿庆龙, 哈丽哈什·依巴提, 李青军, 2021, 混合盐碱对棉花幼苗渗透调节物质的影响, 新疆农业科学, 58(11): 2011-2023.)
[17]Zhang X.H., Yang H.Q., Li F.J., and Zhang W., 2004, Changes in ultraweak luminescence, ATP and active oxygen contents during apricot florescence, Zhiwu Shengli yu Fenzi Shengwuxue Xuebao (Journal of Plant Physiology and Molecular Biology), 30(1): 41-44. (张新华, 杨洪强, 李富军, 张伟, 2004, 杏花开放过程中超弱发光和ATP及活性氧含量的变化, 植物生理与分子生物学学报, 30(1): 41-44.)
[18]Zhao X.Y., Wang Q., Yang S., and Zhang R.R., 2020, The transcriptome sequencing and analysis of the medicinal plantApocynumvenetum, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 18(8): 2503-2511. (赵雪艳, 王琪, 杨莎, 张瑞瑞, 2020, 药用植物罗布麻的转录组测序及分析, 分子植物育种, 18(8): 2503-2511.)
[19]Zhu H.S., and Huang P.S., 1994, Water stress in soil and activated oxygen metabolism in rice, Nanjing Nongye Daxue Xuebao (Journal of Nanjing Agricultural University), (2): 7-11. (朱杭申, 黄丕生, 1994, 土壤水分胁迫与水稻活性氧代谢, 南京农业大学学报, (2): 7-11.)
文章摘自:卜令豪,陈忠祥,刘志华.盐胁迫对罗布麻生理生化指标及超微弱发光的影响[J/OL].分子植物育种:1-15[2022-09-11].