摘 要:目的研究热处理和不同离子强度条件下汉麻蛋白的热聚集行为。方法以汉麻籽为原料,考察在80、90、100℃热处理下,以及不同离子强度(0、0.2、0.4、0.6、0.8mol/LNaCl溶液)下汉麻蛋白的ζ-电位、粒径、浊度、二级结构、凝胶电泳、巯基及二硫键等指标。结果汉麻蛋白随着热处理温度的升高和离子强度的增大,ζ-电位绝对值降低、粒径增大、浊度增加;电泳图中在70kDa处有聚集条带显示;傅里叶变换红外光谱显示随着热处理温度升高,α-螺旋结构显著降低,β-折叠和无规则卷曲结构显著增大;随着离子强度增大,α-螺旋和β-转角结构显著降低,β-折叠结构增加,无规则卷曲结构先增大后减小;90℃热处理时游离巯基含量低于80℃和100℃,二硫键含量在80℃处理下最少;离子强度对汉麻蛋白总巯基影响不显著。结论热处理温度的升高及离子强度增大对汉麻蛋白聚集行为具有促进作用,为汉麻蛋白热加工工艺优化和品质调控提供了理论基础。
关键词:汉麻蛋白;聚集体;离子强度;热处理
0引言
汉麻又称大麻、火麻,被广泛应用在医药领域,其籽仁可食用。汉麻籽含有丰富的营养组分,其中蛋白质含量占20%~25%[1?2]。汉麻蛋白是一种优质蛋白质,富含多种必需氨基酸,具有极高的营养价值、低致敏性和易消化的特性,越来越多的应用在食品领域[3?4]。在现代食品加工过程中,热处理是食品加工的基本方法[5]。热处理时食物中的蛋白质在化学力的作用下形成聚集体[6],这种聚集行为可引起蛋白质性质和功能发生变化,如溶解性降低[7]、沉淀析出、功能性改变[8]等。蛋白聚集行为受到溶液的加热温度[9]、离子强度[10]、pH[11]等因素影响,加热温度具有影响蛋白分子去折叠状态的效果[12],离子强度可以发挥屏蔽静电作用,影响蛋白分子与溶剂的水合反应[13]。AMAGLIANI等[14]认为蛋白浓度、温度、pH和离子强度对蛋白质无定形聚集体的影响较大。目前,对于汉麻蛋白的研究多围绕提取方法及功能特性,对热聚集行为机制及调控方式的研究较少。汉麻蛋白热聚集行为的探究可以为调控产品加工工艺参数、提高产品品质、促进产品开发应用奠定基础。
本研究以汉麻籽为原料,探究汉麻蛋白热聚集行为以及离子强度对汉麻蛋白热聚集行为的影响,为汉麻蛋白食品热加工工艺优化和质量控制提供理论参考。
1材料与方法
1.1材料与试剂
汉麻籽(广西巴马县)。
甘氨酸(glycine,Gly)、三羟甲基氨基甲烷(Tris)、Ellman试剂、丙烯酰胺、甲叉双丙烯酰胺、四甲基乙二胺、过硫酸铵、二硫苏糖醇、碘乙酰胺、β-巯基乙醇(分析纯,美国Sigma公司);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、尿素、考马斯亮蓝R250(分析纯,北京博奥拓达科技有限公司);氯化钠、氢氧化钠、磷酸氢二钠、磷酸二氢钠、正己烷、盐酸(分析纯,天津市富宇精细化工有限公司)。
1.2仪器与设备
PHS-3C型pH计(上海仪电科学仪器股份有限公司);HH-S4型恒温水浴锅(巩义市予华仪器有限责任公司);FA224电子天平(精度0.0001g,上海舜宇恒平科学仪器有限公司);524G数显恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);FD-1A-50真空冷冻干燥机(北京博医康实验仪器有限公司);GL-21M冷冻离心机(湖南湘仪实验室仪器开发有限公司);TDL-5-A离心机(上海安亭科学仪器厂);HAD-HZS-H恒温振荡器(北京恒奥德科技有限公司);Zetasier Nano ZS纳米粒度分布仪(英国Malvern仪器有限公司);DYY-6D电泳仪(北京六一生物科技有限公司);L160000A FTIR傅里叶变换红外光谱仪(Fourier transform infrared spectrometer, FTIR)(珀金埃尔默仪器有限公司);Alpha-1506紫外可见光分光光度仪(上海谱元仪器有限公司)。
1.3实验方法
1.3.1汉麻蛋白的提取
汉麻籽浸于正己烷中振荡2h,抽滤,重复上述操作进行脱脂3次,粉碎,过筛,得60目脱脂汉麻粉。将原料与蒸馏水按照料液比1:20(m:V)混合后,用1mol/LNaOH溶液调pH到10.0,在室温条件下磁力搅拌1h,再以5000r/min转速离心30min,取上清液。用1mol/LHCl将上清液的pH调到4.5,静置30min,5000r/min离心30min,收集沉淀,并将沉淀用蒸馏水洗3次去除其中的盐分,调pH至7.0,冷冻干燥,备用[15]。采用凯氏定氮法测定干粉样品中蛋白质的含量为93.46%。
1.3.2不同温度汉麻蛋白热聚集体的制备
将汉麻蛋白粉溶于pH为7.0、10mmol/L的磷酸缓冲液(标准缓冲液)中,配制为5%(m:V)的蛋白质溶液,在25℃下磁力搅拌2h使其充分溶解。5000r/min的转速离心30min,取上清液过0.45µm纤维素膜,滤液倒入带塞三角瓶中。将样品分别置于80、90、100℃水浴锅中处理30min,迅速冷却以终止聚集体的形成。样品经5000r/min离心30min,取上清液过0.45µm纤维素膜除去不溶性物质,得到不同温度汉麻蛋白热聚集体[16]。
1.3.3不同离子强度汉麻蛋白热聚集体的制备
将汉麻蛋白粉以1:15(m:V)溶于去离子水中,在25℃下磁力搅拌2h使其充分溶解。5000r/min的转速离心30min,取上清液过0.45µm纤维素膜,滤液倒入带塞三角瓶中,向样品中分别加入NaCl溶液,制备成NaCl浓度分别为0、0.2、0.4、0.6、0.8mol/L的汉麻蛋白溶液,摇晃均匀,将样品放入90℃水浴锅中加热30min,迅速冷却以终止聚集体的形成。样品经5000r/min离心30min,取上清液过0.45µm纤维素膜除去不溶性物质,得到不同离子强度处理的汉麻蛋白热聚集体。
1.3.4粒径分布
将经过不同条件处理后的汉麻蛋白热聚集体配制成10mg/mL溶液,稀释后经过0.45µm滤膜,进行样品测定。采用Malvern纳米粒度分布仪测定其粒径分布特征和多分散指数(polydispersity index,PDI),平行3次,取其平均值作为测定值。
1.3.5ζ-电位
将经过不同条件处理后的汉麻蛋白热聚集体样品用pH7.0、10mmol/L磷酸缓冲液配制成10mg/mL的蛋白质溶液,稀释后缓慢加入马尔文电位样品池。采用Malvern纳米粒度分布仪测定电位值,重复测量3次,取其平均值作为测定值。
1.3.6二级结构
将经过不同条件处理后的汉麻蛋白热聚集样品,冻干成粉末。利用FTIR测定,扫描范围4000~400cm?1,分辨率4cm?1,利用PeakFitv4.12软件对红外光谱数据进行拟合分析。
1.3.7巯基和二硫键含量测定
蛋白质样品巯基(包括游离巯基和总巯基)含量的测定采用Ellman法[17]并稍做修改。
游离巯基:取0.0100g样品加入10mLTris-Gly(pH8.0)缓冲液,4500r/min离心10min,取上清液加入100µLEllman试剂,20℃避光保温1h,在412nm处测吸光度(以缓冲液代替样品为空白),通过公式(1)计算出游离巯基含量。
总巯基:取0.0050g样品加入10mL0.2mol/L Tris-HCl(10 mmol/L EDTA、2%SDS、8mol/L尿素、pH6.8)缓冲液中,加入100 µL Ellman 试剂,20℃避光反应1h,在412nm处测定吸光度值,通过公式(1)计算出总巯基含量。

式中,A412表示412nm波长处的吸光度;C表示汉麻蛋白溶液质量浓度,mg/mL;D表示稀释因子。
二硫键:总巯基与游离巯基之差的1/2,通过公式(2)计算出二硫键含量:

1.3.8浊度
将不同条件下处理后的汉麻蛋白热聚集样品,用pH7.0、10mmol/L的磷酸缓冲液稀释蛋白质量浓度至8mg/mL,溶解2h,用分光光度计在600nm处测定吸光度计算浊度T[18]。每个样品测定3次,最终结果取其平均值(以蒸馏水为空白):

式中,A表示600nm波长处的吸光度;V表示稀释倍数;I表示光程,取0.001m。
1.3.9十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
将蛋白样品稀释为80mg/mL,8000r/min离心5min,取上清液0.5mL加入250µL蒸馏水及缓冲液(0.2mL10%SDS和50µL0.01mol/L巯基乙醇)混合均匀,煮沸5min,冷却后的蛋白溶液8000r/min离心5min,上样量为20µL。采用12%的分离胶和5%的浓缩胶,电压恒定为120V。取出凝胶放入考马斯亮蓝染液(R250)中染色30min,再用脱色液脱色至背景清晰,利用凝胶成像系统分析电泳条带[19]。
1.4数据处理
采用Excel 2013和SPSS 22.0对数据进行处理,通过Origin2019绘图,实验结果以3次平均值±标准偏差表示。
2结果与分析
2.1粒径分布
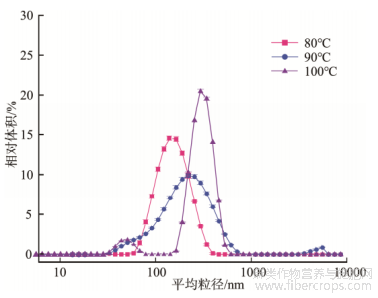
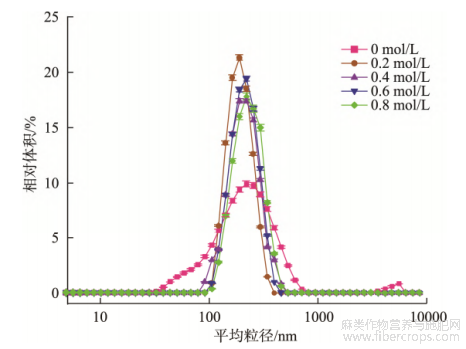
加热温度对汉麻蛋白聚集体粒径分布有较大影响。由图1显示,随加热温度的升高平均粒径增大,90℃下平均粒径高于80℃,达到175.8nm,PDI下降。当热处理温度达到100℃时,平均粒径可增至400.1nm,随着热处理温度的升高,蛋白分子表面电荷数量减小,斥力减弱,分子聚集更容易,使汉麻蛋白热聚集体平均粒径增大。王冬梅等[20]研究大豆蛋白热处理的行为表征结果与本结论一致,随着热处理温度的升高,大豆蛋白形成了可溶性聚集体,聚集体粒径和分子量逐渐增大。汉麻蛋白在不同离子强度作用下,粒径分布发生了明显改变。如图2所示,经NaCl处理后的汉麻蛋白聚集体粒径峰向右偏移,粒径增大,平均粒径由175.8nm增至271.2nm,PDI升高。随着离子强度增大,汉麻蛋白热聚集体粒径逐渐增大,当NaCl浓度从0.2mol/L增加至0.8mol/L时,平均粒径由193.9nm增至271.2nm,PDI略有降低,这表明离子强度增加能促进汉麻蛋白的聚集。在盐离子作用下,蛋白微环境中的电荷产生屏蔽作用[21],水化层被破坏,影响蛋白质表面疏水作用,分子间斥力减小,更易发生聚集。同时,离子强度的增加相当于减少蛋白质的净电荷密度,随着NaCl浓度增大,分子表面电荷数减少,热力学稳定性下降,蛋白质分子发生聚集,汉麻蛋白热聚集体平均粒径增大。李向红等[22]通过对不同离子强度大豆分离蛋白热聚集体的研究表明,随着离子强度的增大,大豆分离蛋白热聚集体的粒径随之增大,与本研究结论一致。
图1不同温度处理的汉麻蛋白热聚集体粒径分布变化(n=3)
图2 不同离子强度处理的汉麻蛋白热聚集体粒径分布变化(n=3)
2.2ζ-电位
ζ-电位是溶液中带电粒子的电层中剪切面的电位,通常用来评价胶体的稳定性。蛋白质溶液是一种典型的胶态分散体系,ζ-电位的绝对值越大,表明蛋白质分子表面的负载量就越大,并有较大的静电斥力维持系统处于相对稳定的状态;相反,当ζ-电位绝对值较低时,体系状态不稳定,蛋白质分子容易聚集。
随着热处理温度升高,ζ-电位绝对值逐渐减小。100℃热处理汉麻蛋白ζ-电位的绝对值小于80℃时,表明在100℃下分子表面电荷总数发生减少,蛋白质分子间的斥力减弱,静电作用力增强,汉麻蛋白分子及热聚集体分子被静电吸引形成了新的更大的聚集体分子。随着热处理温度升高,ζ-电位的绝对值降低,可能是由于汉麻蛋白表面带负电残基随着高温处理逐渐掩埋,静电排斥减少,溶液稳定性降低,这将有利于体系中蛋白分子形成聚集体。
离子强度对汉麻蛋白热聚集体ζ-电位有较大影响,NaCl处理后的汉麻蛋白热聚集体的ζ-电位绝对值明显低于未经NaCl处理的汉麻蛋白热聚集体。随着NaCl浓度的增大,汉麻蛋白热聚集体的ζ-电位绝对值逐渐减小,从
18.3mV降至8.05mV。处于特定离子强度的环境下汉麻蛋白分子由于静电相互作用产生了屏蔽效应,静电相互作用引起的排斥弱化,使整个溶液体系中吸引力大于排斥力,以及体系中由于竞争水合加剧了分子间的碰撞,产生疏水性聚集,分散体系的平衡被完全破坏,溶液稳定性降低,从而导致了汉麻蛋白聚集现象的发生。袁江兰等[23]通过实验发现随着NaCl浓度增加,大米谷蛋白热聚集体ζ-电位绝对值减少,与上述结论相符。
2.3二级结构
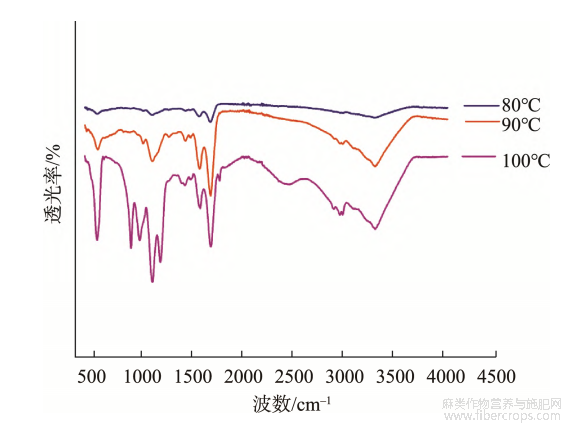
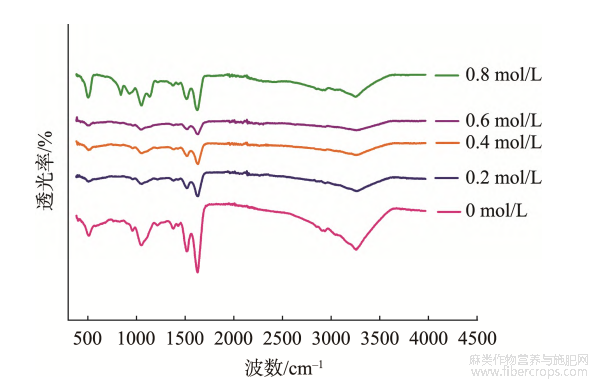
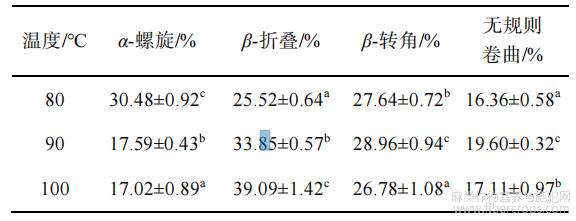
利用FTIR对汉麻蛋白聚集体进行扫描,结果如图3、4所示。在酰胺Ⅰ带(1700~1600cm?1),汉麻蛋白热聚集体具有较强的吸收峰,酰胺Ⅰ带谱峰与蛋白质二级结构之间有相对应的关系,可以通过对峰面积的研究进一步对蛋白质二级结构进行分析,结果如表1、2所示。
经过不同温度处理的汉麻蛋白热聚集体在酰胺Ⅰ带的特征吸收峰有显著差异(P<0.05)。由图3和表1可知,随着热处理温度的升高,汉麻蛋白聚集体α-螺旋结构显著减少(P<0.05),在100℃时最低;而β-折叠和无规则卷曲结构显著增多(P<0.05)。此结果与热处理红芸豆蛋白的二级结构相似,红芸豆蛋白随温度升高,α-螺旋结构占比呈下降趋势,而不规则结构占比呈上升趋势[24]。蛋白质二级结构主要由α-螺旋、β-折叠、β-转角和无规则卷曲组成,β-转角和α-螺旋代表蛋白质的有序结构,而β-折叠和无规则卷曲代表蛋白质的无序结构[25],氢键是稳定二级结构的主要作用力。FTIR结果显示,热处理对汉麻蛋白聚集体氢键有显著影响,使维持α-螺旋的氢键断裂,α-螺旋结构打开,
疏水性基团暴露,打破分子间作用力平衡,分子间的相互作用增强,进而通过β-折叠形成蛋白聚集体[26]。
图3不同温度处理的汉麻蛋白热聚集体的红外光谱图
图4不同离子强度处理的汉麻蛋白热聚集体的红外光谱图
表1不同温度处理对汉麻蛋白热聚集体二级结构的影响
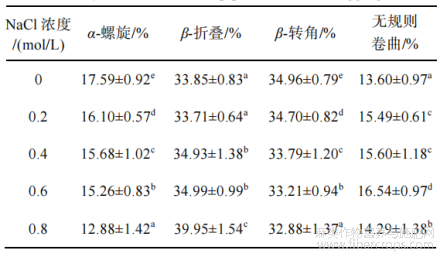
在0.8mol/L时最高;无规则卷曲结构先增大后减小,在0.6mol/L时最高。FTIR结果表明,离子强度的增加可以促进汉麻蛋白聚集体从有序结构向无序结构转变,β-折叠结构含量反映了蛋白疏水位点的暴露程度,随着NaCl浓度的增加,蛋白聚集体发生部分变性且二级结构改变,β-折叠结构含量增大,疏水位点暴露,同时ζ-电位绝对值减小,分子间斥力减小,分子聚集形成更大的聚集体。
表2不同离子强度处理对汉麻蛋白热聚集体二级结构的影响
2.4巯基及二硫键
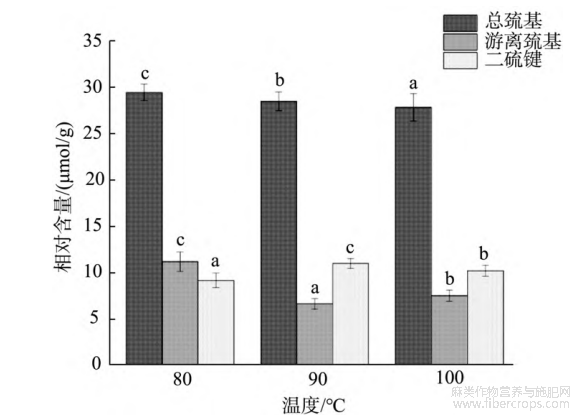
游离巯基是蛋白质中最活跃的基团。它位于蛋白质分子表面,氧化后形成一个新的二硫键,对维持复合蛋白质的结构稳定性起着重要作用。用含量表征了汉麻热聚集体中蛋白质氧化程度的变化,不同样品的游离巯基含量可以反映不同处理方式对蛋白质共价作用的影响。
由图5可知,经过热处理后汉麻蛋白热聚集体的总巯基含量有显著变化(P<0.05),由29.49μmol/g降至27.87μmol/g,游离巯基含量先减小后增大,二硫键先增大后减小。当90℃热处理时汉麻蛋白热聚集溶液中的游离巯基含量最低为6.62μmol/g,这是由于随着热处理温度的升高,游离巯基氧化成二硫键和发生-SH-SS互换反应[27],从而发生游离巯基减少和二硫键增多的现象;然而,当热处理温度增加到100℃时,游离巯基含量反而提升至7.5μmol/g,可能是由于在100℃的热处理时,蛋白质发生疏水性聚集,使得暴露的游离巯基被部分包裹在聚集体内部,不再发生-SH-SS互换和二硫键转换[28]。
不同浓度NaCl处理对汉麻蛋白巯基和二硫键的影响如图6所示。随着离子强度增大,游离巯基含量变化显著(P<0.05),总巯基含量无显著变化(P>0.05)。可知离子强度对汉麻蛋白游离巯基的二硫键转换和-SH-SS互换影响不大。在不同离子强度的作用下,汉麻蛋白聚集现象的差异可能是由于疏水性基团暴露增加,蛋白质表面疏水性增加,从而发生疏水性聚集。
图5不同温度处理的汉麻蛋白热聚集体的巯基和二硫键含量(n=3)

图6不同离子强度处理的汉麻蛋白热聚集体的巯基和二硫键含量(n=3)
2.4浊度
浊度法是监测蛋白质聚集最直观最简便的方法。热处理温度对汉麻蛋白热聚集体浊度具有一定影响。随着热处理温度的升高,浊度显著增大(P<0.05),80℃时汉麻蛋白浊度为900.55%,100℃时上升到1297.66%,浑浊程度肉眼可见。这是由于温度促进汉麻蛋白热聚集行为的发生,随着温度升高,大分子可溶性聚集体增多,溶液浊度增大,汉麻蛋白浊度的增加与其平均粒径增大的结果相互验证。陈振家等[24]研究红芸豆蛋白在70~95℃热处理时稳定性的结果与本研究结论一致,随着热处理温度升高,红芸豆蛋白内部疏水结构的暴露,溶解度逐渐降低,浊度升高,高温促进蛋白聚集现象发生。JIANG等[29]的研究结果表明随着NaCl浓度的增加,大豆蛋白更容易发生热聚集,当蛋白在0.6mol/LNaCl溶液中加热到80~97℃时,SPI浊度呈指数性增加,蛋白质发生严重聚集。但90℃与100℃处理下汉麻蛋白浊度变化不大,这是由于在100℃下,聚集现象加剧,生成大分子不溶性聚集体并以沉淀的形式析出,可溶性聚集体浊度相差不大。
离子强度对汉麻蛋白浊度也具有一定影响。随着NaCl浓度的增大,汉麻蛋白浊度逐渐增大,从1267.2%增加到1341.06%,由此可知离子强度可促进汉麻蛋白聚集。随着离子强度增大,汉麻蛋白分子粒径增大,溶液体系更稳定。袁江兰等[23]用0.30mol/LNaCl处理大米谷蛋白时,溶液浊度显著增加,并且出现了肉眼可见的浑浊。JIANG等[29]研究结果显示,大豆分离蛋白浊度随着盐离子强度的增加而增加。
2.6十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
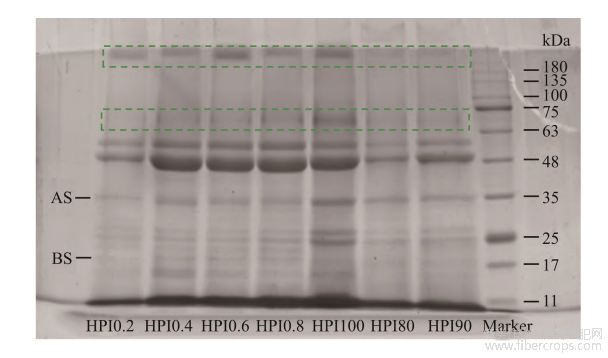
汉麻蛋白主要由麻仁球蛋白(edestin)和白蛋白(albumin)组成。麻仁球蛋白占总蛋白质含量的60%~80%,它由6个相同的亚基组成,每个亚基由一个酸性亚基(acidic subunits, AS)和一个碱性亚基(basic subunits, BS)通过一个二硫键连接而成[30]。麻仁球蛋白的分子量大约为300kDa,其中AS分子量约为34kDa,组成相对均一;而BS主要由两个亚基组成,分子量分别为20和18kDa[31]。由图7可见,汉麻蛋白热聚集体在浓缩胶与分离胶顶部出现明显条带,并随着温度的升高和离子强度的增大,条带更明显。这可能是由于随温度升高和离子强度增大,汉麻蛋白发生聚集并形成大分子可溶性聚集体,这也是引起粒径增大及浊度上升的原因。此结果与蒋将[32]的电泳结果一致,大豆蛋白聚集体在浓缩胶顶部出现聚集条带。王庆玲[33]在研究pH偏移及热处理对汉麻蛋白结构的影响过程中也得到相同结论。而随着热处理温度和离子强度的变化,汉麻蛋白分布在70kDa处的条带具有明显
图7不同条件处理后汉麻蛋白热聚集体的电泳图
变化,随着热处理温度增加和离子强度增大,70kDa处的条带逐渐加深,在100℃和0.8mol/LNaCl处理条件下出现明显的条带。这说明热处理温度和离子强度会促使蛋白亚基的聚集,70kDa附近的亚基条带在加热过程中最易发生聚集,且随着离子强度的增大聚集能力增大。温度升高也会促使红芸豆蛋白亚基的聚集,90kDa附近的红芸豆蛋白亚基条带在加热过程中最易发生聚集,与本研究所得结果相似[24]。
3结论
食品加工过程中加热是常见的处理方式,食盐是必不可少的调味品,然而热处理和离子强度对食品加工及食品品质具有影响。热处理可以促进汉麻蛋白聚集行为的发生,并随着热处理温度的升高,聚集现象更显著。汉麻蛋白表面带负电残基随着高温处理逐渐掩埋,ζ-电位的绝对值降低,静电排斥减少,分子间作用力平衡破坏;α-螺旋结构打开,形成β-折叠和无规则卷曲构象,游离巯基氧化生成二硫键,分子聚集粒径增大,浊度上升,形成蛋白聚集体,体系稳定性增强。随着离子强度的升高,蛋白质表面净电荷密度减少,ζ-电位绝对值降低,蛋白微环境中的电荷产生屏蔽作用,分子间斥力减小,蛋白分子粒径增大,更易发生聚集;α-螺旋结构含量减少,β-折叠结构含量增大,蛋白结构由有序性向无序性变化,浊度增大,形成大分子可溶性聚集体。离子强度对汉麻蛋白聚集行为具有一定的调控作用。本研究对热处理及离子强度对汉麻蛋白聚集行为的影响进行了探讨,为汉麻蛋白的加工及应用提供了理论依据。
参考文献
[1]孟妍,曾剑华,王尚杰,等.汉麻籽蛋白研究进展[J].食品工业,2020,41(1):268?273.
[2]刘雪强,刘阳,粟建光,等.中国汉麻综合利用技术与产业化进展[J].中国麻业科学,2019,41(6):283?288.
[3]MIROSLAV H, TAMARA DH, ATHINA L, et al. Hempseed meal protein isolates prepared by different isolation techniques. Part I. physicochemical properties [J]. Food Hydrocolloid, 2018, 79: 526?533.
[4]何锦风,陈天鹏,卢蓉蓉,等.汉麻籽的综合利用及产业化研究[J].中国食品学报,2010,10(3):98?112.
[5]连文绮.新型热和非热食品加工技术的研究进展及影响其工业应用的因素[J].食品工业科技,2019,40(9):363?368.
[6]WANG XF, HE ZY, ZENG MM, et al. Effects of the size and content of protein aggregates on the rheological and structural properties of soy protein isolate emulsion gels induced by CaSO4 [J]. Food Chem, 2017, 22: 130?138.
[7]简华君,张海瑞,黄小林,等.碱溶热处理对大豆分离蛋白溶解度、热聚集和流变性质的影响[J].食品工业科技,2014,35(16):101?104.
[8]刘紫薇,朱明明,王凤新,等.高温湿热处理对大豆分离蛋白的结构及其功能特性的影响[J].食品与发酵工业,2021,47(15):157?164.
[9]畅鹏,杜鑫,杨东晴,等.蛋白质热聚集行为机理及其对蛋白质功能特性影响的研究进展[J].食品工业科技,2018,39(24):318?325.
[10]HUSSAIN R, GAIANI C, JEANDEL C, et al. Combined effect of heat treatment and ionic strength on the functionality of whey proteins [J]. J Dairy Sci, 2012, 95(11): 6260?6273.
[11]娄爱华,潘腾,陈星,等.pH值对纯化猪肉肌球蛋白热聚集体的影响[J].中国食品学报,2021,21(6):46?53.
[12]HE XT, YANG XQ, ZHANG JB. Effects of pepsin hydrolysis on the soy β-conglycinin aggregates formed by heat treatment at different pH [J]. Int J Food Sci Technol, 2014, 49(7): 1729?1735.
[13]SCHMITT C, MOITZI C, BOVAY C, et al. Interal structure and colloidal behaviour of covalent whey protein microgels obtained by heat treatment [J]. Soft Matter, 2010, 6(19): 4876?4884.
[14]AMAGLIANI L, SCHMITT C. Globular plant protein aggregates for stabilization of food foams and emulsions [J]. Trends Food Sci Technol, 2017, 67: 248?259.
[15]宋淑敏,魏连会,石杰,等.汉麻籽蛋白提取制备工艺[J].食品工业,2019,40(10):63?65.
[16]安然.大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学,2019.
[17] ELLMAN GD. Tissue sulfhydryl groups [J]. Arch Biochem Biophy, 1959, 82: 70–72.
[18]李云.大豆蛋白聚集及共混凝胶性质研究[D].无锡:江南大学,2007.
[19]HE S, SHI J, WALID E, et al. Extraction and purification of a lectin from small black kidney bean (Phaseolus vulgaris) using a reversed micellar system [J]. Proc Biol, 2013, 48(4): 746?752.
[20]王冬梅,范志军,安然,等.大豆蛋白热聚集体的溶液行为表征[J].现代食品,2020,(7):182?184.
[21]SCHOKKER EP, SINGH H, PINDER DN, et al. Heat-induced aggregation of β-lactoglobulin AB at pH 2.5 as in fluenced by ionic strength and protein concentration [J]. Int Dairy J, 2000, 10: 233?240.
[22]李向红,华欲飞,刘展,等.不同离子强度大豆分离蛋白热诱导聚集体的研究[J].中国食品学报,2010,10(2):104?109.
[23]袁江兰,黄亚明,李传雯,等.大米谷蛋白热聚集的盐效应及机制[J].食品工业科技,2017,38(18):69?73.
[24]陈振家,王晓闻,荆旭,等.不同温度处理对红芸豆蛋白热稳定性及结构的影响[J].农业工程学报,2020,36(19):306?312.
[25]王喜波,曹佳,杨赛,等.大豆乳清蛋白与硫酸葡聚糖相互作用及乳化特性研究[J].农业机械学报,2021,52(10):409?416.
[26]吕彤,林俊杰,周昌瑜,等.热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J].农业工程学报,2016,32(8):285?291.
[27]PENG W, KONG X, CHEN Y, et al. Effects of heat treatment on the emulsifying properties of pea proteins [J]. Food Hydrocolloid, 2016, 52(2): 301?310.
[28]周建中.棉籽球蛋白热聚集行为及其凝胶特性研究[D].无锡:江南大学,2016.
[29]JIANG J, XIONG YL, CHEN J. pH Shifting alters solubility characteristics and thermal stability of soy protein isolate and its globulin fractions in different pH, salt concentration, and temperature conditions [J]. J Agric Food Chem, 2010, 58(13): 8035?8042.
[30]徐鹏伟. 火麻仁蛋白制备、性能表征及超声改性研究[D]. 北京: 中国科学院大学, 2020.
[31]WANG XS, TANG CH, YANG XQ, et al. Characterization, amino acid composition and in vitro digestibility of hemp (Cannabis sativa L.) proteins [J]. Food Chem, 2008, 107(1): 11?18.
[32]蒋将. pH 偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D]. 无锡: 江南大学, 2011.
[33]王庆玲. 汉麻蛋白改性对蛋白功能性质及营养价值的影响研究[D]. 无锡:江南大学,2019.
文章摘自:王冰,杨杨,范洪臣,李婷婷,张娜,石彦国,朱秀清.热处理温度和离子强度对汉麻蛋白热聚集行为的影响[J].食品安全质量检测学报,2022,13(16):5337-5344.