摘 要:汉麻花叶用乙醇浸泡提取后的残渣经过水提醇沉后,得到汉麻多糖-I,水相浓缩至小体积用乙酸乙酯萃取后,水层直接减压浓缩得到汉麻多糖-II,乙酸乙酯萃取后的水层继续用正丁醇萃取,减压浓缩得到汉麻多糖-III。用苯酚-硫酸法对3种汉麻多糖进行多糖质量分数的测定,并进行DPPH、ABTS、羟基、超氧阴离子自由基清除实验,结果表明,3种汉麻多糖对DPPH清除率和ABTS清除率都有良好的效果,汉麻多糖-II抗氧化活性最强,清除DPPH、ABTS、羟基、超氧阴离子自由基率的IC50分别为0.012,0.043,0.138,1.857mg/mL。
关键词:汉麻花叶;多糖;抗氧化
汉麻(Cannabis sativa L.)为桑科大麻属一年生草本植物,又被称为火麻、寒麻、线麻和魁麻等[1]。致幻成分四氢大麻酚(THC)含量<0.3%的非毒品利用价值的汉麻可以被大规模种植及加工利用[2]。汉麻的纤维、籽粒、秆芯、花、叶和根一般都是纺织、食品和医药等领域的重要来源。近几年,我国汉麻产业发展十分迅速,年产量平均增长25%[3]。现代药理学研究表明,汉麻具有抗癫痫、抗抑郁及抗氧化等生物活性[4]。但根据现有的汉麻提取加工技术,加工后残余物中含有大量的汉麻多糖[5],据报道汉麻多糖具有抗氧化、保湿、抑菌[6]等多种功效。因此,开发一种可以合理利用汉麻花叶残渣,实现资源高值化回收利用的方法具有重要意义。
1.1 材料与仪器
乙酸乙酯、正丁醇、无水乙醇、过氧化氢、邻苯三酚、硫酸亚铁均为分析纯,天津市科密欧化学试剂有限公司;水杨酸、抗坏血酸均为分析纯,阿拉丁试剂(上海)有限公司;DPPH(1,1-二苯基-2-苦肼基>97.0%)、ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐>98.0%),梯希爱(上海)化成工业发展有限公司。汉麻花叶由齐齐哈尔市塔哈乡大马岗村提供,采集后切碎晾干保存。SpectraMaxD3/iD5多功能酶标仪,美谷分子仪器(上海)有限公司。
1.2 提取物的制备
取30.0kg干燥的汉麻花叶,加120.0L乙醇室温浸泡3d后过滤,重复2次,得到滤渣。取干燥后的滤渣5.0kg,加入50.0L水,100℃加热提取1h后过滤,重复2次,合并提取液并减压浓缩至5.0L。常温下向浓缩液中加入15.0L 95%乙醇,搅拌后放置沉淀12h后抽滤,得滤饼和滤液。滤饼为汉麻多糖-I。将滤液减压浓缩至5.0L,每次用5.0L乙酸乙酯萃取2次,取水层3.0L减压浓缩至恒重得到乙酸乙酯萃取后的水溶物(汉麻多糖-II),剩余的2.0L滤液每次用2.0L正丁醇萃取2次,将得到的水层减压浓缩至恒重,得到正丁醇萃取后的水溶物(汉麻多糖-III)。
1.3 多糖质量分数的测定
1.3.1 标准曲线的测定
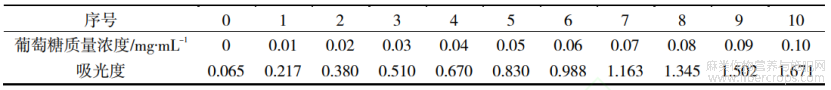
根据文献[7],将配制好的0.10mg/mL葡萄糖标准溶液,用蒸馏水稀释为0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08,0.09,0.10mg/mL的溶液,并标记离心管编号1~10,分别在每支离心管中加入5%苯酚和浓硫酸,然后将离心管放入沸水煮30min后取出,分别从每支离心管中取2.0mL加入比色皿。最后,空白对照为同样处理后的蒸馏水,标记为0,用紫外分光光度计,在490nm处测定样品的吸光度,并绘制葡萄糖标准曲线。
1.3.2 多糖质量分数测定
分别取3种汉麻多糖配制成0.10mg/mL样品溶液。按照标准曲线测定方法加入5%苯酚和浓硫酸,煮沸后,在490nm处测定其吸光度,进行3次平行实验,将所得的吸光度代入葡萄糖标准曲线方程,计算出3种汉麻多糖中多糖质量浓度ρ,计算3种汉麻多糖质量分数
多糖质量分数=![]() (1)
(1)
式中:ρ为3种样品中多糖质量浓度;V为3种样品体积(mL);m为3种样品质量(mg)。
1.4 抗氧化活性测试
1.4.1 DPPH自由基清除率
根据文献[8],分别取3种汉麻多糖配制成10.00mg/mL样品溶液,稀释浓度为0.01,0.025,0.05,0.10,0.20,0.40,0.60,0.80,1.00mg/mL,从稀释后的3种样品溶液与提前配制好的DPPH乙醇溶液等比例混合后在28℃避光反应30min。在517nm处测定样品的吸光度A1;对照组是以无水乙醇代替DPPH溶液,测定相应的吸光度A2;空白组是以无水乙醇代替样品溶液,测定相应的吸光度A0。Vc作为阳性对照,按上述方法测定DPPH自由基清除率。
根据文献[9],分别取3种汉麻多糖配制成10.00mg/mL样品溶液,进行稀释(与1.4.1一致),精确量取稀释后的3种样品溶液0.8mL,加入提前配制好的ABTS乙醇溶液3.2mL,混合均匀后在25℃下避光反应10min。在734nm处测定样品的吸光度A1;对照组是精确量取稀释后的样品溶液0.8mL与3.2mL无水乙醇混合,测定相应的吸光度A2;空白组是ABTS乙醇溶液与无水乙醇等比例混合,测定相应的吸光度A0。Vc作为阳性对照,按上述方法测定ABTS自由基清除率。
1.4.3 羟基自由基清除率
根据文献[10-11],分别取3种汉麻多糖配制成10.00mg/mL样品溶液,进行稀释(与1.4.1一致),精确量取稀释后的样品溶液、9mmol/L水杨酸乙醇溶液和9mmol/L硫酸亚铁溶液各0.5mL,混合均匀,加入8.8mmol/L双氧水溶液0.5mL,在37℃下反应30min。在510nm处测定样品的吸光度A1;对照组用等体积去离子水代替双氧水溶液,测定相应的吸光度A2;空白组用等体积去离子水代替样品溶液,测定相应的吸光度A0。Vc作为阳性对照,按上述方法测定羟基自由基清除率。
1.4.4 超氧阴离子自由基清除率
根据文献[12-13],分别取3种汉麻多糖配制成10.00mg/mL样品溶液,进行稀释,(与1.4.1一致),在25℃的水浴锅中预热配制好的Tris-HCl缓冲液20min。取预热后的Tris-HCl缓冲液4.5mL,再加入稀释后的样品溶液各1.0mL和25mmol/L邻苯三酚溶液0.4mL。混合后的溶液在25℃水浴中反应4min,然后加入8%盐酸溶液1.0mL终止反应,在320nm处测定样品的吸光度A1;对照组用去离子水代替邻苯三酚溶液,测定相应的吸光度A2;空白组用去离子水代替样品溶液,测定相应的吸光度A0。Vc作为阳性对照,按上述方法测定超氧阴离子自由基清除率。
1.4.5 自由基清除率和 IC50值的计算
DPPH、ABTS、羟基、超氧阴离子自由基清除率计算公式为
清除率=![]() (2)
(2)
式中:A0为空白组吸光度值;A1为样品组吸光度值;A2为对照组吸光度值。
采用IBM SPSS Statistics对各浓度所对应的清除率进行分析计算,得出不同自由基清除率的IC50值。
2.1 葡萄糖标准曲线
通过苯酚-硫酸法测得葡萄糖的吸光度,结果如表1所示。以葡萄糖浓度为x轴,吸光度为y轴,绘制葡萄糖标准曲线,得回归方程y=16.0809x+0.04514,相关系数为R2=0.999,表明两者存在较好的线性关系。
表1 葡萄糖标准溶液浓度与吸光度测定数值表
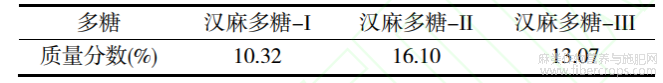
对3种汉麻多糖中多糖质量分数的测定结果如表2所示。由表2可以看出,乙酸乙酯萃取后的水层(汉麻多糖-II)中多糖质量分数最高,其次是正丁醇萃取后的水层(汉麻多糖-III)和汉麻醇沉产物(汉麻多糖-I)。
表2 3种汉麻多糖质量分数
2.3 多糖对DPPH自由基的清除能力
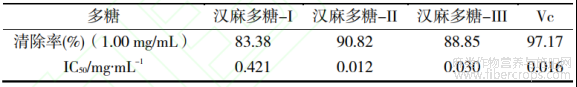
以Vc为对照,测定3种汉麻多糖对DPPH的清除能力,并计算IC50值,结果如表3所示。由表3可知,3种汉麻多糖对DPPH都具有一定的清除能力,其IC50值从大到小依次为:汉麻多糖-II>Vc>汉麻多糖-III>汉麻多糖-I。其中,汉麻多糖-II在1.00mg/mL浓度下对DPPH的清除能力达到90.82%,小于阳性对照Vc。
表3 3种汉麻多糖对DPPH自由基清除率的IC50值
2.4 多糖对ABTS自由基的清除能力
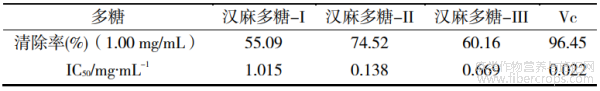
以Vc为对照,测定3种汉麻多糖对ABTS自由基的清除能力,并计算IC50值,结果如表4所示。由表4可知,3种汉麻多糖对ABTS自由基的清除能力从大到小依次为:Vc>汉麻多糖-II>汉麻多糖-III>汉麻多糖-I。其中,汉麻多糖-II在1.00mg/mL浓度下的清除率达到99.34%,仅次于阳性对照Vc。
表4 3种汉麻多糖对ABTS自由基清除率的IC50值
2.5 多糖对羟基自由基的清除能力
以Vc为对照,测定3种汉麻多糖对羟基自由基的清除能力,并计算IC50值,结果如表5所示。3种汉麻多糖对羟基自由基都具有一定的清除能力,3种汉麻多糖对羟基自由基清除能力的IC50值,从大到小依次为:Vc>汉麻多糖-II>汉麻多糖-III>汉麻多糖-I。其中,汉麻多糖-II在1.00mg/mL浓度下的清除率达到74.52%。
表5 3种汉麻多糖对羟基自由基清除率的IC50值
2.6 多糖对超氧阴离子自由基的清除能力
以Vc为对照,测定3种汉麻多糖对超氧阴离子自由基的清除能力,并计算IC50值,结果如表6所示。3种汉麻多糖对超氧阴离子自由基清除能力从大到小依次为:Vc>汉麻多糖-II>汉麻多糖-III>汉麻多糖-I。其中,汉麻多糖-II在1.00mg/mL浓度下的清除率达到35.18%,小于阳性对照Vc。另外,与前3种相比,3种汉麻多糖对超氧阴离子自由基清除能力均较弱。
表6 3种汉麻多糖对超氧阴离子自由基清除率的IC50值
3 结论
通过苯酚-硫酸法对3种汉麻多糖进行多糖质量分数的测定,其中,汉麻多糖-II的质量分数最高,为16.10%。对3种汉麻多糖进行DPPH、ABTS、羟基、超氧阴离子自由基清除实验,3种汉麻多糖对DPPH和ABTS清除率都有良好的效果,它们的活性顺序为:汉麻多糖-II>汉麻多糖-III>汉麻多糖-I,其中,汉麻多糖-II抗氧化活性最强。利用该特性,可将汉麻多糖应用于化妆品和饲料等相关领域。
[1] 徐梅,王常青,赵大洲. 火麻仁多肽的制备及减肥功能研究[J]. 现代食品,2022, 28(7): 190-194.
[2] 张晓艳,孙宇峰,曹焜,等. 纤用工业大麻雌雄株主要农艺性状的初步研究[J]. 中国农学通报,2020, 36(20): 1-6.
[3] 常存,潘宇涛,赵金海,等. 黑龙江省汉麻产业发展分析[J]. 黑龙江科学,2020, 11(22): 5-8.
[4] 吴肖肖,梅秀明,蒋迪尧,等. 超高效液相色谱串联质谱法测定纺织品中大麻二酚[J]. 印染,2020, 46(6): 54-58.
[5] Chang T, Li H, Lv H, et al. Extraction, physicochemical properties, anti-aging, and antioxidant activities of polysaccharides from industrial hemp residues[J]. Molecules, 2022, 27(18): 5746.
[6] 郭孟璧,郭蓉,郭鸿彦,等. 工业大麻雌株花叶多糖抑菌活性及稳定性分析[J]. 食品与生物技术学报,2019, 38(6): 11-16.
[7] 高馨,郭义美,周君,等. 苯酚-硫酸法测定红参多糖含量研究[J]. 实验室科学,2018, 21(1): 28-30, 33.
[8] 李芳龙,阿呷尔布,李家东,等. 水柏枝乙醇提取物不同极性部位体外抗氧化活性研究[J]. 四川农业大学学报,2021, 39(4): 512-517.
[9] 陈誉,罗磊,王硕,等. 咖啡果壳多酚的提取及抗氧化和抗炎特性[J]. 食品与生物技术学报,2022, 41(8): 104-111.
[10] 冯彦博. 香菇子实体多糖的抗氧化和对急性肺损伤的修复作用[D]. 泰安:山东农业大学,2021.
[11] 田爱莹. 汉麻叶活性成分的提取分离及其抗氧化活性研究[D]. 天津:天津科技大学,2015.
[12] 杜玉菲,王建芬,林聪,等. 不同加工形式的茶叶水提物抗氧化性比较研究[J]. 食品安全导刊,2020(30): 116-118.
[13] 刘羽倩. 胚芽黄茶发酵工艺的研究[D]. 贵阳:贵州大学,2023.
文章摘自:刘东辉,程亮,赵英楠,孙立秋,王丹,李军,时志春,霍金海,赵明,张树军. 汉麻多糖的提取及抗氧化活性研究[J]. 齐齐哈尔大学学报(自然科学版). 2024,40(01):51-55.