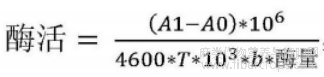摘 要:本发明涉及生物工程和苎麻纤维脱胶领域,具体涉及一种碱性果胶裂解酶及其在苎麻脱胶中的应用。本发明对来源于Paenibacillustarimensis的氨基酸序列为SEQIDNo:1所示的野生型碱性果胶裂解酶进行定点突变获得热稳定性显著提升的碱性果胶裂解酶,其氨基酸序列如SEQIDNo:3所示。与现有技术相比,本发明提供的碱性果胶裂解酶属于嗜热耐碱酶,能够在pH6~12范围内保持稳定,为苎麻脱胶酶制剂或复合酶制剂提供了一种新的优良的选择。与对应的野生型碱性果胶裂解酶相比,本发明的碱性果胶裂解酶在65℃,pH10热碱条件下的半衰期提高了接近1倍,且具有更佳的苎麻脱胶效果,更有利于工业应用。
技术要点
1.一种碱性果胶裂解酶,其特征在于,其氨基酸序列如SEQIDNO:3所示。
2.编码权利要求1所述碱性果胶裂解酶的基因。
3.如权利要求2所述基因,其特征在于,所述基因的核苷酸序列如SEQIDNO:4所示。
4.一种包含如权利要求2所述基因的重组载体或重组菌株。
5.如权利要求4所述的重组载体或重组菌株,其特征在于,所述重组载体的表达载体包括以pPIC9K。
6.如权利要求4所述的重组载体或重组菌株,其特征在于,所述重组菌株的宿主包括毕赤酵母。
7.如权利要求1所述碱性果胶裂解酶的制备方法,其特征在于,包括如下步骤:构建权利要求4或5所述重组表达载体并转化至宿主细胞,获得重组表达菌株,对所述重组表达菌株进行培养、诱导表达、分离纯化,得到所述碱性果胶裂解酶。
8.如权利要求7所述制备方法,其特征在于,构建所述重组表达载体包括如下步骤:
(1)筛选得到氨基酸序列如SEQIDNO:1所示的碱性果胶裂解酶,合成对应的核苷酸序列并连接至表达载体,获得重组质粒,所述核苷酸序列如SEQIDNO:2所示;
(2)以所述重组质粒为模板,设计突变引物,进行定点突变PCR扩增反应,获得所述重组表达载体。
9.如权利要求1~8所述碱性果胶裂解酶在苎麻脱胶中的应用。
10.如权利要求7所述的应用,其特征在于,所述碱性果胶裂解酶用于苎麻脱胶的温度为50℃~70℃,pH为6~12。
技术领域
本发明涉及生物工程和苎麻纤维脱胶领域,具体涉及一种碱性果胶裂解酶及其在苎麻脱胶中的应用。
背景技术
纺织工业中最常用的原料为植物纤维,如棉花、苎麻等,这些植物纤维中大都含有果胶类杂质,因此在纺织工业原料加工过程中,需要通过一些手段去除植物纤维中的果胶类杂质,即脱胶处理。传统的化学脱胶方法是利用高温和强碱性条件处理纺织原料以达到脱胶的目的,该方法存在生产能耗大、处理时间长、操作环境比较危险及产生的废液对环境危害较大等弊端。因此,目前纺织工业脱胶处理的发展趋势是采用生物酶法进行原料脱胶处理,其常用的酶有果胶裂解酶、聚半乳糖醛酸酶、果胶甲酯酶、淀粉酶以及纤维素酶等。
其中,果胶裂解酶来源广泛,主要由真菌和细菌产生,通过β-消除反应作用于聚半乳糖醛酸(Polygalacturonicacid)的α-1,4糖苷键,并在非还原末端生成4,5-不饱和寡聚半乳糖醛酸。作为棉织物精练、苎麻脱胶的关键酶之一,果胶裂解酶可以去除果胶质,提高纤维吸水性,保持纤维柔软手感,并提高纤维的可纺性能、成纱性能。目前,国内外已有许多商品化的果胶裂解酶制剂用于纺织工业中,但大多数果胶裂解酶的使用条件是常温或中温,无法满足苎麻脱胶高温强碱的工作环境,且需较长的作用时间才能达到预期效果。
发明内容
基于此,本发明通过酶挖掘与改造技术获得新的嗜热的碱性果胶裂解酶,为苎麻脱胶工艺提供新的酶制剂,为纺织复合酶制剂创制提供新选择。
本发明上述目的通过以下技术方案实现:
一种碱性果胶裂解酶,其氨基酸序列如SEQIDNO:3所示。
本发明的碱性果胶裂解酶属于嗜热耐碱酶,通过对来源于Paenibacillustarimensis的氨基酸序列为SEQIDNo:1所示的野生型碱性果胶裂解酶进行定点突变获得,与野生型碱性果胶裂解酶相比,本发明的碱性果胶裂解酶在65℃,pH10热碱条件下的半衰期提高了接近1倍,且具有更佳的苎麻脱胶效果,更有利于工业应用,为苎麻脱胶酶制剂或复合酶制剂提供了一种新的优良的选择。
进一步,编码所述碱性果胶裂解酶的基因。
进一步,所述基因的核苷酸序列如SEQIDNO:4所示。
进一步,包含所述基因的重组载体或重组菌株。
进一步,所述重组载体的表达载体包括pPIC9K。
进一步,所述重组菌株的宿主包括毕赤酵母。
进一步,所述碱性果胶裂解酶的制备方法包括如下步骤:构建所述重组表达载体并转化至宿主细胞,获得重组表达菌株,对所述重组表达菌株进行培养、诱导表达、分离纯化,得到所述碱性果胶裂解酶。
进一步,构建所述重组表达载体包括如下步骤:
(1)筛选得到氨基酸序列如SEQIDNO:1所示的碱性果胶裂解酶,合成对应的核苷酸序列并连接至表达载体,获得重组质粒,所述核苷酸序列如SEQIDNO:2所示;
(2)以所述重组质粒为模板,设计突变引物,进行定点突变PCR扩增反应,获得所述重组表达载体。
本发明还提供所述碱性果胶裂解酶在苎麻脱胶中的应用。
进一步,所述碱性果胶裂解酶用于苎麻脱胶的温度为50℃~70℃,pH为6~12。
说明书附图
图1为本发明突变型碱性果胶裂解酶pel114-A308I基因片段的PCR产物琼脂糖凝胶电泳图;泳道M为Marker;泳道1为pel114-A308I基因;
图2是本发明突变型碱性果胶裂解酶经Ni-NTA亲和层析处理后的SDS-PAGE分析结果;其中,泳道M为分子量Marker;泳道1为毕赤酵母GS115/pPIC9K-pel114-A308I纯化样品;泳道2为毕赤酵母GS115/pPIC9K-pel114-A308I发酵上清液;
图3是本发明野生型及突变型碱性果胶裂解酶的最适反应温度曲线;
图4是本发明野生型及突变型碱性果胶裂解酶的最适pH曲线;
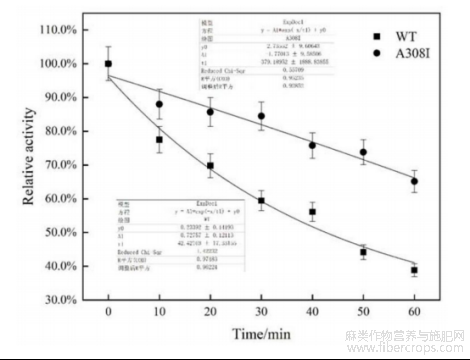
图5是本发明野生型及突变型碱性果胶裂解酶在65℃下的半衰期曲线;
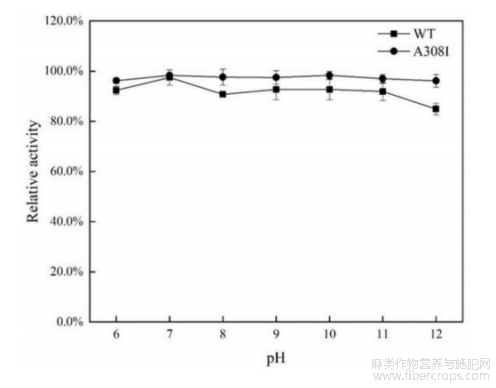
图6是本发明野生型及突变型碱性果胶裂解酶的pH稳定性曲线。
具体实施方式
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。其中,采用“原始氨基酸位置替换的氨基酸”来表示碱性果胶裂解酶中突变的氨基酸,如“AxxB”表示第xx位的氨基酸由野生型酶的氨基酸A替换成氨基酸B,位置的编号对应SEQIDNo:1中野生型碱性果胶裂解酶的氨基酸序列编号。
为了获得一种新的嗜热的碱性果胶裂解酶,为苎麻脱胶工艺提供新的酶制剂或复合酶制剂提供新选择,发明人进行了以下酶挖掘和改造过程:
(1)进行文献调研并整理比较已报道的不同来源的碱性果胶裂解酶的酶学性质,选择了目前报道酶活最高的来自于类芽孢杆菌0602的pelN酶作为探针酶,该酶最适反应温度为65℃,最适pH为9.8,比酶活为2060U/mg,在60℃下的半衰期为16.5min。
(2)基于探针酶pelN的氨基酸序列,在NCBI数据库上通过Blastp进行候选序列收集,筛选与探针酶序列相似性在30%~80%的氨基酸序列,剔除重复、异常、不完整的序列后,共收集到565条序列,并通过分子进化遗传学分析(MAFFT等工具)进行系统发育分析,绘制系统发育树。
(3)选择探针酶所在及临近分支,进行来源及家族结构域划分,从中筛选与探针酶同一家族且同样来自类芽孢杆菌的候选序列,利用序列分析软件对探针酶及所述候选序列进行比对,通过确定的保守的序列模式筛选具有果胶裂解酶活性的候选序列。
(4)制备步骤(3)筛选的候选序列对应的酶并分析其酶学性质,从中筛选可以分解果胶的嗜热耐碱酶,获得了来源于Paenibacillustarimensis的野生型碱性果胶裂解酶pel114(NCBIReferenceSequence登录号:WP_235289114.1),其与探针酶的序列相似性为69.18%,且目前尚未有与该野生型碱性果胶裂解酶pel114的应用相关的报道。
其中,所述氨基酸序列对应的酶的制备及其酶学性质分析过程如下:根据所述氨基酸序列,合成对应的核苷酸序列,将所述核苷酸序列连接至表达载体,获得重组质粒并转化到宿主细胞中,获得重组菌株并进行种子培养、发酵培养、诱导表达和分离纯化,获得纯度较高的重组蛋白;检测重组蛋白分解不饱和聚半乳糖醛酸的酶活、最适pH、最适温度、pH稳定性和半衰期,筛选嗜热耐碱的重组蛋白。
(5)利用SWISS-MODEL平台对碱性果胶裂解酶pel114进行同源建模,并利用第三方平台对模型情况进行打分,打分情况为优。
(6)通过alphafold2对碱性果胶裂解酶pel114进行结构预测,基于FireProt网站的理性设计进行预测,得到一些活性位点。
(7)在300K和350K的耦合温度下对碱性果胶裂解酶pel114进行分子动力学模拟,根据均方根波动值(RMSF)波动确定碱性果胶裂解酶pel114的柔性区域,对该区域进行虚拟饱和突变,得到一些自由能较低的突变位点。同时,将本发明的碱性果胶裂解酶与已有报道的耐热的碱性果胶裂解酶进行序列比对,得到一些潜在的突变位点。
(8)对步骤(7)获得的突变位点进行定点突变,制备相应的突变型碱性果胶裂解酶,检测上述突变型碱性果胶裂解酶的酶学性质,经筛选,得到热稳定性显著提高的突变体A308I,其氨基酸序列如SEQIDNO:3所示。
基于上述理论分析,发明人根据探针酶筛选获得了氨基酸序列如SEQIDNO:1所示的野生型碱性果胶裂解酶pel114,然后对该野生型碱性果胶裂解酶进行结构预测、分子动力学模拟等,获得一些潜在突变位点,然后通过筛选获得A308I定点突变的突变型碱性果胶裂解酶A308I,其氨基酸序列如SEQIDNO:3所示,其筛选和制备方法包括如下步骤:
(1)筛选得到氨基酸序列如SEQIDNO:1所示的野生型碱性果胶裂解酶pel114,合成对应的核苷酸序列并连接至表达载体,获得重组质粒,所述核苷酸序列如SEQIDNO:2所示;
(2)以步骤(1)获得的重组质粒为模板,设计突变引物,进行定点突变PCR扩增反应,获得所述重组表达载体;
(3)将步骤(2)获得的重组表达载体转化到宿主细胞中,获得重组表达菌株;
(4)对步骤(3)获得的重组菌株进行种子培养、发酵培养和诱导表达,然后离心收集上清液,利用Ni-NTA柱层析获得纯度较高的重组蛋白;
(5)检测重组蛋白分解不饱和聚半乳糖醛酸的酶活、最适pH、最适温度、pH稳定性和半衰期,筛选嗜热耐碱的重组蛋白,获得碱性果胶裂解酶A308I。
下面结合具体实施例,进一步阐述本发明。
本发明实施例中的全基因合成皆由苏州金唯智生物科技有限公司完成。
本发明实施例所用试剂如下:
MD固体培养基包含20g/L葡萄糖,13.4g/L无氨基酵母氮源,20g/L琼脂。
BMGY液体培养基包含20g/L胰蛋白胨、10g/L酵母提取物、10mL/L甘油、13.4g/L无氨基酵母氮源、0.1mol/L磷酸盐。
BMMY液体培养基包含20g/L胰蛋白胨、10g/L酵母提取物、13.4g/L无氨基酵母氮源、0.1mol/L磷酸盐、10mL/L甲醇。
此外,内切酶购自Fermentas公司,连接酶购自Invitrogen公司,底物不饱和聚半 乳糖醛酸购买自sigma公司。所使用的其他材料、试剂等,如无特别说明,为从商业途径得到 的材料和试剂。
本发明实施例中未注明具体条件的实验方法,通常按照制造厂商所建议的条件。
实施例1:野生型碱性果胶裂解酶的制备
(1)重组质粒pPIC9K-pel114的构建
通过NCBI获得来源于Paenibacillus tarimensis的碱性果胶裂解酶的全基因序 列pel114,其氨基酸序列如SEQ ID No:1所示,将其进行密码子优化后得到如SEQ ID No:2 所示的核苷酸序列,全基因合成优化后的核苷酸序列并亚克隆到表达载体pPIC9K上,得到 重组质粒pPIC9K-pel114。
(2)菌落PCR鉴定和测序
将步骤(1)获得的重组质粒pPIC9K-pel114用SacI进行线性化,利用电转化的方法 将其转化至宿主细胞毕赤酵母GS115中。对转化的抗MD平板上的单菌落进行菌落PCR验证, 得到表达菌种毕赤酵母GS115/pPIC9K-pel114。
(3)酶的诱导表达及纯化
将表达菌种毕赤酵母GS115/pPIC9K-pel114接种于10mL BMGY液体培养基中,30 ℃ , 250rpm,振荡培养过夜;常温3000g离心2min后,收集菌体,将其转接至BMMY培养基中,转 接后的菌液OD600为0.5~1 .0;30℃ , 250rpm条件下继续培养24h~120h,期间每隔24h取样并 向培养基中添加甲醇至1.0%v/v,培养完成后,固液分离获得发酵上清液。
使用AKTA蛋白纯化系统对获得的发酵上清液进行Ni-NTA柱层析。用含有300mM咪唑的20mMTris-HCl缓冲液洗脱,用超滤管(Millipore)浓缩收集目标蛋白溶液,得到野生型碱性果胶裂解酶WT,通过SDS-PAGE分析判断WT蛋白质纯度。
实施例2:突变型碱性果胶裂解酶的制备
(1)重组质粒pPIC9K-pel114-A308I的构建
以实施例1的重组质粒pPIC9K-pel114为模板,设计引物,引物序列如表1所示,进行PCR扩增获得具有特异性点突变A308I的目的基因片段。用内切酶对PCR产物与质粒pPIC9K进行酶切,再使用连接酶对酶切产物进行连接反应,获得重组质粒pPIC9K-pel114-A308I。
表1引入突变碱基的引物及其序列
(2)菌落PCR鉴定和测序
将步骤(1)获得的重组质粒pPIC9K-pel114-A308I用SacI进行线性化,利用电转化的方法将其转化至宿主细胞毕赤酵母GS115中。对转化的抗MD平板上的单菌落进行菌落PCR,然后将PCR产物点至1%琼脂糖凝胶电泳胶孔内(另点一孔Marker作为对照),110V分离30min后将琼脂糖凝胶电泳胶浸泡于Gelred染色液15min,根据Marker判断菌落PCR产物条带的大致大小,并与预期的条带大小相比较,从而确定表达菌株构建是否完成,实验结果见图1。本实施例中,通过菌落PCR鉴定阳性转化子,得到表达菌种毕赤酵母GS115/pPIC9K-pel114-A308I。将含有A308I突变的碱性果胶裂解酶命名为A308I,其氨基酸序列为SEQIDNO:3,编码核苷酸序列为SEQIDNO:4。
(3)酶的诱导表达及纯化
将表达菌种毕赤酵母GS115/pPIC9K-pel114-A308I接种于10mLBMGY液体培养基中,于30℃,250rpm振荡培养过夜;常温、3000g条件下离心2min以收集菌体,将菌体转接至BMMY培养基中,使转接后的菌液OD600为0.5~1.0;于30℃,250rpm条件下继续培养24h~120h,期间每隔24h取样并向培养基中添加甲醇至1.0%v/v,培养完成后,固液分离获得发酵上清液。
使用AKTA蛋白纯化系统对获得的发酵上清液进行Ni-NTA柱层析,用含有300mM咪唑的20mMTris-HCl缓冲液洗脱,用超滤管浓缩收集目标蛋白溶液,得到突变型碱性果胶裂解酶A308I,通过SDS-PAGE分析判断A308I蛋白质纯度,图2表明,通过Ni-NTA一步纯化,获得了电泳纯的碱性果胶裂解酶A308I目的蛋白。
效果例1:野生型和突变型碱性果胶裂解酶的酶学性质测定
(1)碱性果胶裂解酶的酶活测定
取160μL底物溶液(0.2%不饱和聚半乳糖醛酸溶液)在最适温度下预热适当时间,加入40μL酶液,最适温度下震荡反应10min后,加入300μL0.03M的H3PO4溶液终止反应,继续震荡5min后,取200μL加入紫外专用酶标板,测量其在波长为235nm下的吸光值。对照组则加入40μL缓冲液,160uL底物溶液,相同条件下反应10min,加入300μL0.03M的H3PO4溶液终止反应,继续震荡5min后,取200μL加入紫外专用酶标板,测量其在波长为235nm下的吸光值。
果胶裂解酶酶活(U)的定义为:每分钟使聚半乳糖醛酸裂解产生1μM的不饱和聚半乳糖醛酸所需的酶量。
果胶裂解酶酶活的计算公式如下:
其中,T(min)为在酶反应的线性范围内的酶促反应时间,b(cm)为光程,酶量(mg)=浓度*体积,A1为样品反应液在235nm的吸收值,A0为对照组在235nm的吸收值,4600(L·mol-1cm-1)为不饱和聚半乳糖醛酸在235nm处的摩尔吸光系数。
(2)酶学性质测定
按照上述酶活测定方法,测定实施例1制备的野生型碱性果胶裂解酶WT和实施例2制备的突变型碱性果胶裂解酶A308I在不同的温度(45~75℃)下的酶活和不同pH(pH7.0~11.0)下的酶活,确定其最适反应温度和最适反应pH。
将适当稀释的酶液置于65℃中,每隔20min取一次样并测定其酶活,以加热前的酶活为100%计算相对酶活,统计所得数据并算出野生型及突变型碱性果胶裂解酶的半衰期t1/2来衡量其热稳定性。
分别用50mM的Tris-HCl缓冲液(pH7.0~9.0)、50mM的Gly-NaOH缓冲液(pH9.0~11.0)和50mM的Na2HPO4-NaOH缓冲液(pH12.0)配制酶液,使反应体系的pH在6.0-12.0范围内,于4℃下处理12h,测定残余酶活性,以未处理的酶活为100%计算相对酶活,以研究碱性果胶裂解酶的pH稳定性。
参阅图3~图4,野生型碱性果胶裂解酶WT与突变型碱性果胶裂解酶A308I的最适温度均为60℃,最适反应pH均为10.0。参阅图5,在65℃条件下,野生型碱性果胶裂解酶的半衰期为55min,其热稳定性显著高于探针酶pelN,另外,突变型碱性果胶裂解酶的半衰期为90min,显著高于野生型碱性果胶裂解酶,因此突变体的热稳定性有较大的提高。参阅图6,在pH6.0~12.0范围内室温处理野生型碱性果胶裂解酶与突变型碱性果胶裂解酶12h,两者均能保持80%以上的酶活力。
效果例2:野生型和突变型碱性果胶裂解酶的苎麻脱胶分析
按照以下方法进行苎麻脱胶:
①压麻:将苎麻进行机械碾压直至苎麻柔软松散。
②预处理:将苎麻浸渍在含5g/L尿素、3g/L渗透剂JFC?6的溶液中24h,固浴比为1:10。
③酶处理:将苎麻按浴比1:10浸泡在含1g/L渗透剂JFC?6的50mMGly?NaOH,pH10的缓冲液中,加入适量酶在60℃水浴16h进行酶脱胶处理。其中,每15g苎麻需使用1000U的碱性果胶裂解酶进行酶脱胶处理。
④碱氧处理:将苎麻按浴比1:10浸渍在含6mL/L30%H2O2,4g/LNaOH溶液中于40℃水浴;将温度升至60℃,保温10min后加入6mL/L30%H2O2;将温度升至98℃,保温30min,期间多次翻拌,保证漂白均匀。
⑤还原:按浴比1:10将苎麻置于2g/L乙酸浸渍10min,水洗,然后在含2g/L脱氧酶JMN?6中于50℃浸泡10min。
⑥上油:按浴比1:10将苎麻浸泡在含5g/L乳化油JM?D1、5g/L乳化油JM?D2的溶液中,40℃浸泡45min。
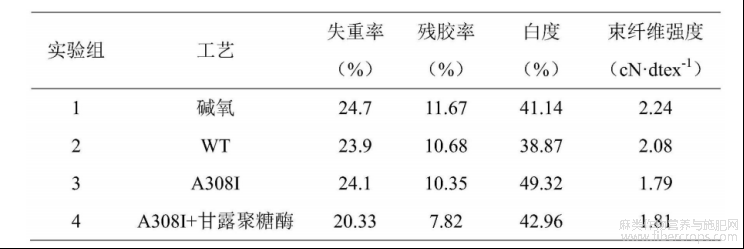
实验共分为4组,实验组1不进行酶脱胶处理,实验组2~4分别采用野生型碱性果胶裂解酶WT、突变型碱性果胶裂解酶A308I、突变型碱性果胶裂解酶A308I与甘露聚糖酶复配进行苎麻脱胶的酶处理工艺。
将原麻烘至恒重,冷却后称重(记为m0),经过脱胶处理后将其再次烘干,记录脱胶后苎麻的干重(记为m1),计算失重率,失重率=(m0?m1)/m0×100%。
参照GBT5889?1986《苎麻化学成分定量分析方法》,对脱胶后的苎麻精干麻的残胶率进行测试,苎麻精干麻残胶率公式如下:残胶率(%)=(试样的干重?提取残胶后的试样干重)/试样的干重×100%。
参照GBT5885?1986《苎麻纤维白度试验方法》,对脱胶后的苎麻精干麻的白度进行测试,精干麻的白度计算公式如下:白度(度)=试样平均白度值/试样的测定次数束纤维断裂强度测试方法如下:测试仪器购于常州第一纺织厂,测试样品切割长度为40mm,控制样品重量在10mg左右,将机器的夹距调节为10mm,拉伸速度为300mm/min,束纤维强度的计算公式为以下所示:麻束的线密度(dtex)=麻束的质量/麻束的切割长度×104,束纤维断裂强度(cN·dtex?1)=麻束的断裂强力/麻束的线密度。
表2不同酶复配处理对苎麻纤维性能的影响
参阅表2,与纯碱氧方法相比,加入野生型碱性果胶裂解酶WT或突变型碱性果胶裂解酶A308I后,苎麻的残胶率下降,其中,突变型碱性果胶裂解酶A308I处理的苎麻的蓝光白度显著上升,因此,添加碱性果胶裂解酶可以提升苎麻的脱胶效果,其中突变型碱性果胶裂解酶的辅助脱胶效果更佳。此外,突变型碱性果胶裂解酶与甘露聚糖酶复配处理的苎麻的残胶率显著下降,因此,本发明的突变型碱性果胶裂解酶可以与其他酶复配,以提升酶法苎麻脱胶的效果。
综上,本发明的野生型及突变型碱性果胶裂解酶属于嗜热耐碱酶,其最适温度为60℃,最适pH为10,并且能够在较宽的pH范围内(即pH6~12)保持稳定,并且与探针酶相比,本发明的碱性果胶裂解酶的热稳定性得以显著提升,其中突变型碱性果胶裂解酶的热稳定性显著优于野生型果胶裂解酶。本发明的野生型及突变型碱性果胶裂解酶可用于高温强碱环境下的苎麻脱胶工艺,降低苎麻的脱胶率,为苎麻脱胶工业的酶制剂和复配酶制剂需求提供了一种新选择,其中突变型碱性果胶裂解酶在降低苎麻残胶率的同时能够提升苎麻白度,具有更佳的辅助苎麻脱胶的作用。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
文章摘自国家大麻专利:一种碱性果胶裂解酶及其在苎麻脱胶中的应用,发明人:郑穗平,陈妤坤,申请号:202311686995.7,申请日:2023.12.08