摘 要:本发明提供了一种红麻快速发根的培育方法,属于生物技术领域,包括:将HcNI R基因片段连接在过表达载体上,将获得的HcNI R基因过表达载体转化发根农杆菌,后制备发根农杆菌菌液;红麻种子萌发后,将其子叶进行切割,获得外植体;将所述外植体伤口朝下置于培养基中进行预培养;预培养结束后,将所述外植体浸泡在所述发根农杆菌菌液中,后取出,伤口朝上置于恢复培养基中,进行黑暗培养;黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养,获得带根系的外植体。该方法能够有效将红麻根结线虫抗性基因导入红麻,获得抗根结线虫的红麻植株,该方法能够节省大量的时间、人力和物力,提高工作效率。
权利要求书
1.一种红麻快速发根的培育方法,其特征在于,所述培育方法包括:
将HcNIR基因片段连接在过表达载体上,获得HcNIR基因过表达载体;
将所述HcNIR基因过表达载体转化发根农杆菌,后制备发根农杆菌菌液;
红麻种子萌发后,将其子叶进行切割,获得外植体;
将所述外植体伤口朝下置于培养基中进行预培养;
预培养结束后,将所述外植体浸泡在所述发根农杆菌菌液中,后取出,伤口朝上置于恢复培养基中,进行黑暗培养;
黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养,获得带根系的外植体;
其中,所述HcNIR基因片段的核苷酸序列如SEQ ID NO.1所示。
2.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述将HcNIR基因片段连接在过表达载体上,获得HcNIR基因过表达载体,具体包括:
将HcNIR基因片段连接在过表达载体PHG上,获得HcNIR基因过表达载体PHG?HcNiR。
3.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述将所述HcNIR基因过表达载体转化发根农杆菌,后制备发根农杆菌菌液,具体包括:
采用冻融法将所述HcNIR基因过表达载体转化至发根农杆菌A4感受态细胞,获得含有HcNIR基因的发根农杆菌;
将所述含有HcNIR基因的发根农杆菌进行培养,获得发根农杆菌菌液。
4.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述红麻种子萌发后,将其子叶进行切割,获得外植体,具体包括:
将灭菌后的红麻种子置于萌发培养基中,放在环境温度为25℃,光周期为16/8h的培养室中培养7?10d后,去掉种皮,将子叶切割成大小均一的矩形,获得外植体。
5.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述将所述外植体伤口朝下置于培养基中进行预培养,具体包括:
将所述外植体伤口朝下置于恢复培养基中,在环境温度25℃,16h光照条件下,将外植预培养1d。
6.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述预培养结束后,将所述外植体浸泡在所述发根农杆菌菌液中,后取出,伤口朝上置于恢复培养基中,进行黑暗培养,具体包括:
预培养结束后,将所述外植体置于所述发根农杆菌菌液中浸泡15min,后取出吸干多余菌液,伤口朝上置于恢复培养基中,25℃黑暗条件下黑暗培养2~3d。
7.根据权利要求1所述的一种红麻快速发根的培育方法,其特征在于,所述黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养,获得带根系的外植体,具体包括:
黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养7?10d,获得带根系的外植体。
技术领域
本发明属于生物技术领域,特别涉及一种红麻快速发根的培育方法。
背景技术
红麻(Hibiscus cannabinus)又名洋麻或槿麻,为锦葵科(Malvaceae)木槿属(Hibiscus)一年生草本韧皮纤维作物,是麻纺和造纸工业的重要原料,其纤维强力大、吸湿性好、散水快,耐腐蚀磨损,应用领域十分广阔。红麻根结线虫病(Meloidogyne spp .)是一种世界性病害,据报道,20世纪七八十年代,红麻和玫瑰麻在美国作为商品生产的主要障碍是易感染根结线虫,在美国东南部,红麻栽培品种普遍高度感染数种根结线虫。据调查,在我国各红麻主产区,红麻根结线虫病也普遍发生,一般造成减产20%~30%,严重者达50%以上,甚至绝产,造成红麻生产的巨大经济损失。
截止到目前,对红麻根结线虫的研究仍处于感染后筛选抗病优良品种的初级阶段,现有技术的缺点是成本高、效率底、耗时间,同时还不能准确地把抗虫基因导入到红麻根系中,靶向定位直接解决根结线虫。
大豆是中国重要粮食作物之一,已有五千年栽培历史,是一种其种子含有丰富植物蛋白质的作物,大豆蛋白质含量为35%~40%。大豆最常用来做各种豆制品、榨取豆油、酿造酱油和提取蛋白质。关于大豆根结线虫的预防,已有将抗虫基因转化大豆子叶诱导根系生成的技术,具体将包含目的基因的重组质粒转入发根农杆菌K599中,进行大豆子叶的遗传转化,最后诱导毛状根生成(王玲爽.大豆GmBIN2基因的克隆及功能分析[D] .东北农业大学.2018)。
目前,发根农杆菌转化大豆技术较为成熟,由于红麻和大豆相比用途不同,且种植面积和种植地点差异等导致红麻发根农杆菌转化组培实验还未开展。
为了解决红麻根结线虫病害问题,本发明提供了一种红麻快速发根的培育方法,该方法能够有效将红麻根结线虫抗性基因导入红麻,获得抗根结线虫的红麻植株,该方法能够节省大量的时间、人力和物力,提高工作效率。
本发明通过以下技术方案实现:
本发明提供一种红麻快速发根的培育方法,所述培育方法包括:
将HcNIR基因片段连接在过表达载体上,获得HcNIR基因过表达载体;
将所述HcNIR基因过表达载体转化发根农杆菌,后制备发根农杆菌菌液;
红麻种子萌发后,将其子叶进行切割,获得外植体;
将所述外植体伤口朝下置于培养基中进行预培养;
预培养结束后,将所述外植体浸泡在所述发根农杆菌菌液中,后取出,伤口朝上置于恢复培养基中,进行黑暗培养;
黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养,获得带根系的外植体;
其中,所述HcNIR基因片段的核苷酸序列如SEQ ID NO .1所示。
所述HcNIR基因片段编码白蛋的氨基酸序列如SEQ ID NO .2所示。
进一步的,所述将HcNIR基因片段连接在过表达载体上,获得HcNIR基因过表达载体,具体包括:
将HcNIR基因片段连接在过表达载体PHG上,获得HcNIR基因过表达载体PHG?HcNiR。
进一步的,所述将所述HcNIR基因过表达载体转化发根农杆菌,后制备发根农杆菌菌液,具体包括:
采用冻融法将所述HcNIR基因过表达载体转化至发根农杆菌A4感受态细胞,获得含有HcNIR基因的发根农杆菌;
将所述含有HcNIR基因的发根农杆菌进行培养,获得发根农杆菌菌液。
进一步的,所述红麻种子萌发后,将其子叶进行切割,获得外植体,具体包括:
将灭菌后的红麻种子置于萌发培养基中,放在环境温度为25℃,光周期为16/8h(明/暗)的培养室中培养7?10d后,去掉种皮,将子叶切割成大小均一的矩形,获得外植体。
进一步的,所述将所述外植体伤口朝下置于培养基中进行预培养,具体包括:
将所述外植体伤口朝下置于恢复培养基中,在环境温度25℃,16h光照条件下,将外植体预培养1d。
进一步的,所述预培养结束后,将所述外植体浸泡在所述发根农杆菌菌液中,后取出,伤口朝上置于恢复培养基中,进行黑暗培养,具体包括:
预培养结束后,将所述外植体置于所述发根农杆菌菌液中浸泡15min,后取出吸干多余菌液,伤口朝上置于恢复培养基中,25℃黑暗条件下黑暗培养2~3d。
进一步的,所述黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养,获得带根系的外植体,具体包括:
黑暗培养结束后,将所述外植体伤口朝下置于根诱导培养基中培养7?10d,获得带根系的外植体。
基于同一发明构思,本发明提供一种红麻植株,所述红麻植株通过上述一种红麻快速发根的培育方法制备。
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
1.本发明一种红麻快速发根的培育方法,该方法将红麻HcNIR基因重组子转入到发根农杆菌感受态,制备出发根农杆菌菌液,切割红麻子叶作为外植体,再将带目的基因的发根农杆菌菌液转化红麻外植体,最后进行生根培养,该方法抗根结线虫基因的转化效率高,转化后经统计成功转化植株占总数的93%以上,红麻的生长周期为半年以上,本发明直接用红麻发根的快速培育方法,节省了大量的时间,人力,物力,还能提高工作效率,准确的将抗红麻根结线虫基因导入到根中,快速筛选得到抗根结线虫的红麻过表达植株。
2.本发明一种红麻快速发根的培育方法,该方法经过前期筛选符合红麻转化的发根农杆菌感受态,然后对红麻发根培养的组培条件的探索,培养基及抗生素的配比的研究得到适合红麻种子的生长培养,切割子叶后的恢复培养以及生根培养条件,为制备红麻抗根结线虫的转基因植株做好基础,制备出的红麻转基因植株制备优异的抗根结线虫性能。
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
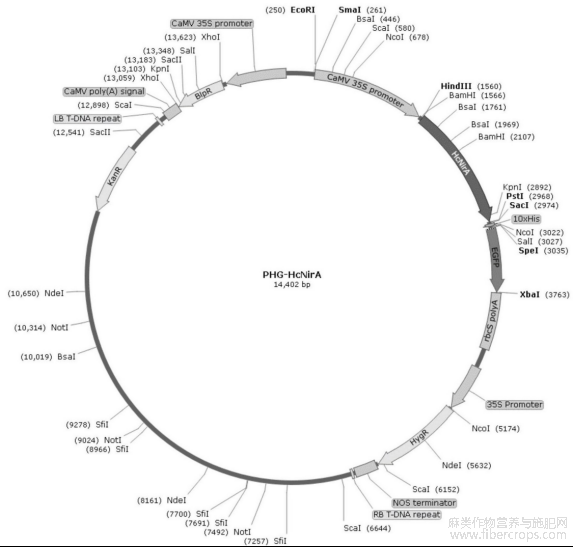
图1为HcNIR基因过表达载体PHG?HcNiR质粒图谱。
图1
图2为本发明红麻快速发根的培育试验照片。
图2
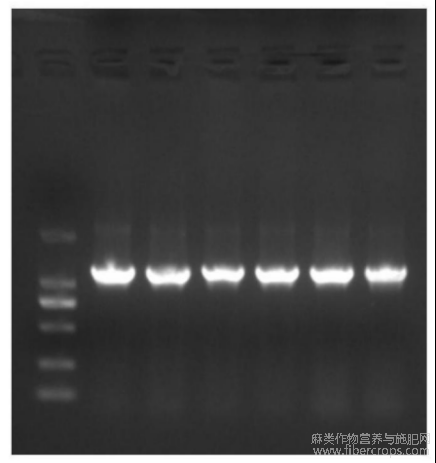
图3为转基因红麻根中HcNIR基因PCR验证图谱。
图3
图4为将重组子转入发根农杆菌并转化红麻子叶后在发根培养基上培养10d后的照片。
图4
图5为未导入发根农杆菌的红麻子叶外植体在发根培养基上培养10d后的照片。
图5
具体实施方式
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
下面将结合实施例及实验数据对本申请一种红麻快速发根的培育方法进行详细说明。
实施例1
本实施例一种红麻快速发根的培育方法。
1.总RNA的提取、反转录cDNA
1.1总RNA的提取
1)加液氮研磨粉碎红麻叶片材料。每50~100mg材料加入1mlTRIZOL(材料体积应小于TRIZOL体积的10%),振荡或用移液器打至无大颗粒。
2)悬液在室温放置5分钟,使核酸-蛋白复合物彻底分解。加入0.2ml氯仿/mlTRIZOL(起始),用手剧烈振荡15秒,15~30℃放置2~3分钟。12,000rpm,2~8℃,离心15分钟。
3)吸出无色上清,加入0.5ml异丙醇/mlTRIZOL(起始),15~30℃放置10分钟。12,000rpm,2~8℃,离心10分钟。
4)75%乙醇洗涤(>1ml乙醇/mlTRIZOL),7,500rpm,2~8℃,离心5分钟。
5)室温放置10?20分钟干燥(briefly,彻底干燥会降低RNA溶解度),加入经DEPC处理的H2O,55~60℃,10分钟。每100mg叶片可以获得100~200μg总RNA。
1.2RT?PCR反应
采用东洋纺公司的ReverTraRTKit(FSQ?101,TOYOBO)
1)10μl反转录反应体系:
加入不含核酸酶的水补足至10μl;
2)反应条件为:在37℃条件下,进行15分钟的逆转录反应;
在98℃条件下,进行5分钟的酶失活反应;
4℃保温5min;
反应结束后,加入不含核酸酶的水80μl稀释,稀释后的cDNA溶液可放?20℃长期保存,若经常使用,需分装成若干小管保存,经常冻融不利于cDNA的稳定。
2.PCR,构建载体
2.1高保真酶PCR反应:构建质粒
2.1.120μlPCR反应体系:
2μl10×缓冲液
2μl2mMdNTPs
2μlDNA模板(红麻叶片提取的cDNA)
1μlDMSO
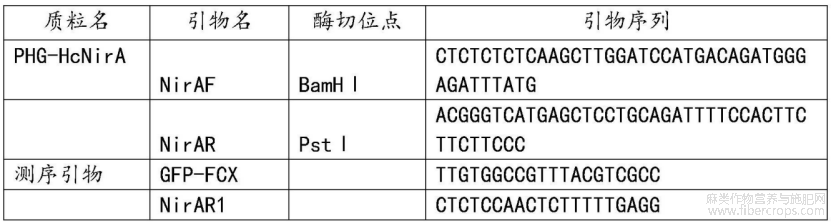
0.8μl10pmol/μl上、下游引物(见表1中NirAF和NirAR)
0.5UkodDNA聚合酶(KOD?401,TOYOBO)
加水补足20μl。
其中,涉及的引物如表1所示:
表1
2.1.2PCR扩增程序:
94℃预变性4min;
94℃变性30s,50~64℃退火30s,68℃延伸1min/kb,45个循环;
68℃保温8min。
2.2DNA电泳,回收与酶切:
2.2.1电泳:
每个反应管中加入适量10×上样buffer,在1%?3%(10ulEB,1~3g琼脂糖/100ml0.5×TBE缓冲液)的琼脂糖凝胶上进行电泳。在0.5×TBE缓冲液中以5~10V/cm进行电泳,结束电泳,在凝胶成像系统中拍照。
2.2.2琼脂糖凝胶DNA回收(GK2042,捷瑞生物):
1)将DNA目标条带小心割下,放入1.5mlEP管中。
2)向管中加入400ul的bandingB,放入70℃水浴中,直到凝胶完全溶解。
3)向管中加入100ul的异丙醇,室温放1分钟,5000rpm离心1分钟过柱。
4)重复步骤3
5)加500ulwashbuffer12000rmp洗两次,10000rmp离心1分钟。
6)向柱中加入40ul双蒸水,37℃放置2分钟,12000rmp离心1分钟收集。
2.2.3酶切:
40μl酶切体系:
质粒pHG?HcNiR(30ul)
4μl10×酶切缓冲液
4μl10×BSA(加或不加参考说明书)
6U限制性内切酶(NEB)
加水补足40μl
在37度水浴处理1h左右。
2.3质粒构建步骤:
PCR片段经琼脂糖凝胶回收后,与酶切回收的空载体混合,加入EasyGenoDNA重组体系连接(#VI201?02,天根生物),10ul重组体系如下:
5ul2×EasyGenoAssemblyMix
2.5ul酶切载体DNA
2.5ul片段DNA
将反应体系加入250ulEP管中,放50℃水浴30分钟后转化大肠杆菌涂板,放37℃培养箱16小时后,挑菌,送测序,测序正确的提质粒放在?20℃长期保存,质粒图谱如图1所示。
2.4质粒的提取
2.4.1普通碱法小量抽提大肠质粒DNA
接种一单菌落于3ml含适当抗生素的LB液体培养基中,37℃,200rpm振荡培养过夜;取1.5ml培养物(低拷贝质粒取3ml),12,000rpm离心30秒;吸尽上清液,悬浮菌体于100μl溶液Ⅰ(Glucose50mmol/L,EDTA10mmol/L,Tris?HCl25mmol/L,pH8.0)中;加入200μl新鲜配制的溶液Ⅱ(NaOH0.2mol/L,SDS1%),立即轻轻上下混匀;加入150μl溶液Ⅲ(KAc5mol/L,pH4.8),快速上下混匀,室温放置5分钟;12,000rpm,离心10分钟;转移上清至另一离心管,加入2倍体积的乙醇,混匀;12,000rpm离心10分钟;去上清,70%乙醇洗涤DNA沉淀,12,000rpm离心1分钟,去除上清;真空干燥沉淀;溶于60μl含10μg/mlRNaseA的双蒸水中。
3.重组子转化发根农杆菌:
(1)发根农杆菌we感受态细胞的制备:
1)将发根农杆菌A4活化,挑取单菌落于1.5mLYEP液体培养基中,28℃,200rpm,震荡过夜;
2)取1.5mL活化的菌液接种于50mLYEP培养基中,28℃,180rpm,震荡至OD600为0.40?0.60;
3)冰浴30min,并随时震荡混匀并在低温4℃下5500rpm离心8?10min,弃上清;
4)用10mL预冷的0.1MNaCl溶液重悬细胞,低温4℃下5500rpm离心8?10min,弃上清;
5)用1mL预冷的20mM的CaCl2溶液重悬细胞,将菌液分装成每管100μL(30%甘油),液氮速冻后?80℃保存。
(2)冻融法转化发根农杆菌感受态细胞:
1)重组质粒提取;
2)取5μL质粒,加入100μL发根农杆菌感受态细胞中,轻弹管底混匀;
3)冰浴30min,液氮速冻2?3min,37℃水浴锅热激5min后迅速放在冰上冰浴3?5min;
4)向离心管中加入500?600μLYEP液体培养基,放在28℃,180rpm摇床中振荡培养2h;
4.红麻毛状根的诱导
(1)培养基成分
1)萌发培养基:40g/L含琼脂和蔗糖的MS培养基,1mg/L6?BA,1?2g琼脂,pH=5.8;
2)恢复培养基:40g/L含琼脂和蔗糖的MS培养基,1?2g琼脂,250mg/LCef,pH=5.6。
3)根诱导培养基:40g/L含琼脂和蔗糖的MS培养基,1?2g琼脂,250mg/LCef,植物组培抗菌剂PPM作用浓度为0.05%?0.2%,pH=5.6。
(2)发根农杆菌菌液的制备
挑取含有目的基因的发根农杆菌菌液,涂于含有Kanacine的发根固体培养基(或者是YEP固体培养基)上,28℃倒置培养2d。挑取单菌落接种于含有50mg/mL Kanacine的发根液体培养基(或者是YEP液体培养基)中,28℃220rpm震荡培养16h。取菌液1:100进行二次活化,当菌液达到OD600=0.8时,收集菌体于50mL无菌离心管中,低温4℃4000rpm离心10min。用0.1mM/LMgCl2的溶液重悬,作为转化用菌液。
(3)毛状根的诱导
在无菌操作台中将饱满的红麻种子用75%酒精消毒5分钟,再倒入次氯酸钠(分析纯)液体消毒20分钟,灭菌水冲洗3?5次;将灭菌过的红麻种子种在萌发培养基中,放在环境条件为25℃,光周期为16/8h的培养室中培养7?10d后,去掉种皮,用无菌刀切子叶成大小均一的矩形0.5~0.7cm,伤口朝下,放于恢复培养基上,25℃,16h光周期条件下,将外植体预培养1d。第2天时,将外植体放入至准备好的发根农杆菌的侵染菌液中,浸泡15min后,倒掉菌液,将外植体取出。使用无菌滤纸将外植体上多余的菌液吸干,伤口朝上,放于恢复培养基上。25℃黑暗条件下培养2~3d后,将外植体伤口朝下放于到根诱导培养基上培养一周到十天即可见到根的生成。
如图2所述,A图为萌发培养基,B图为切割后的红麻子叶,C图为子叶外植体的恢复培养状态,D图为生根培养状态,E图为生根培养一周后状态,可见到根的生成,F图为生根培养三周后状态,可见到大量的再生根已布满发根培养基中。
用该方法对红麻HcNIR基因重组子转到发根农杆菌感受态,然后再将红麻种子灭菌,种到萌发培养基中,切割子叶后进行恢复培养,转化红麻外植体,最后进行生根培养,转化效率高,转化后经统计成功转化植株占总数的93%以上。红麻的生长周期要半年多,所以直接用红麻发根的快速培育方法,节省了大量的时间,人力,物力还能提高工作效率,准确的将抗红麻根结线虫基因导入到根中快速筛选得到抗根结线虫的红麻过表达植株。以转基因红麻根中的DNA为模板,用表1中的测序引物GFP?FCX和NiRAR1进行PCR反应,结果如图3,获得近1500bp跑胶图,条带位置大小正确。
图4为将重组子转入发根农杆菌并且转化红麻子叶在发根培养基上培养10天后的效果图,可见子叶外植体有再生根生成。
图5为将未导入发根农杆菌的红麻子叶外植体放入本发明发根培养基上培养10天后的效果图,可见子叶外植体并无再生根生成。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。