摘 要:汉麻CsNAC56转录因子在调控植物抗逆性中的应用,属于汉麻的抗逆性研究技术领域。所述应用为:在汉麻体内将CsNAC56转录因子表达量增高,以提高汉麻对非生物胁迫的耐受性。与水处理相比,在NaHCO<subgt;3</subgt;胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高11倍;在甘露醇胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高6倍;在NaCl胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高9倍。本发明明确CsNAC转录因子在不同胁迫反应中的功能,为抗逆分子育种提供基因资源;丰富汉麻NAC转录因子参与非生物胁迫的分子调控网络。
权利要求
1.汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:所述应用为:在汉麻体内将CsNAC56转录因子表达量增高,以提高汉麻对非生物胁迫的耐受性。
2.根据权利要求1所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:与水处理相比,在NaHCO3胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高11倍;在甘露醇胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高6倍;在NaCl胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高9倍。
3.根据权利要求1所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:所述应用中,过表达GFP-CsNAC56载体的构建具体为:
步骤一:GFP载体单酶切
为了将CsNAC56基因插入到SmaI酶切位点处,将GFP载体用BsaI/Eco31I限制性内切酶进行双酶切,将酶切产物进行胶回收后,获得GFP载体的线性化产物,-20℃保存备用;
步骤二:CsNAC56基因克隆
从NCBI网上获得CsNAC56基因的片段序列,引物设计为GFP-CsNAC56-F:GGAGAGAACACGGGGGACTTTGCAAC-ATGGAGAGCACCGACTCCTC,GFP-CsNAC56-R:CCACTCCCTGAAGCGGCCGCTGTACA-TGAATACCAGTGCATTCCGGGC;分别在CsNAC56基因的5’端和3’端加上GFP载体在BsaI/Eco31I酶切位点接头,以汉麻的cDNA为模板,按照PCR反应体系,获得同源融合的胶回收片段;
步骤三:目的片段与GFP线性化载体的连接
将步骤二得到的加完同源接头的CsNAC56基因胶回收产物和步骤一得到的经过BsaI/Eco31I双酶切的GFP线性化产物,按照In-Fusion连接体系,50℃反应15分钟,然后将连接产物放-20℃保存备用或者直接用于转化。
4.根据权利要求3所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:步骤一中,BsaI/Eco31I双酶切体系由4.0μL质粒、2.0μL 10×Buffer J(promega)、1.0μL BsaI/Eco31I、13μL dd H2O组成。
5.根据权利要求3所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:步骤二中,所述PCR反应体系包括2.0μL 10×PCRbuffer、2μL dNTP Mix(2mM)、1.0μLCsNAC56-F(10μM)、1.0μL CsNAC56-R(10μM)、0.4μL KOD(5U/μL)、0.8μL MgSO4(25mM)、0.1~0.2μg cDNA,并使用dd H2O补足至20μL;反应程序为94℃5min循环1次,94℃30sec循环30次,50℃45sec循环30次,72℃71sec循环30次,72℃10min循环1次,16℃30min循环1次。
6.根据权利要求3所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:步骤二中,所述In-Fusion连接体系包括0.2~0.4μg GFP vector(Sma I)、1.5μLCsNAC56胶回收片段、5μL 2×Assembly Master Mix,并使用ddH2O补足至10μL。
7.根据权利要求1所述的汉麻CsNAC56转录因子在调控植物抗逆性中的应用,其特征在于:所述应用中,酵母双杂交Bait表达载体(pGBKT7-CsNAC56)的构建具体为:
步骤一:带有载体同源序列的CsNAC56基因的扩增
根据CsNAC56基因的序列,设计构建Bait表达载体引物;以pROK2-CsNAC56质粒为模板,pGBKT7-CsNAC56-F和pGBKT7-CsNAC56-R为引物,利用PCR的方法引入pGBKT7质粒线性化末端的同源互补序列;pGBKT7-CsNAC56-F:5’-CATGGAGGCCGAATTCATGGAGAGCACCGACTCCT-3’,pGBKT7-CsNAC56-R:5’-GCAGGTCGACGGATCCTTATGAATACCAGTGCATTCC-3’;
步骤二:pGBKT7质粒双酶切
使用限制性内切酶EcoRI和BamHI进行双酶切,酶切反应体系包括2.0μL 10×BufferE、1.0μgpGBKT7质粒、1.0μL EcoRI(12U/μL)、1.0μLBamH I(10U/μL)、0.2μL BSA,超纯水补足体积至20μL,反应条件:37℃,6h;通过电泳检测双酶消化的结果,并通过凝胶回收试剂盒回收消化的质粒,并对凝胶回收结果进行电泳以确定浓度;
步骤三:CsNAC56基因与pGBKT7载体(双酶切后的质粒)的连接反应
使用In-Fusion连接体系,In-Fusion连接体系具体为0.2~0.4μgpGBKT7 vector(SmaI)、1.5μL CsNAC56胶回收片段、5μL 2×Assembly Master Mix,并使用dd H2O补足至10μL;反应条件:50℃,15min。
说明书
汉麻CsNAC56转录因子在调控植物抗逆性中的应用
技术领域
本发明属于汉麻的抗逆性研究技术领域,具体涉及汉麻CsNAC56转录因子在调控植物抗逆性中的应用。
背景技术
大麻(Cannabis sativa L.)是一年生草本植物,属于大麻科。大麻是最早的驯化农作物之一,是一种重要的经济植物,其茎中含有优质的纤维素,种子含有高质量的油以及花序含有有价值的树脂,从特种纸浆和纸张到营养食品,药品和化妆品,大麻茎,种子和花序可以衍生出多种产品。然而,曾经是重要的非粮食作物,用于生产纺织品和绳索,但由于与其他原料(如棉花和合成纤维)的竞争,大麻种植在20世纪逐渐减少。因此,培育纤维产量高、抗性强的汉麻品种已成为研究的热点。
植物依靠复杂的信号通路来有效防御外部威胁,同时保持增长的平衡。转录因子(TFs)在控制植物发育的各种过程以及对外界刺激的反应中形成了主要的调控因子。植物中约有58个转录因子家族,其中NAC转录因子是植物特有的一类转录因子(王婉妮等,2022),通常,在NAC家族的转录因子中,保守的NAC域由五个子域组成,其中有三个高度保守的A,C和D子域以及两个不同的B和E子域。除了与DNA结合外,NAC结构域还通过与其他包含NAC结构域的蛋白质相互作用来参与核定位以及同二聚体和异二聚体的形成。
TRR区域(transcriptional regulation region)位于NAC蛋白的C端,其序列是高度可变的,与转录激活活性调控的多样性密切相关。遗传学研究表明,NAC转录因子在植物中具有重要的生物学功能,例如叶片衰老,次级代谢以及对各种环境胁迫的反应(Crameret al 2011;Nakashima et al 2012;Puranik et al 2012;刘涛等,2022)。Tran等报道从拟南芥中克隆的ANAC019,ANAC055和ANAC072在增强转基因植物的抗旱性中起重要作用(Tran etal.,2004)。因此,越来越多的研究探索了NAC家族应对各种非生物胁迫的功能。同时有研究表明,NAC和MYB家族的几类转录因子参与控制厚壁细胞形成的各个步骤(Zhu etal.,2014)。NAC基因VND6(VASCULAR-RELATED NAC DOMAIN6)和VND7分别抑制了拟南芥初生根中次生木质部及初生木质部脉管的形成(Kubo et al.,2005)。其他两个拟南芥NAC基因NST1(NAC SECONDARY WALL THICKENING PROMOTING FACTOR1)和NST2能够调节次生壁增厚,这是花药开裂过程中气孔破裂所必需的(Mitsuda et al 2005)。拟南芥基因SND1(SECONDARY WALL-ASSOCI-ATED NAC DOMAIN PROTEIN1)被证明是调节纤维中次生壁合成的关键转录开关(Stracke et al 2001)。
发明内容
本发明的目的是为了解决汉麻在面对非生物胁迫时耐受性差的问题,提供一种汉麻CsNAC56转录因子在调控植物抗逆性中的应用。
为实现上述目的,本发明采取的技术方案如下:
汉麻CsNAC56转录因子在调控植物抗逆性中的应用,所述应用为:在汉麻体内将CsNAC56转录因子表达量增高,以提高汉麻对非生物胁迫的耐受性。
进一步地,与水处理相比,在NaHCO3胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高11倍;在甘露醇胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高6倍;在NaCl胁迫下,控制CsNAC56转录因子在汉麻体内表达量至少增高9倍。
本发明相对于现有技术的有益效果为:本发明明确CsNAC转录因子在不同胁迫反应中的功能,为抗逆分子育种提供基因资源;丰富汉麻NAC转录因子参与非生物胁迫的分子调控网络。
附图说明
图1为GFP载体图谱;
图2为大肠杆菌菌液PCR电泳图,其中M:DNA Marker DL2000 1-8、检测的大肠杆菌菌液PCR产物;
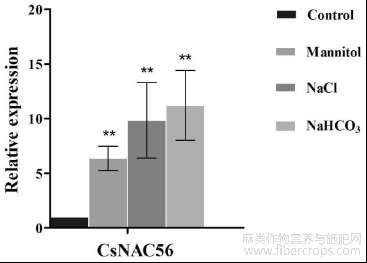
图3为CsNAC56表达模式分析图;
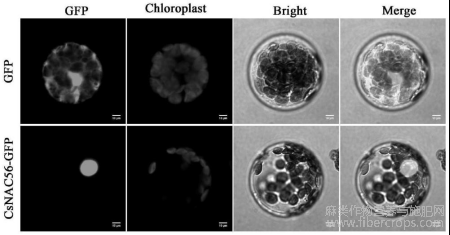
图4为CsNAC56亚细胞定位图;
图5为CsNAC56转录自激活验证图。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1
本发明以汉麻NAC转录因子CsNAC56为研究对象,分别在不同的非生物胁迫下研究其表达模式,并且利用原生质体瞬时转化技术及酵母双杂交技术探讨其分子特性。
本实施例所使用的植物材料为汉麻2号,培养至快速生长期时,在28℃环境和16/8h光/暗循环中生长,相对湿度为70-75%。
一、非生物胁迫下CsNAC56基因的在汉麻叶中的表达模式
利用水、300mM Mannitol(甘露醇)、100mM NaHCO3和200mM NaCl依次浸泡汉麻幼苗,于处理24h对叶子进行取样,液氮速冻,-80℃保存用于提取RNA,利用TRIzol试剂(Invitrogen)提取总的RNA;使用ReverTra Ace qPCR RT Master Mix with gDNA Remover(TOYOBO)反转录。使用Bio-Rad Chromo4 real-time PCR系统进行实时定量PCR。
反应混合液含有2×SYBR Green Realtime PCR Master Mix(Toyobo)12.5μl,上下游引物0.5μM,cDNA模板2μl(相当于100ng的RNA),dd H2O补足至总体积为25μl。反应条件为:94℃,30s;45循环:94℃,12s;58℃,30s;72℃,30s。最后80℃,1s。汉麻Actin1作为内参标准化数据。相对表达水平利用2-△△CT方法计算(Livak et al.,2001)。CsNAC56在水处理下的表达水平设为1,其它的处理相应进行计算。每一个样品进行三次独立的生物学重复,每次进行三次技术重复。所有的引物显示在表1中。
表1实时定量PCR引物序列
二、过表达GFP-CsNAC56载体的构建
(1)GFP载体单酶切
如图1所示,图1为载体图,将基因融合到过表达载体上,为了将CsNAC56基因插入到SmaI酶切位点处,将GFP载体用BsaI/Eco31I限制性内切酶进行双酶切,按照BsaI/Eco31I双酶切体系,将酶切产物进行胶回收后,获得GFP载体的线性化产物,-20℃保存备用。所述BsaI/Eco31I双酶切体系由4.0μL质粒、2.0μL 10×Buffer J(promega)、1.0μL BsaI/Eco31I、13μL dd H2O组成。
(2)CsNAC56基因克隆
从NCBI网上获得CsNAC56基因的片段序列,引物设计如表2所示,分别在CsNAC56基因的5’端和3’端加上GFP载体在BsaI/Eco31I酶切位点接头,以汉麻的cDNA为模板,按照PCR反应体系,获得同源融合的胶回收片段。所述PCR反应体系包括2.0μL 10×PCR buffer、2μLdNTP Mix(2mM)、1.0μL CsNAC56-F(10μM)、1.0μL CsNAC56-R(10μM)、0.4μL KOD(5U/μL)、0.8μL MgSO4(25mM)、0.1~0.2μg cDNA,并使用dd H2O补足至20μL;反应程序为94℃5min循环1次,94℃30sec循环30次,50℃45sec循环30次,72℃71sec循环30次,72℃10min循环1次,16℃30min循环1次。
表2:GFP-CsNAC56载体构建的CsNAC56基因引物设计
(3)目的片段与GFP线性化载体的连接
将上述步骤(2)得到的加完同源接头的CsNAC56基因胶回收产物和步骤(1)得到的经过BsaI/Eco31I双酶切的GFP线性化产物,按照In-Fusion连接体系,50℃反应15分钟,然后将连接产物放-20℃保存备用或者直接用于转化。所述In-Fusion连接体系包括0.2~0.4μg GFP vector(Sma I)、1.5μL CsNAC56胶回收片段、5μL2×Assembly Master Mix,并使用dd H2O补足至10μL。
(4)连接产物转化大肠杆菌及鉴定
将上步获得的连接产物加入到大肠杆菌感受态细胞当中,经过热击转化后在含有50mg/L卡那霉素的LB固体平板上进行筛选,筛选出的单菌落进行菌液PCR检测。检测用CsNAC56的基因引物(表2)和GFP的载体引物(表3)。检测成功的克隆,将菌液送北京华大基因进行测序验证。
表3:GFP-CsNAC56构建的载体引物设计
为了确认GFP-CsNAC56载体序列是否正确,选取2个样品以GFP F/R为引物提交给华大基因有限公司测序部进行测序,经序列比对发现测序结果与CsNAC56基因的DNA序列完全相同,表明此植物表达载体已经构建成功。
(5)拟南芥原生质体转化
步骤一:25℃左右培养25-30d拟南芥幼苗(未抽薹)。
步骤二:取苗若干,加入5-10mL酶解液(Cellulase R10 0.15g、Mecerozyme R100.04g、D-mannitol 0.728g、200mM KCl 100μL、200mM MES1mL、1M CaCl2 100μL、BSA100μL),全部浸泡组织为宜。24℃静置酶解4h。MES指的是2-吗啉乙磺酸;
步骤三:40μm滤网过滤后300rpm离心3min,去上清。
步骤四:用4℃预冷W5溶液(154mM NaCl 10mL、125mM CaCl2.H2O 12.5mL、5mM KCl250μL、2mM MES1mL)10mL洗涤2次,300rpm离心3min,离心温度4-25℃均可。
步骤五:根据需要加入500μL MMG溶液(150mM MgCl2 1mL、200mM MES200μL、Mannitol 0.728g)悬浮,(每个样品(2×105个/ml),用100μL原生质体)。镜检:40倍镜下,每个视野20-40个左右。
步骤六:取100μL原生质体悬液+20μL DNA(步骤(4)得到)(500ng以上的纯化质粒,共定位额外加10μL Marker共转),取与DNA和原生质体体积之和相等的PEG4000溶液(120μL),轻柔均匀混合,室温静置30min。
步骤七:用1mL的W5稀释终止反应(稀释转化混合液,然后轻柔颠倒摇动离心管使之混合完好以终止转化反应)。300rpm离心3min收集原生质体,去上清。
步骤八:加入1mL W5洗涤1-2次。最后加入1mL W5溶液,28℃暗培养18-24h。
步骤九:去上清,只留100μL左右的原生质体,荧光显微镜或者激光共聚焦显微镜观察。
三、酵母双杂交Bait表达载体(pGBKT7-CsNAC56)的构建
(1)带有载体同源序列的CsNAC56基因的扩增
根据CsNAC56基因的序列,设计构建Bait表达载体引物(PCR反应体系及反应程序参见过表达GFP-CsNAC56载体的构建中的参数)。
以pROK2-CsNAC56质粒为模板,pGBKT7-CsNAC56-F和pGBKT7-CsNAC56-R为引物,利用PCR的方法引入pGBKT7质粒线性化末端的同源互补序列。
表4设计构建pGBKT7表达载体引物
引物名称 引物序列
pGBKT7-CsNAC56-F <![CDATA[5’-<u>CATGGAGGCCGAATTC</u>ATGGAGAGCACCGACTCCT-3’]]>
pGBKT7-CsNAC56-R <![CDATA[5’-<u>GCAGGTCGACGGATCC</u>TTATGAATACCAGTGCATTCC-3’]]>
注:下划线代表载体同源序列
(2)pGBKT7质粒双酶切
使用限制性内切酶EcoRI和BamHI进行双酶切,酶切反应体系包括2.0μL 10×Buffer E、1.0μg pGBKT7质粒、1.0μL EcoRI(12U/μL)、1.0μL BamH I(10U/μL)、0.2μL BSA,超纯水补足体积至20μL,反应条件:37℃,6h;
通过电泳检测双酶消化的结果,并通过凝胶回收试剂盒回收消化的质粒,并对凝胶回收结果进行电泳以确定浓度。
(3)CsNAC56基因与pGBKT7载体(双酶切后的质粒)的连接反应
使用In-Fusion连接体系,In-Fusion连接体系具体为0.2~0.4μg pGBKT7 vector(SmaI)、1.5μL CsNAC56胶回收片段、5μL 2×Assembly Master Mix,并使用dd H2O补足至10μL。反应条件:50℃,15min。
(4)连接产物的大肠杆菌转化和鉴定
将上述步骤获得的连接产物转化到大肠杆菌感受态细胞DH5α中,在LB固体平板上(含有50mg/L卡那霉素)进行筛选,挑取单菌落进行菌液PCR检测。检测用CsNAC56的基因引物(表4)。检测到成功的克隆,将菌液送至北京华大基因进行测序验证。
四、双杂交研究CsNAC56及缺失片段转录激活活性
(1)酵母感受态细胞制备
步骤一:将Y2H酵母菌在YPDA固体培养基上划线,并在30℃培养箱中培养2-3d,在10mLYPDA液体培养基中挑取单个克隆并摇动过夜(30℃,220rpm);
步骤二:取步骤一得到的10μL菌液置于50mLYPDA液体培养基中,震荡培养约18h,直至OD600达到0.4-0.5;
步骤三:将步骤二得到的菌液置于50mL无菌的离心管中,室温下1000g离心10min,弃去上清液,将下层细胞重悬于30mL无菌去离子水中;
步骤四:离心,沉淀细胞,弃去上清液,用1.5mL的1.1×TE/LiAc重悬细胞,将悬浮液分装到2mL离心管中;
步骤五:高速离心15s,弃去上清液,用600μL的1.1×TE/LiAc重悬菌体,置于冰上,感受态细胞制备完成。
(2)酵母细胞的小量转化
步骤一:取两个预先冷却的1.5mL离心管(一个pGBKT7-CsNAC56实验组,一个pGBKT7对照组),按体系加入:
Y2H感受态细胞50μL
pGBKT7-CsNAC56(or pGBKT7)100ng
变性鲱鱼精DNA(10μg/μL)5μL
轻柔混匀;
步骤二:向混合体系中加入500μLPEG/LiAc,充分混匀,在30℃下水浴30min(每隔10min混匀一次);
步骤三:加入DMSO 20μL,混匀,42℃水浴15min(期间每隔5min混匀一次);
步骤四:高速离心15s,弃上清,1mLYPD Plus Medium重悬菌体;
步骤五:30℃,200rpm震荡培养30min;
步骤六:高速离心15秒,弃去上清液,将菌体重悬于1mL0.9% NaCl溶液中;
步骤七:涂平板:将100μL的菌液涂布到直径为90mm的SD/-Trp上,并在30℃下培养3-5d。
步骤八:平板生长出单克隆后,挑菌于SD/-Trp液体培养基,待菌浑浊后,调整OD值为1,点点于SD/-Ade/-His/-Trp/X-α-Gal培养基上,30℃倒置培养3-5d,检测Bait自激活活性。
(3)重组pGBKT7载体转化到酵母Y2H细胞中
将上述步骤(4)连接产物的大肠杆菌转化和鉴定中构建好的含有不同缺失片段的pGBKT7重组载体转化到上述(1)制备的酵母细胞Y2H中,转化方法同(2)酵母细胞的小量转化,点点于SD/-Trp/-His/-Ade/X-α-Gal平板上,30℃倒置培养3-5d,观察结果。
五、结果与分析
(1)表达模式分析
为研究CsNAC56是否响应非生物胁迫,利用水、300mM Mannitol、100mM NaHCO3、和200mM NaCl处理汉麻幼苗,水处理为对照。利用qRT-PCR来研究CsNAC56基因的表达。如图3所示,CsNAC56可以响应多种非生物胁迫,在NaHCO3处理下,其表达量最高,是水处理的11倍;在甘露醇及NaCl处理下的表达量分别是对照处理的6倍及9倍。以上结果表明在叶中CsNAC56能够积极响应多种非生物逆境胁迫,很可能在不同逆境途径的交叉信号途径中发挥作用。
(2)CsNAC56的亚细胞定位分析
为了进一步确定CsNAC56转录因子在细胞中的定位,通过原生质体瞬时转化,在显微镜下观察定位情况。如图4所示,35S驱动的GFP蛋白在整个表皮细胞中都有表达,而CsNAC56蛋白只在细胞核中表达,因此,该蛋白定位于细胞核。
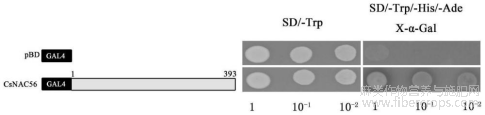
(3)CsNAC56转录自激活活性验证
为验证CsNAC56是否具有转录自激活活性,将CsNAC56 CDS的完整序列克隆到pGBKT7载体中(图5)。然后将不同的构建体转化到Y2H酵母细胞中并检测它们的转录激活活性。所有转化体在SD/-Trp培养基上生长良好,表明这些构建体已成功转化为Y2H细胞。在含有X-α-Gal的SD/-Trp/-His/-Ade培养基上,携带CsNAC56(氨基酸1-393)的全长CDS的细胞是蓝色的(图5右下角),表明CsNAC56的完整CDS具有转录激活能力。
(4)结论
通过对CsNAC56表达模式、亚细胞定位及转录自激活活性分析发现,该基因定位于细胞核,CsNAC56能够不同程度的响应非生物胁迫,并且全长具有转录自激活活性,能够作为转录因子发挥功能。
本发明构建的过表达GFP-CsNAC56载体在大肠杆菌中转化,对所得菌液进行测序得到以下两个序列
序列1
>gene-LOC115706270 CsNAC56
MESTDSSAGSQQLQNHHQPNLPPGFRFHPTDEELVVHYLKKKVISAPLPVSIIAEVDLYKFDPWELPAKATFGEQEWYFFSPRDRKYPNGARPNRAATSGYWKATGTDKPVLTSGGSQKVGVKKALVFYGGKPPKGIKTNWIMHEYRLAENKAINKPPPGCDLGNKKNSLRLDDWVLCRIYKKNNTNRAVMDHERDQEAMEELLGPMNSNNHNHNHSHNNIPVPHPMGPHNGKLQLLLPKAATLLNYGALNENDHNLFDGMLSNDHANINSNTTNTTNNASLLLPPSSNMSLKRSLIHGLYWPNEIVDDEEAAAAGPLSSSSSKRLQLDDSCTAATTTTSMGEGNQSTSIASLLSQLPNQTASLHQQTMLGALGGSDGLFRGSYQLPGMHWYS*
序列2
>LOC115706270 CsNAC56
ATGGAGAGCACCGACTCCTCCGCCGGTTCCCAACAATTACAGAATCATCATCAGCCAAACCTCCCGCCAGGGTTCCGCTTCCATCCGACCGACGAGGAGCTCGTGGTTCACTATCTCAAGAAGAAGGTTATCTCAGCTCCTCTCCCTGTTTCTATCATCGCCGAAGTCGATCTATACAAGTTTGATCCATGGGAGCTTCCAGCTAAGGCGACGTTTGGAGAACAGGAGTGGTACTTTTTCAGTCCACGAGATCGGAAGTATCCGAACGGAGCCAGGCCCAATCGGGCGGCGACGTCCGGGTACTGGAAGGCAACTGGCACGGATAAGCCTGTATTAACTTCTGGAGGATC
TCAGAAGGTCGGCGTTAAAAAGGCGCTCGTCTTCTATGGCGGTAAACCTCCGAAAGGGATTAAAACCAATTGGATTATGCACGAATACAGACTCGCTGAAAACAAAGCCATAAACAAACCTCCTCCAGGTTGCGATTTGGGCAACAAGAAAAACTCTCTCAGACTTGATGATTGGGTACTGTGTCGAATCTACAAGAAGAACAACACGAATAGGGCAGTGATGGATCACGAGAGGGATCAAGAAGCGATGGAGGAGTTGTTGGGGCCAATGAACAGCAATAATCATAATCACAATCACAGTCATAATAATATTCCAGTACCTCATCCGATGGGCCCACATAATGGCAAGC
TACAACTACTACTACCAAAGGCGGCGACACTACTAAATTATGGGGCGTTGAACGAAAATGACCACAACCTGTTCGATGGAATGCTAAGCAATGATCATGCCAATATTAATAGCAATACAACAAATACTACTAACAATGCTTCACTGCTCTTGCCACCTTCTTCAAATATGTCCCTCAAACGCTCACTCATTCACGGTCTTTACTGGCCCAACGAGATTGTGGACGATGAAGAAGCAGCGGCTGCTGGGCCCTTATCGTCTTCCTCAAGCAAAAGACTGCAACTGGATGATAGTTGTACGGCCGCCACAACGACCACCTCGATGGGCGAGGGAAATCAATCGACTTCAATAGCCTCACTGCTTAGCCAGCTCCCGAACCAAACGGCGTCGTTGCACCAACAGACAATGCTCGGAGCATTGGGGGGATCTGATGGGCTATTCCGGGGATCTTATCAATTGCCCGGAATGCACTGGTATTCATAA
摘自国家发明专利,发明人:边境、张晓艳、田媛、孙凯旋、肖湘、王晓楠、赵越、高宇、王云云、孙宇峰,申请号:202311487666.X,申请日:2023.11.09