摘 要:苎麻是中国特有的韧皮纤维作物,炭疽病是苎麻重要病害之一,影响苎麻纤维产量和品质。 试验采用植物病原真菌传统分离法,对采自湖北省、湖南省和江西省苎麻主产区感染炭疽病的苎麻叶片进行炭疽病病原菌的分离,并通过对病原菌形态特征观察、致病性测定、核糖体内部转录间隔区序列(internal transcribed spacers,ITS)和 β-微管蛋白序列(β-tubulin,TUB2)的克隆和分析,对引起苎麻炭疽病的病原进行鉴定。 经形态学和分子生物学结合分析,确定引起我国苎麻炭疽病的病原主要有胶孢炭疽菌(Colletotrichum gloeosporioides)、果生炭疽菌(C. fructicola)、暹罗炭疽菌(C. siamense)和希金斯炭疽菌(C. higginsianum)。 根据新的炭疽菌种的分类方法,苎麻炭疽病病原分属于胶孢炭疽菌复合群(C. gloeosporioides complex) 和毁灭炭疽菌(C. destructivum com?plex)复合群。 研究结果为研究苎麻炭疽病菌的生物学特性、流行规律以及苎麻抗炭疽病分子育种研究和有效绿色防治策略提供理论依据。
关键词:苎麻;炭疽病;刺盘孢属;病原分离;病原鉴定
苎麻(Boehmeria nivea L. Gaud)是荨麻科(Urticaceae)苎麻属(Boehmeria)多年生宿根性纤维作物,在我国有着悠久的种植历史。 我国苎麻种质资源和遗传多样性丰富,种植面积和原料产量在世界上处于优势地位[1]。 苎麻炭疽病是苎麻上经常发生的主要病害之一,给苎麻生产带来严重的经济损失[2]。 该病害在我国长江流域以南各省麻区均有发生,发病率达 20% ~40%,感病后叶片上产生典型病斑进而影响作物生长,发病严重的麻园纤维产量减产达 l0%以上[3],并且刮制后的原麻有红褐色斑点,极大影响苎麻纤维的品质[4]。 长期以来,我国苎麻在种质资源创新与鉴定、品种筛选、育种与繁育技术研究[5-8]以及基于 UAV-RGB 遥感系统估算苎麻产量等方面均取得重大进展[9-10],但在苎麻炭疽病病害及其病原菌的研究方面还比较薄弱。 1914 年日本学者 Sawada 在中国台湾首次对该病菌进行分离和形态学观察,并将苎麻炭疽病菌命名为 C. boehmeriae Sawada(以寄主来源和其名字命名)[11-12]。 二十世纪八九十年代,我国苎麻研究专家对苎麻炭疽病的症状及各个生育期病害发生的特点、侵染源、发生规律等进行了系统性研究,提出了苎麻炭疽病的防治措施,为苎麻炭疽病害的防治提供了指导[3-4, 13-14]。 至今,国内外关于苎麻炭疽病病原菌的研究报道仍较少。 在以往苎麻炭疽病的田间调查、病害防治、苎麻品种抗性检测和对苎麻炭疽菌的研究报道中,根据寄主来源和发现者命名的“Colletotrichum boehmeriae Sawada”一直作为苎麻炭疽病菌的病原,但其不能说明苎麻炭疽菌真正的病原和分离地位。 准确鉴定引起苎麻炭疽病的病原菌是研究病菌生物学特性、发生规律和开展病害防治的基础。
本研究通过采集苎麻炭疽病感病的叶片,采用传统组织分离法进行病原真菌的培养和分离,依据病菌的形态学特征、致病性测定、分子生物学和形态学结合的方法对引起苎麻炭疽病的病原菌进行鉴定,旨在明确引起苎麻炭疽病的病原菌。
1 材料与方法
1.1 试验材料
从湖北省武汉市华中农业大学苎麻材料圃、湖北省咸宁市苎麻基地大田、中国农业科学院麻类研究所苎麻材料圃(湖南长沙)和江西省宜春市农科所苎麻材料圃等地,采集症状典型的苎麻炭疽病病叶,用于病原菌的分离。
1.2 试验方法
1.2.1 病菌分离与纯化
应用常规植物病原菌的分离法进行病菌的分离[15-16]。 在无菌操作台上,切取病健交界处约2 mm×2 mm 的病组织,先用灭菌水冲洗干净,再用 75%酒精消毒 1 min,5%次氯酸钠消毒 3 min,最后用无菌水冲洗 3 遍,将消毒好的病组织置于 PDA 平板上,28 ℃下暗培养 3~4 d。 待菌落长出后,重复纯化 2~3 次。 将分离的菌株保存在 PDA 平板中,4 ℃储存备用。
1.2.2 致病性检测
分生孢子液接种:选取新鲜健康的苎麻叶片(华苎 4 号),放入铺有吸水纸的盘中摆放整齐,吸水纸经灭菌水滋润。 在每个叶片上滴加分生孢子液,每片叶片接 10 处,每处接种 6 μL ( 1 ×106 个/ mL),3 个重复,以清水作为对照组,用保鲜膜封盘并置于 28 ℃ 恒温培养箱中 12 h 光暗交替培养,连续观察 10 d,记录叶片发病情况。
菌丝块接种:叶片选取同以上分生孢子液接种。 PDA 平板上活化好的菌落用打孔器( d =6 mm)打取菌丝块。 将菌丝块面朝下接种到叶片上,每片叶片接 5 ~ 6 个菌丝块,3 个重复,清水作为对照,培养条件和观察方法同分生孢子液接种。 叶片发病后从病斑上再次分离病原菌,比较再分离菌株与接种菌株的一致性,完成柯赫氏法则的验证。
1.2.3 病原菌的鉴定
形态学鉴定:将菌丝块接种到 PDA 平板上,在 28 ℃培养箱里黑暗培养,3 d 后观察并记录菌落特征,主要包括菌落颜色、形态和生长情况。 在显微镜下观察分生孢子、附着胞及孢子梗的形态,用显微镜及标尺测量分生孢子的大小,并计算分生孢子的长宽比例,查阅真菌分离鉴定工具书,初步判定病菌的种类。
分子生物学鉴定:采用 CTAB 法提取病原菌 DNA,用真菌核糖体内部转录序列 ITS 通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[17]、β-微管蛋白基因( β -tubulin,TUB2) 的 PCR 扩增引物 T1 ( 5’-AACATGCGTGAGATTGTAAGT - 3’) 和βt2b (5’-ACCCTCAGTGTAGTGACCCTTGGC-3’)[18]对目的基因区域进行 PCR 扩增。 将 PCR 产物纯化后进行 T 载体的连接和大肠杆菌的转化,并对质粒进行测序。 将所测得的序列在 NCBI 网站(http: / / www.ncbi.nlm.nih.gov)进行同源性比较,以近缘菌株构建系统发育树,确定其分类地位。
2 结果和分析
2.1 苎麻炭疽病的田间症状
根据苎麻炭疽病田间症状观察,从我国 3 个省份(湖北、湖南、江西)主要苎麻产区采集具有苎麻炭疽病症状的叶片。 对田间症状和采集的叶片进行观察,发现苎麻炭疽病主要症状包括:染病叶片呈现典型的圆形病斑,病斑直径 1~3 mm,病斑边缘黑色,中央褐色,可扩展,严重的呈中间凹陷坏死症状(图 1-A~ C);叶片上具有大量小圆斑症状,病斑直径<1 mm,病斑中央灰白色,边沿深褐色,扩展有限(图 1-D);叶片上具有大量小圆斑症状,病斑直径<1 mm,可扩展成片(图 1-E);叶片上具有黑色大斑,直径>5 mm,病斑扩展成片(图 1-F)。
2.2 苎麻炭疽病病原菌致病性测定结果
本试验共分离 89 个菌株,选取形态有差异且能在 PDA 培养基上直接产生或者切断菌丝后能诱导产生橘红色分生孢子的 23 个菌株进行致病性测定。 先采用分生孢子接种法对菌株的致病性进行测定,结果显示,菌株大致有强致病性、弱致病性和无致病性 3 类(图 2)。 23 个菌株中有4个菌株可以引起“华苎 4 号”发病,其中,强致病性菌株占总测试菌株的 61%。 强致病性菌株接种叶片 3 d 后,叶片上接种点开始出现病斑,随着培养时间的延长病斑变大,扩大成片,最后整个叶片
退绿,腐烂(图 2-A1~A4);第二类弱致病性菌株,接种叶片 3 d 后出现病斑,随着培养时间的延长,坏死部位没有继续恶化,10 d 后叶片仍然完好(图 2-B1 ~ B4);第三类菌株接种后叶片没有受感
染,叶片表面未见任何病斑(图 2-C1~ C4 )。
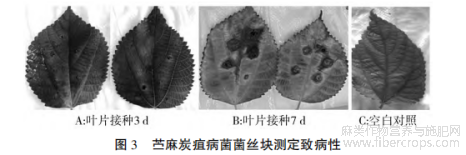
将致病性强的菌株用菌丝片法再次进行致病性检测。 结果显示,接种 3 d 后接种处开始发病,初为褐色斑点(图 3-A),接种 7 d 后病斑颜色加深并扩展为圆形,有的病斑连成片导致叶片腐烂(图 3-B)。 从病组织再分离的病原菌与接种用的菌株形态上一致。
2.3 苎麻炭疽病菌的形态特征及分类地位
2.3.1 形态学鉴定结果
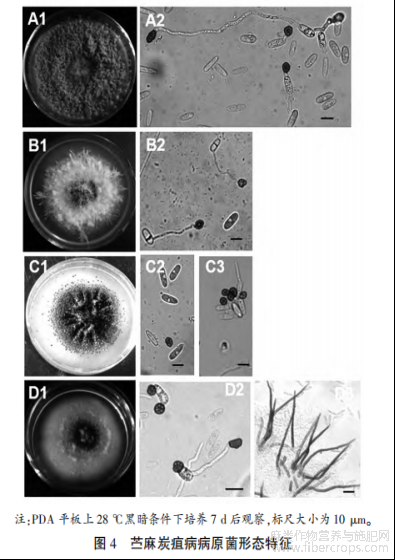
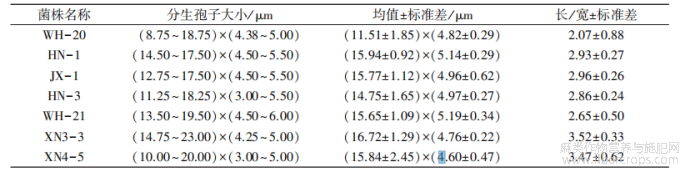
苎麻炭疽病菌在 PDA 培养基上菌落呈圆形,菌落边缘整齐。 菌丝匍匐状,稀疏至茂密,大部分菌株菌丝最初为白色,随着培养时间的延长慢慢变为淡灰色,有的是褐色、墨绿色(图 4-A1、B1、C1、D1)。 分生孢子橘红色,有的点状分布,有的成片分布,分生孢子单胞,无色透明,卵圆形,有的内含油球(图 4-A2、B2、C2、C3、D2)。 有的菌株具黑色或者褐色刚毛,有分隔,顶端尖锐(图 4-D3)。 分生孢子梗簇生或单生,无色或淡褐色,直或弯曲,具分隔,基部略膨大。 菌丝有隔,直径2.55~3.83 μm,平均 3.01 μm。 孢身大小及孢子长宽比例见表 1。 查阅真菌鉴定手册,根据病菌形态特征,初步判定苎麻炭疽菌病原为胶孢炭疽菌 C. gloeosporioides(胶孢炭疽菌刚毛少,分生孢子圆筒形,(11~18)μm×(4~6)μm)和希金斯炭疽菌 C. higginsianum(希金斯炭疽菌分生孢子盘上有刚毛数根,分生孢子长椭圆或圆筒形,两端钝圆,无色,单胞,(15~21)μm×(3.0~5.5)μm)。
表1 苎麻炭疽菌代表性菌株分生孢子大小测定
2.3.2 分子生物学鉴定结果
选取具有正常致病力且经过柯赫氏法则验证的 14 个菌株进行 ITS 基因克隆和测序,将分离菌株的测序结果在 GenBank 中进行 BLAST 比对。 比对结果显示,菌株与胶孢炭疽菌 C. gloeospori?oides、果生炭疽菌 C. fructicol、暹罗炭疽菌 C. siamense 和希金斯炭疽菌 C. higginsianum 的同源性达97% ~99%(Accession number:FJ515005、FJ459930、HM016798、AB042317.1、GU935872.1)。 而且序列比对中发现,C. gloeosporioides、C. fructicola、C. siamense 和 C. higginsianum 这 4 类植物炭疽菌病原的 ITS 序列本身同源性高达 99%,单通过 ITS 基因无法将菌株鉴定到种。
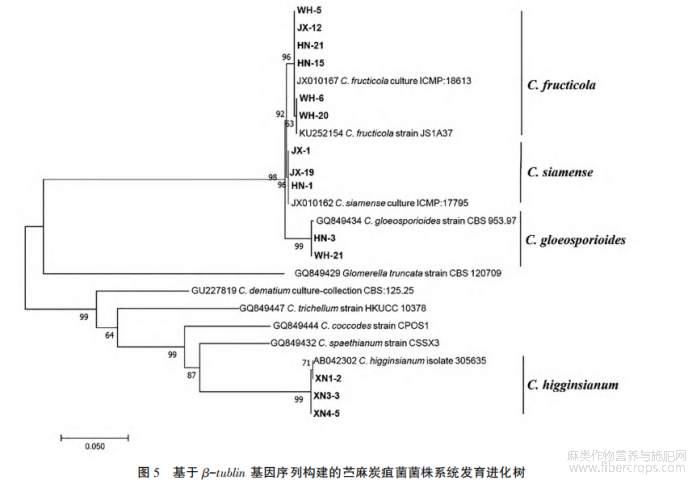
进一步对测试菌株进行 β-tubulin 基因的克隆。 表 2 中列举了菌株的来源和 β-tubulin 基因在NCBI 上的登录号。 将分离菌株的 β-tubulin 基因测序结果在 GenBank 中进行 BLAST 比对,查找相似物种的 β-tubulin 序列,使用 MEGA 7.0 最大似然法对相似性较高的菌株及同属不同种菌株进行分子系统发育分析(图 5)。 结果显示,从湖南采集的菌株中鉴定出 3 个炭疽菌属的病菌:C. fructi?cola、C. siamense 和 C. gloeosporioides;湖北武汉的材料中包括种 C. fructicola 和 C. gloeosporioides;江西的菌株中,并未分离到 C. gloeosporioides,分离的菌株为 C. fructicola 和 C. siamense。 采自湖北咸宁的材料,通过 β-tubulin 比对,与人参生刺盘孢 C. panacicola 和希金斯炭疽菌 C. higginsianum 的同源性都为 99%,而这两个病原菌属于 C. destructivum species complex 复合群,所以分子序列上同源性很高。 真菌鉴定手册记载希金斯炭疽菌 C. higginsianum 分生孢子盘上有刚毛数根,分生孢子圆筒形,(15~21)μm×(3.0~5.5)μm。 本试验中分离自咸宁的菌株其分子孢子特性(图 4-D1~ D3,表 1)与 C. higginsianum 的描述一致,再结合分子检测的结果,判定分离自咸宁的菌株属于 C. hig?ginsianum。
表2 基于 β-tubulin 基因的系统发育分析所用菌株信息
3 讨论与结论
苎麻炭疽病由植物炭疽菌属(Colletothrichcum spp.)真菌引起。 该属真菌是一类全球性分布的重要植物病原菌,被列为全球第八大植物病原真菌[19]。 目前已报道约 176 属 190 余种植物可被炭疽菌侵染[20]。 炭疽菌类真菌命名方式和系统分类方法发生过数次重大的变更,存在种间性状交叉和系统发育关系不清的问题。 1831—1957 年,其分类依据主要以寄主范围为主,即只要从一种尚未报道的寄主上分离获得该属真菌,即被视为新种。 该时期至少 750 个新种被描述,导致许多物种同物异名。 Von Arx 发现该属真菌分类混乱,依据分生孢子和产孢细胞等显微形态特征,并结合纯培养特征,将 750 多个种合并为 11 个种[21]。 Sutton 在 Von Arx 的分类基础上,于 1962—1992 年,以分生孢子和附着胞形态特征,结合纯培养物特征和寄主范围,把该属扩展到包含部分复合种的39 个种[22]。 2009—2019 年,Damm 等[23-24]分别对存在争议的种的混乱问题又进行整理。 目前,炭疽菌属共包括 14 个复合种,其中 C. gloeosporioides 复合种包括 38 个近似的物种[25],近年又扩展至22 个复合种[26]。
准确区分和鉴定病害的病原菌是制定病害有效防御策略的基础。 对病原真菌的鉴定,常以纯培养物上产生的分生孢子、附着胞、分生孢子梗和产孢细胞的形态和大小等特征进行形态学鉴定[27]。 对于特征明显的炭疽菌种采用形态学能够容易被鉴定出来,但是某些近似炭疽菌种却难以准确区分,比如 Liu 等[28]认为胶孢炭疽菌 C. gloeosporioides、暹罗炭疽 C. simense 和果生炭疽菌C. fruticola等一些近种,其菌落形态存在细微差异,单依据分生孢子形态和大小很难明显区分,并且一些菌株形态学特征不够稳定,易受培养条件的影响。 真菌的分子鉴定是从基因水平上反映菌株间遗传特性,DNA 序列特征不会随环境的改变而变化,特异性高,准确可靠,借助分子手段进行辅助鉴定可以弥补形态学鉴定的不足[29]。 除病毒以外,所有生物都具有核糖体基因转录间隔区(ITS 序列)区段的基因,该序列种间高度保守,可作为研究生物系统进化及分类的依据[30]。 另外基于胶孢炭疽菌 C. gloeosporioides 复合种的病原种类多,单选用 ITS 序列可能无法对小种进行有效的区分。 目前,基于多基因序列分析,将 ITS 基因、肌动蛋白基因(Actin gene,ACT)[30]和 β-微管蛋白基因(β-tubulin,TUB2)[31]、几丁质合成酶 A 基因( chitin synthase A gene,CHS1)等[32]序列进行联合分析用于炭疽菌的分子鉴定,能较好地区分炭疽菌属真菌的大部分种。
本研究对采集自我国苎麻主产区的苎麻炭疽病病株进行病原菌的分离,首先通过形态学对分离的病菌进行分析,初步判定引起苎麻炭疽病病原是刺盘孢菌属中的胶孢炭疽菌 C. gloeospori?oides。 通过对 ITS 序列的克隆发现胶孢炭疽菌 C. gloeosporioides、果生炭疽菌 C. fructicol、暹罗炭疽菌 C. siamense 和希金斯炭疽菌 C. higginsianum 4 类炭疽菌的 ITS 序列本身有很高的同源,甚至同源性达 99%,单通过 ITS 基因无法将菌株进行鉴定到种。 所以通过本研究可以推断 ITS 序列无法对引起苎麻炭疽病的病原菌鉴定到种。 进一步通过微管蛋白 β-tubulin 基因的克隆和肌动蛋白基因(Actin gene,ACT)(结果未显示)的克隆多基因联合分析,结果确定引起苎麻炭疽病的病原菌为胶孢炭疽菌 C. gloeosporioides[33]、果生炭疽菌 C. fructicola、暹罗炭疽菌 C. siamense 和希金斯炭疽菌C. higginsianum[34]。 微管蛋白 β-tubulin 基因的克隆和肌动蛋白基因(Actin gene,ACT)可以对苎麻炭疽菌进行小种间的鉴定。 依据新的炭疽菌种的分类方法,胶孢炭疽菌 C. gloeosporioides、果生炭疽菌 C. fructicola、暹罗炭疽菌 C. siamense 隶属于胶孢炭疽菌复合群 C. gloeosporioides complex,希金斯炭疽菌 C. higginsianum 属于毁灭炭疽菌 C. destructivum complex 复合群。
本研究对我国苎麻主产区湖北省、湖南省和江西省的苎麻炭疽病病原菌进行了分离和鉴定,为病菌生物学特性及其致病基因的研究奠定了基础。 鉴定出的 4 类病原菌在苎麻上引起病害的发生规律以及各苎麻生长地区中优势种群和病菌的致病基因、致病力分化、遗传多样性等还需要进一步研究和分析。 对病原菌进行基因组测序,利用生物信息学方法进行组学序列分析、基因功能注释和比较基因组学分析,是研究植物病原菌间基因变异重组、突变以及插入/ 缺失、遗传多样性、致病力分化机制的有效方法[35]。 全基因组分析已用于柑橘溃疡病菌、水稻稻瘟病菌、芽孢杆菌、芒果炭疽菌等多种病原菌的基因组分析。 大量病原菌全基因组测序及比较基因组研究文献和炭疽菌全基因组序列数据,将有助于苎麻炭疽菌基因组测序、组装和功能基因的预测。
参考文献
[1]白雪花,王延周,魏忆萍,等.298份苎麻种质资源纤维产量性状综合评价[J].植物遗传资源学报,2022,23(1):106-122.
[2]熊常财,曾粮斌,李景柱,等.苎麻主要病害的发生及防治[J].中国麻业科学,2012,34(5):220-225.
[3]李瑞明,马辉刚.苎麻炭疽病发生及防治研究[J].植物保护学报,1993(1):83-89.
[4]罗俊国.苎麻炭疽病病菌的培养性状和苎麻品种对炭疽病的抗性[J].湖北农业科学,1991(12):18-19.
[5]罗诗洁,曹晓兰.苎麻种质资源信息平台的构建[J].中国麻业科学,2022,44(2):73-79.
[6]付虹雨,王薇,廖澳,等.基于无人机遥感的苎麻优质种质资源筛选[J].智慧农业(中英文),2022:1-10.
[7]崔忠刚,吴文梅,杨燕,等.饲用苎麻新品种“川饲苎3号”的选育[J].养殖与饲料,2022,21(10):42-45.
[8]于娜,陈晓蓉,石亚亮,等.苎麻kinesin基因家族全基因组鉴定与表达分析[J].中国麻业科学,2022,44(1):13-26.
[9]FU H,WANG C,CUI G,et al.Ramie yield estimation based on UAV RGB images[J].Sensors (Basel),2021,21(2):669.
[10]CUI D,CUI G,YANG R,et al.Phenotypic characteristics of ramie (Boehmeria nivea L.) germplasm resources based on UAV remote sensing[J].Genetic Resources and Crop Evolution,2021,68(2):551-566.
[11]戴芳澜.外人在华采集真菌考[J].植物病理学报,1979(1):7-11.
[12]王绪霞,汤涤洛,刘立军.苎麻炭疽菌研究进展[J].中国麻业科学,2022,44(2):119-125.
[13]陈洪福.苎麻几种常见病害及其防治[J].中国麻作,1986(3):25-27.
[14]李瑞明,邓程振,曾永三,等.江西苎麻病害调查[J].江西植保,1987(2):22-23.
[15]王成彬,涂艳,姜宁,等.楸树炭疽病菌的分离与鉴定[J].植物病理学报,2022:1-5.
[16]方中达,许志纲.铁盐对水稻白叶枯病菌噬菌体的钝化作用[J].植物病理学报,1979(1):21-26.
[17]Kerry O,Elizabeth C.Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are Nonorthologous[J].Molecular Phylogenetics and Evolution,1997,7(1):103-116.
[18]JIAN Y,LI Y,TANG G,et al.Identification of Colletotrichum species associated with anthracnose disease of strawberry in Sichuan Province,China[J].Plant Disease,2021,105(10):3025-3036.
[19]Mansfield J,Genin S,Magori S,et al.Top 10 plant pathogenic bacteria in molecular plant pathology[J].Molecular Plant Pathology,2012,13(6):614-629.
[20]Da S L,Moreno H,Correia H,et al.Colletotrichum:species complexes,lifestyle,and peculiarities of some sources of genetic variability[J].Applied Microbiology and Biotechnology,2020,104(5):1891-1904.
[21]Von Arx J A.Die arten derguttung Colletotrichum[J].Phytopathol Z,1957,29:413-468.
[22]Sutton B C.Fungi imperfecti with pycnicia,acervuli and stromata[M].Surrey,England:Common Wealth Mycological Institute,1980:523-537.
[23]Damm U,Sato T,Alizadeh A,et al.The Colletotrichum dracaenophilum,C.magnum and C.orchidearum species complexes[J].Studies in Mycology,2019,92:1-46.
[24]Damm U,Sun Y,Huang C.Colletotrichum eriobotryae sp.nov.and C.nymphaeae,the anthracnose pathogens of loquat fruit in central Taiwan,and their sensitivity to azoxystrobin[J].Mycological Progress,2020,19(4):367-380.
[25]Jayawardena R S.Notes on currently accepted species of Colletotrichum[J].Mycosphere,2016,7(8):1197-1260.
[26]Vieira W,Bezerra P A,Silva A,et al.Optimal markers for the identification of Colletotrichum species[J].Molecular Phylogenetics and Evolution,2020,143:106694.
[27]LIU F,WANG M,Damm U,et al.Species boundaries in plant pathogenic fungi:a Colletotrichum case study.[J].BMC Evolutionary Biology,2016,16(1):81.
[28]LIU F,TANG G,ZHENG X,et al.Molecular and phenotypic characterization of Colletotrichum species associated with anthracnose disease in peppers from Sichuan Province,China[J].Scientific Reports ,2016,6:32761.
[29]Silva Rojas H V,Ávila Quezada G D.Phylogenetic and morphological identification of Colletotrichum boninense:a novel causal agent of anthracnose in avocado[J].Plant Pathology,2011,60(5):899-908.
[30]Khodadadi F,Gonzalez J B,Martin P L,et al.Identification and characterization of Colletotrichum species causing apple bitter rot in New York and description of C.noveboracense sp.nov[J].Scientific Reports ,2020,10(1):11043.
[31]WANG Y,CHEN J Y,XU X,et al.Identification and characterization of Colletotrichum species associated with anthracnose disease of Camellia oleifera in China[J].Plant Disease,2020,104(2):474-482.
[32]FU M,Crous P W,BAI Q,et al.Colletotrichum species associated with anthracnose of Pyrus spp.in China[J].Persoonia,2019,42:1-35.
[33]WANG X X,WANG B,LIU J L,et al.First report of anthracnose caused by Colletotrichum gloeosporioides on ramie in China[J].Plant Disease,2010,94(12):1508.
[34]WANG X X,CHEN J,WANG B,et al.First report of anthracnose on Boehmeria nivea caused by Colletotrichum higginsianum in China[J].Plant Disease,2011,95(10):1318.
[35]文增叶,李定华,代梦瑶,等.尖孢镰刀菌全基因组测序及其致病相关基因分析[J].基因组学与应用生物学,2020,39(3):1105-1112.
文章摘自:王绪霞,汤涤洛,彭洪翠等.苎麻炭疽病病原菌的分离与鉴定[J].中国麻业科学,2023,45(02):88-96.