摘 要:为了深入了解亚麻种质产量相关性状的遗传变异,以229份亚麻种质为材料,利用广义线性模型(GLM)和混合线性模型(MLM)的关联分析,以挖掘亚麻产量相关性状显著关联的SSR标记?结果表明,呼和浩特地区种植亚麻种质株高((58.40±5.67)cm)?单株果数((17.50±3.50)个)和单株粒质量((0.55±0.15)g)的平均值最大;在集宁地区分枝数((5.00±1.25)个)?果粒数((6.52±2.67)粒)和千粒质量((5.58±1.48)g)平均值最大?7个产量相关性状的表型变异系数为11.18%~18.29%?广义遗传力从大到小依次为千粒质量>果粒数>单株粒质量>株高>单株果数>分枝数>工艺长度?群体结构K=4时,229份亚麻种质分为4个群体?30对SSR引物共扩增出365条带,与亚麻7个产量相关性状进行GLM关联分析共检测到36个SSR标记,表型变异的解释率为1.15%(Lu146)~7.75%(Lu747);MLM关联分析共检测到23个SSR标记,表型变异的解释率为2.26%(Lu203a)~7.16%(Lu291)?在GLM和MLM下,单株粒质量?单株果数和分枝数同时检测到了Lu203a和Lua125a标记,分别分布在第12,2号染色体上?亚麻SSR标记能够很好地关联到产量相关性状,具有一定的解释率?
关键词:亚麻;产量;关联分析;SSR
亚麻(Linum usitatissimum L.)是我国特色油料作物,一般分为油用亚麻(胡麻)和纤维亚麻[1]?主要分布于我国华北?西北地区?亚麻对不同自然环境的适应能力较强,适合种植于我国北方地区干旱寒冷的生态区域?亚麻籽富含亚麻酸?木酚素?亚麻胶?膳食纤维等丰富的营养成分,有益于人体健康,可以制成多种保健食品[2]?
亚麻种质产量相关性状的表型鉴定及其关联的SSR标记的挖掘,对亚麻高产育种具有重要意义?近年来,众多学者以亚麻种质资源为研究对象,通过表型鉴定分析了亚麻产量相关性状的遗传变异?欧巧明等[3]对336份油用亚麻种质资源的6个主要农艺性状进行鉴定与评价,筛选出10份株高适中,单株分茎?分枝能力强,单株果数多,单株生产力高的品种?王利民等[4]应用主基因+多基因混合遗传分离分析方法,研究了单株产量?单株果数?千粒质量和每果粒数4个性状的遗传效应,结果表明,单株产量?单株果数?千粒质量的遗传效应相同?陈英[5]对341份亚麻种质资源的11个数量性状进行多元统计分析,发现亚麻分枝数的变异系数最大,成熟日数的变异系数最小?李秋芝等[6]通过亚麻核心种质农艺性状的遗传多样性分析,筛选出20份表现型较理想的资源材料?邓欣等[7]对535份亚麻材料的表型进行鉴定与评价,结果表明,亚麻种子产量与分枝数?分枝习性?单株茎质量?蒴果数?茎粗?分茎数?全生育日数?千粒质量呈正相关,与工艺长度?出麻率及开花日数呈负相关?
开发亚麻产量相关性状紧密连锁的遗传标记,对亚麻育种缩短周期?提高效率以及精准选育具有重要意义?产量相关性状易受环境影响,属于数量性状?关联分析是快速?准确定位目标性状基因的重要方法,是开发实用性分子标记的主要手段?Cloutier等[8]用30份EST-SSR引物对23份亚麻种质进行了遗传多样性分析?Wu等[9]采用简化基因组测序技术,在亚麻中开发出1574个SSR标记?Choudhary等[10]利用22个SSR标记的270个多态性位点与130份亚麻种质的26个表型性状进行关联分析,获得了95个显著关联位点?这些结果对亚麻种质SSR标记研究提供基础?
内蒙古自治区农牧业科学院胡麻课题组前期研究中通过对401份亚麻种质的表型和SRAP标记的评价,构建了229份亚麻核心种质的自然群体,在此基础上,本研究利用30对SSR引物对该核心群体进行基因型检测,旨在挖掘产量相关性状紧密关联的SSR标记,为亚麻遗传改良提供理论基础?
1材料和方法
1.1试验材料
供试材料为229份亚麻核心种质,其中110份为国内种质,分别来自6个亚麻主产区(内蒙古占10%?甘肃占18%?河北占6%?山西占6%?宁夏占5%?新疆占3%),119份为国外种质,分别来自9个国家(美国占9%?荷兰占8%?匈牙利占8%?加拿大占7%?法国占5%?巴基斯坦占5%?阿根廷占3%?伊朗占3%?俄罗斯占3%)?
1.2产量相关性状的测定与分析
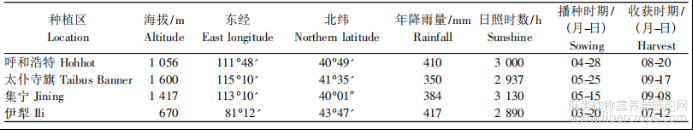
229份亚麻种质分别种植于内蒙古呼和浩特市(Hohhot,HS)?集宁区(Jining,JN)?锡林郭勒盟太仆寺旗(Ximeng,XM)?新疆伊犁州(Xinjiang,XJ)4个亚麻主产区,田间播种均采用随机区组设计,3次重复,每份种质材料种植3行,行长2.0m,行距0.20m,每行种子180粒?4个地区的地理位置?物候条件?播种和收获时期见表1?苗期,取2.00g新鲜嫩叶于-80℃冰箱保存备用?亚麻生理成熟后,试验小区随机取样20株,参照《亚麻种质资源描述规范和数据标准》[11],测定株高?工艺长度?单株果数?每果粒数?单株粒质量?种子千粒质量?分枝数等性状?
表1 4个种植区的地理位置?气候条件
1.3亚麻SSR-PCR扩增
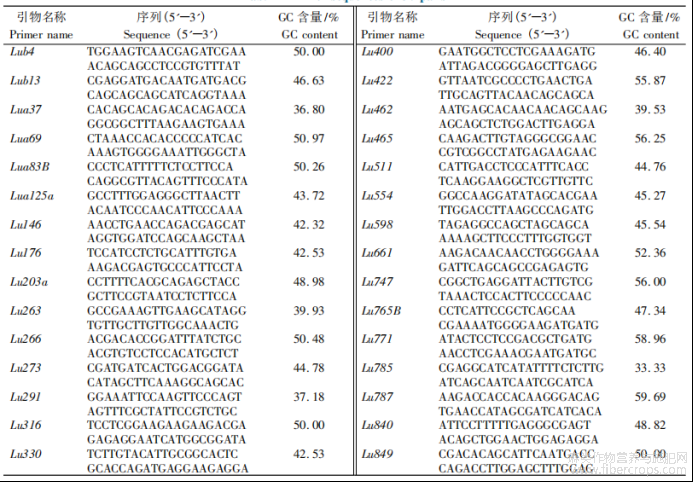
样品基因组DNA提取参照Stewart等[12]提出的CTAB法,检测合格之后于-20℃保存备用?利用本课题组前期筛选获得的30对SSR引物(表2),送上海生工生物工程技术服务有限公司合成,PCR反应体系和扩增程序与伊六喜等[13]优化程序一致?扩增产物用6%非变性聚丙烯酰胺凝胶电泳分离,恒功率70W电泳1.5h,采用银染法显色[14]?DNA Marker(1500)条带为对照标记种质之间基因型差异条带,标记为“0”或“1”,组成一个“1”和“0”的数据矩阵[15]?用POPGEN1.32计算有效等位基因数?引物多态性信息含量[16];用TASSEL5.0对表型数据和SSR分子标记数据进行广义线性模型(General linear model,GLM)和混合线性模型(MLM)的关联分析,得出P值?表型变异解释率?关联位点以及表型效应值数据?
表2 30对引物序列
2结果与分析
2.1亚麻产量相关性状的统计分析
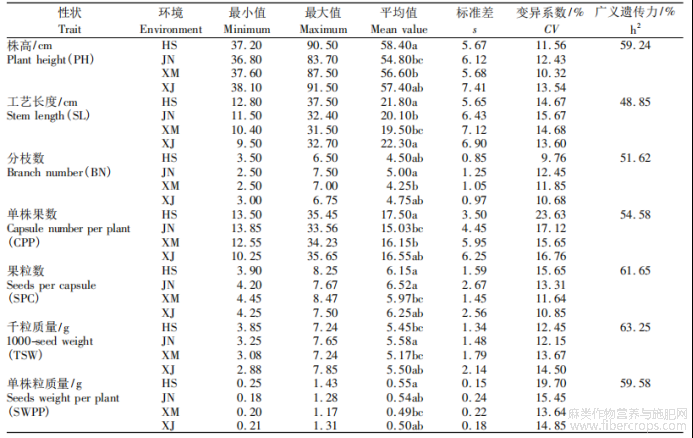
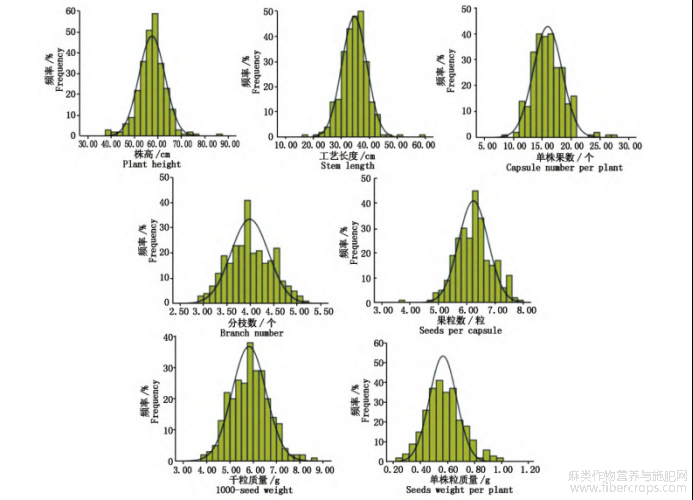
7个产量相关性状的统计分析结果表明,在4个环境下,株高平均值为(56.80±6.22)cm,其中呼和浩特地区平均值最大,为(58.40±5.67)cm;工艺长度平均值为(20.93±6.53)cm,其中新疆地区的平均值最大,为(22.30±6.90)cm;分枝数平均值为(4.63±1.03)个,其中集宁地区的平均值最大,为(5.00±1.25)个;单株果数平均值为(16.31±5.04)个,其中呼和浩特地区的平均值最大,为(17.50±3.50)个;果粒数平均值为(6.22±2.07)粒,其中集宁地区的平均值最大,为(6.52±2.67)粒;千粒质量平均值为(5.42±1.69)g,其中集宁地区的平均值最大,为(5.58±1.48)g;单株粒质量平均值为(0.52±0.20)g,其中呼和浩特地区平均值最大(0.55±0.15)g?7个产量相关性状的4个环境下的平均变异系数为11.18%~18.29%,其中分枝数变异系数最小(11.18%),单株粒质量的变异系数最大(18.29%)?在4个环境下千粒质量的广义遗传力最大(63.25%),工艺长度的广义遗传力最小(48.85%),7个产量相关性状的广义遗传力从大到小依次为千粒质量>果粒数>单株粒质量>株高>单株果数>分枝数>工艺长度(表3)?对7个产量相关性状的正态分布检验结果表明,所有性状基本呈现正态分布的趋势(图1),说明亚麻株高?工艺长度?单株果数?果粒数?单株粒质量?千粒质量?分枝数主要由基因型控制?
表3 不同环境下7个亚麻产量相关性状的统计分析
图1 229份亚麻品质(系)的7个产量相关性状的频率直方图
2.2亚麻产量相关性状的相关性分析
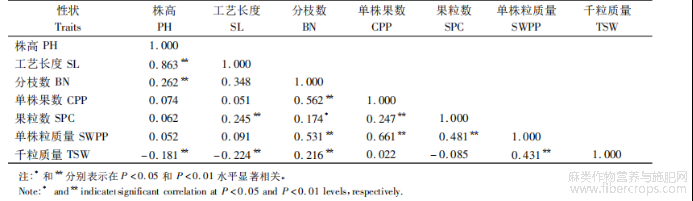
7个产量相关性状之间的相关性分析结果表明,除了工艺长度和千粒质量?千粒质量和株高之间呈极显著负相关,株高与工艺长度的相关系数最大,为0.863(表4),说明亚麻株高和工艺长度是密切相关的2个性状,在纤维亚麻中该特征更为明显,此结果与前期对401份亚麻材料的表型分析结果一致[17]?亚麻单株粒质量?单株果数?果粒数和千粒质量是影响亚麻单株产量的主要性状,本研究结果表明,亚麻单株粒质量与分枝数?单株果数和果粒数之间呈极显著正相关,说明单株果数?果粒数和千粒质量的增多,可以提高单株粒质量,其是亚麻单产直接相关的因素?千粒质量与株高和工艺长度呈极显著负相关(P<0.01),该结果进一步说明了纤维亚麻和油用亚麻之间的表型差异,纤维亚麻株高较高,但种子籽粒较小,而油用亚麻株高较矮,但种子籽粒大?
表4 亚麻7个产量相关性状间的相关性分析
2.3 SSR引物多态性分析
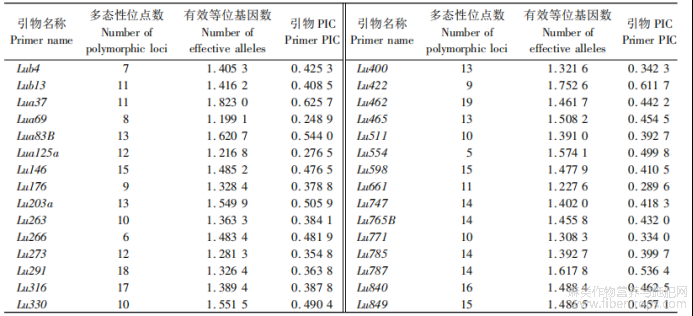
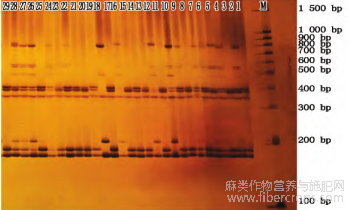
由表5可知,利用30对SSR引物在229份亚麻材料中共扩增出365条条带,平均每对引物扩增出12.17条条带,其中Lu462引物扩增的条带最多(19条),多态性位点在5~19,有效等位基因数在1.1991~1.8320,引物多态性含量为0.2489~0.6257,其中Lua37引物的多态性含量最高,为0.6257,其次为Lu422引物(0.6117),引物平均多态性含量为0.4322?本试验使用的SSR引物多态性好?条带清晰,以Lu661引物在29份亚麻种质上扩增结果为例(图2)?
表5 30对SSR引物在229份亚麻种质的扩增
图2引物Lu661在部分亚麻种质中的扩增
2.4遗传多样性分析
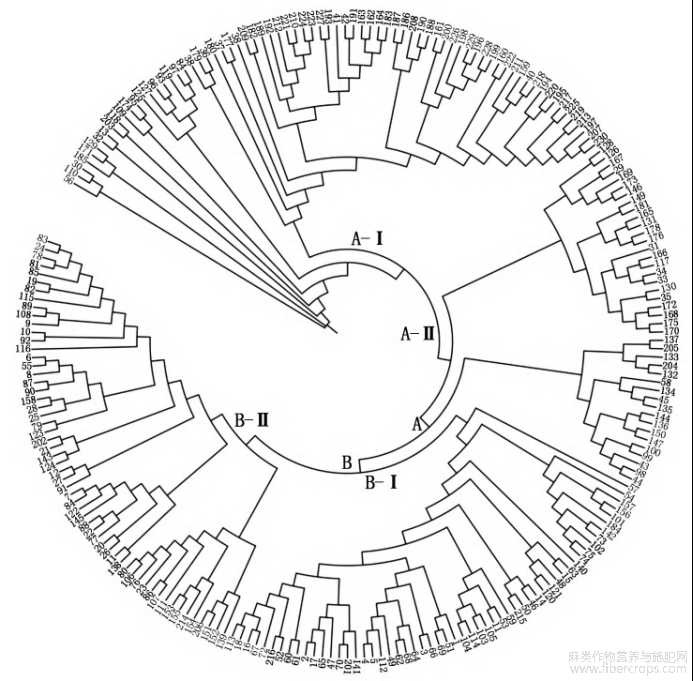
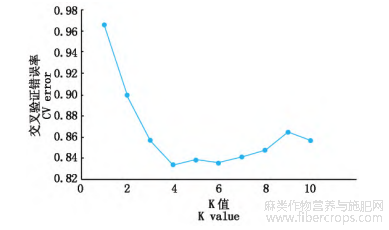
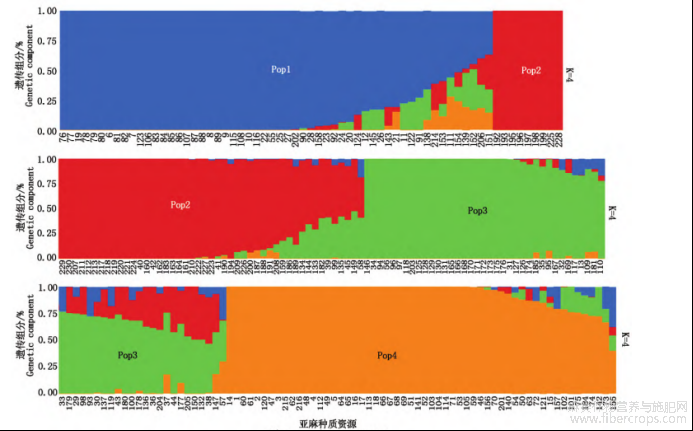
将229份亚麻种质划分为两大类群,分别表示为A和B(图3),其中,A群包括116份亚麻种质,其中国内种质33份,国外种质83份?该群分为2个亚群,第1个亚群(A-Ⅰ)包括74份亚麻种质,其中国内种质20份(内蒙古9份?甘肃5份?宁夏2份?新疆2份?山西1份?河北1份),占该亚群的27.02%;国外种质54份,占该亚群的72.98%?第2个亚群(A-Ⅱ)包括42份亚麻种质,其中国内种质13份(内蒙古8份?甘肃3份?河北1份?新疆1份),5期伊六喜等:亚麻主要产量相关性状的SSR关联分析57占亚群的30.95%;国外种质29份,占该亚群的69.05%?B群包括113份亚麻种质,其中国内种质87份,国外种质26份?该群分为2个亚群,第1个亚群(B-Ⅰ)包括56份亚麻种质,其中国内种质45份,占该亚群的80.35%;国外种质11份(加拿大3份?美国2份?法国2份?巴基斯坦2份?西德1份?匈牙利1份),占该亚群的19.64%?第2个亚群(B-Ⅱ)包括57份亚麻种质,其中国内种质42份,占该亚群的73.68%;国外种质15份(加拿大7份?美国3份?俄罗斯2份?匈牙利1份?法国1份?阿根廷1份),占该亚群的26.32%?从A和B这2个大类群国内外种质占比来看,基本能区分开?对229份亚麻种质的群体结构分析结果显示,当K=4时,ΔK的值出现显著峰值(图4),因此,当K=4时,分为4个群体,第1个群?第2个群和第4群均为56份种质,第3群为61份种质(图5)?
图3 229份亚麻种质的系统进化树
图4 ΔK随K值的变化曲线
图5 229份亚麻种质群体结构分析
2.5关联分析
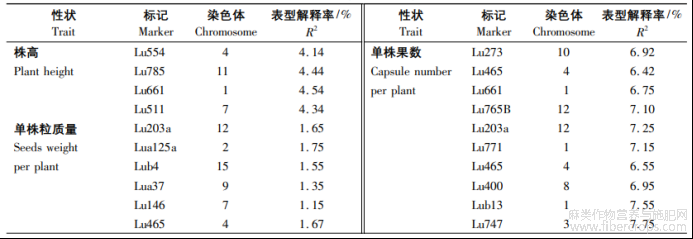
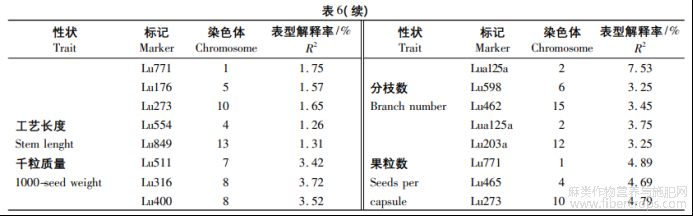
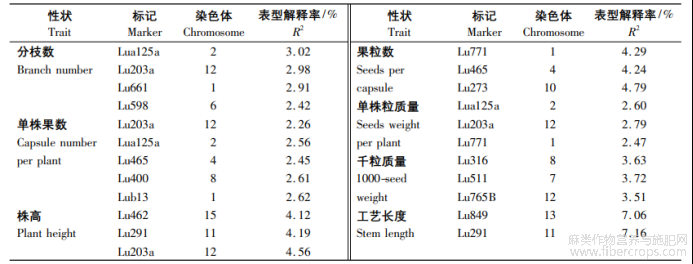
使用TASSEL5.0软件的广义线性模型(GLM)58华北农学报37卷和混合线性模型(MLM)程序,将每份种质的Q值作为协变量,对30个SSR标记分别与不同环境下检测到表型数据均值进行关联分析,检测目标性状显著(P<0.01)关联的标记?GLM和MLM的关联分析结果分别见表6,7,GLM下检测到了36个SSR标记,标记对性状表型变异的解释率为1.15%(Lu146)~7.75%(Lu747),平均为4.19%;MLM下检测到了23个SSR标记,标记对性状表型变异的解释率为2.26%(Lu203a)~7.16%(Lu291),平均为3.62%?在GLM和MLM下,单株粒质量?单株果数和分枝数同时检测到了Lu203a和Lua125a标记,分别分布在第12,2号染色体上。
表6 亚麻产量相关性状的GLM关联分析
表7 亚麻产量相关性状的MLM关联分析
3结论与讨论
亚麻是一种高度自花授粉作物,在高产育种技术上,仍沿用常规育种手段,能用的分子标记较少,导致育种周期长,选择效率低,品种更新换代缓慢?因此,通过亚麻种质资源产量相关性状的关联分析,挖掘实用性分子标记对亚麻遗传改良具有重要意义?关联分析研究中,种质资源的表型鉴定评价是最关键的一步,利用本课题组前期构建的229份亚麻核心种质材料[18],通过4个环境的表型鉴定分析结果表明,在呼和浩特地区种植的亚麻种质株高((58.40±5.67)cm)?单株果数((17.50±3.50)个)和单株粒质量((0.55±0.15)g)指标表现为最大;在集宁地区种植的亚麻种质分枝数((5.00±1.25)个)?果粒数((6.52±2.67)粒)和千粒质量((5.58±1.48)g)的指标表现为最大,说明不同种植环境对亚麻产量相关性状的影响较大?7个产量相关性状的变异系数为11.18%~18.29%,除千粒质量与株高和工艺长度呈极显著负相关外,其他性状之间相关性均为正相关?广义遗传力从大到小依次为千粒质量>果粒数>单株粒质量>株高>单株果数>分枝数>工艺度?基于SSR标记的遗传多样性分析结果表明,229份亚麻种质分为2个大群,国内外种质基本能区分开?此结果为亚麻种质资源收集保存和种质创新提供重要的参考信息?然而为了更好地服务亚麻育种,这些试验结果还需要多年多点的大田试验来进一步鉴定与评估?
近几年,亚麻SSR标记开发研究报道较多[19-20],但是这些成千上万标记真正应用于亚麻育种当中的寥寥无几,因此,亚麻种业发展需要更多种质资源的表型和基因型鉴定评价,并挖掘实用性分子标记?本研究筛选出30对SSR多态性引物,共扩增出365条条带,与亚麻7个产量相关性状进行关联分析,GLM下检测到了36个显著关联的SSR标记,MLM下检测到了23个SSR标记?其中Lu203a和Lua125a标记在2种模型下均关联到单株粒质量?单株果数和分枝数?通过亚麻参考基因组(https://www.ncbi.nlm.nih.gov/nuccore?LinkName)的比对,Lu203a(CCTTTTCACGCAGAGCTACC/GCTTCCGTAATCCTCTTCCA)标记分布在12号染色体上,Lua125a(GCCTTTGGAGGGCTTAACTT/ACAATCCCAACATTCCCAAA)标记分布在2号染色体上?前人对亚麻种质的SSR标记研究中大量使用了这2个标记[21-24],说明后期可以利用Lu203a和Lua125a标记辅助选择对应的目标性状,对亚麻遗传改良提供便利?
参考文献:
[1] Xie D W,Dai Z G,Yang Z M,Tang Q,Sun J,Yang X, Song X X,Lu Y,Zhao D B,Zhang L G,Su J G. Genomic variations and association study of agronomic traits in flax [J]. BMC Genomics,2018,19 (1):512.
[2] 祁惠芳,程子良,孔维宝,梁俊玉,王俊龙.亚麻籽有效成分的提取及其综合利用研究进展[J].中国油脂,2019,44(11):102—107.d
Qi H F,Cheng Z L,Kong W B,Liang J Y,Wang J L. Progress in extraction and comprehensive utilization of effective components in flaxseed[J]. China Oils and Fats, 2019,44(11):102—107.
[3] 欧巧明,叶春雷,李进京,陈军,崔文娟,厚毅清,王立光,李忠旺,罗俊杰.油用亚麻品种资源主要性状的鉴定与评价[J].中国油料作物学报,2017,39(5):623—633.
Ou Q M,Ye C L,Li J J,Chen J,Cui W J,Hou Y Q,Wang L G,Li Z W,Luo J J. Identification and evaluation of main breeding characteristics of oil flax resources[J]. Chinese Journal of Oil Crop Sciences,2017,39(5):623—633.
[4] 王利民,党占海,张建平,赵利,党照,赵玮.胡麻农艺性状与品质性状的相关性分析[J].中国农学通报,2013,29(27):88—92.
Wang L M,Dang Z H,Zhang J P,Zhao L,Dang Z,Zhao W. Correlation analysis between agronomic traits and quality traits in flax[J]. Chinese Agricultural Science Bulletin,2013,29(27):88—92.
[5] 陈英.胡麻种质资源数量性状的多元统计分析[J].中国油料作物学报,2016,38(6):730—736.
Chen Y. Multiple statistics of oil flax germplasm quantitative traits[J]. Chinese Journal of Oil Crop Sciences, 2016,38(6):730—736.
[6] 李秋芝,姜颖,鲁振家,曹洪勋,宋鑫玲,姜籽竹.300份亚麻种质资源主要农艺性状的鉴定及评价[J].中国麻业科学,2017,39(4):172—179.
Li Q Z,Jiang Y,Lu Z J,Cao H X,Song X L,Jiang Z Z. Identification and evaluation of main agricultural characteristics of 300 flax germplasm resources[J]. Plant Fiber Sciences in China,2017,39(4):172—179.
[7] 邓欣,邱财生,陈信波,龙松华,郭媛,郝冬梅,王玉富.亚麻农艺性状与产量形成关系的多重分析[J].西南农业学报,2014,27(2):535—540.
Deng X,Qiu C S,Chen X B,Long S H,Guo Y,Hao D M, Wang Y F. Multiple analysis of relationship of agronomic traits and yield formation in flax ( Linum usitatissimum L.) [J]. Southwest China Journal of Agricultural Sciences,2014,27(2):535—540.
[8] Cloutier S,Niu Z X,Datla R,Duguid S. Development and analysis of EST-SSRs for flax ( Linum usitatissimum L. ) [J]. Theoretical and Applied Genetics,2009,119(1):53—63.
[9] Wu D Z,Liang Z,Yan T,Xu Y,Xuan L J,Tang J,Zhou G,Lohwasser U,Hua S J,Wang H Y,Chen X Y,Wang Q,Zhu L,Maodzeka A,Hussain N,Li Z L,Li X M,Shamsi I H,Jilani G,Wu L D,Zheng H K,Zhang G P,Chalhoub B,Shen L S,Yu H,Jiang L X. Whole-genome resequencing of a worldwide collection of rapeseed accessions reveals the genetic basis of ecotype divergence[J]. MolecularPlant,2019,12(1):30—43.
[10] Choudhary S B,Sharma H K,Kumar A A,Maruthi R T, Mitra J,Chowdhury I,Singh B K,Karmakar P G. SSR and morphological trait based population structure analysis of 130 diverse flax ( Linum usitatissimum L. ) accessions[J]. Comptes Rendus Biologies,2017,340(2):65—75.
[11] 王玉富,粟建光.亚麻种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
Wang Y F,Li J G. Description specification and data standard of flax germplasm resources[M]. Beijing: China Agricultural Publishing,2016.
[12] Stewart C N,Via L E. A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications[J]. BioTechniques,1993,14(5):748—750.
[13] 伊六喜,萨如拉,王树彦,李志伟,斯钦巴特尔,李强.亚麻木酚素含量的SSR关联分析[J].华北农学报,2021,36(1):63—70.
Yi L X,Sa R L,Wang S Y,Li Z W,Si Q B T,Li Q. SSR correlation analysis of linseed lignan content[J]. Acta Agriculturae Boreali-Sinica,2021,36(1):63—70.
[14] 黎瑞源,石桃雄,陈其皎,潘凡,陈庆富.中国35个苦荞审定品种EST-SSR指纹图谱构建与遗传多样性分析[J].植物科学学报,2017,35(2):267—275.
Li R Y,Shi T X,Chen Q J,Pan F,Chen Q F. Construction of EST-SSR fingerprinting and analysis of genetic diversity of thirty-five registered Tartary buckwheat cultivars( Fagopyrum tataricum) in China[J]. Plant Science Journal,2017,35(2):267—275.
[15] 张亚利,宋垚,奉树成. SSR 分子标记在山茶属观赏资源遗传多样性研究中的应用[J].植物科学学报,2016,34(5):755—764.
Zhang Y L,Song Y,Feng S C. Application of SSR for the analysis of genetic diversity in Camellia[J]. Plant Science Journal,2016,34(5):755—764.
[16] 向妮艳,湛蔚,陈贤军,黄稳,覃尔岱,李刚,严兴初,覃瑞.红花油脂相关性状与SSR分子标记的关联分析[J].植物遗传资源学报,2019,20(6):1506—1516.
Xiang N Y,Zhan W,Chen X J,Huang W,Qin E D,Li G,Yan X C,Qin R. Association analysis of oil-related traits with SSR molecular markers in safflower[J]. Journal of Plant Genetic Resources,2019,20(6):1506—1516.
[17] 伊六喜,斯钦巴特尔,张辉,高凤云,赵小庆,侯建华.胡麻种质资源遗传多样性及亲缘关系的SRAP分析[J].西北植物学报,2017,37(10):1941—1950.
Yi L X,Si Q B T,Zhang H,Gao F Y,Zhao X Q,Hou J H. Genetic diversity and phylogenetic relationship of flax germplasm resources based on SRAPs[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(10):1941—1950.
[18] 伊六喜,高凤云,周宇,贾霄云,张辉,王树彦,侯建华,斯钦巴特尔.胡麻种质资源表型性状的鉴定与分析[J].中国油料作物学报,2020,42(3):411—419.
Yi L X,Gao F Y,Zhou Y,Jia X Y,Zhang H,Wang S Y, Hou J H,Si Q B T. Evaluation and analysis of phenotypic traits of flax germplasm resources[J]. Chinese Journal of Oil Crop Sciences,2020,42(3):411—419.
[19] Wu J,Zhao Q,Wu G,Zhan S G,Jiang T. Development of novel SSR Markers for flax( Linum usitatissimum L. ) using reduced-representation genome sequencing[J]. Frontiers in Plant Science,2017,7: 2018.
[20] Saha D,Rana R S,Das S,Datta S,Mitra J,Cloutier S J, You F M. Genome-wide regulatory gene-derived SSRs reveal genetic differentiation and population structure in fiber flax genotypes[J]. Journal of Applied Genetics,2019,60(1):13—25.
[21] Soto-Cerda B J ,Maureira-Butler I ,Muioz G,Rupayan A,Cloutier s. SSR-based population structure,molecular diversity and linkage disequilibrium analysis of a collection of flax ( Linum usitatissimum L.)varying for muci-lage seed-coat content . Molecular Breeding ,2012,30(2):875-888.
[22] 苏钰,李明,姜硕,郑东泽.亚麻EST-SSR标记开发[J].东北农业大学学报,2012,43(4):74—79.
[23] 张倩,姜恭好,杨学,曲志会,李杨,路颖,段海燕.利用SSR标记分析17个亚麻品种的遗传关系[J].中国农学通报,2014,30(21):211—216.
[24] 于文静,陈信波,邱财生,邓欣,郭媛,郝冬梅,龙松华,王玉富.利用SSR标记分析亚麻栽培种的遗传多样性[J].湖北农业科学,2010,49(11):2632—2635.
文章摘自:伊六喜,邬阳,曹彦,贾海滨,斯钦巴特尔,高凤云,周宇,贾霄云.亚麻主要产量相关性状的SSR关联分析[J].华北农学报,2022,37(05):52-61.