摘 要:针对“电子烟油”中的吲唑类新型合成大麻素物质,建立了气相色谱-质谱联用(GC-MS)分析方法。以地西泮为内标物,待测样本经甲醇提取后,采用HP-5MS色谱柱(30m×0.25mm×0.25μm),设置起始温度200℃(保持1min),以20℃/min升至260℃(保持1min),再以5℃/min升至300℃(保持10min)的程序升温条件对9种吲唑类合成大麻素同时进行定性和内标法定量检测,并对目标物的质谱碎片碎裂方式进行解析。结果表明,9种目标物质在20min内得到有效分离,并在1.0~100.0μg/mL范围内呈良好的线性关系,相关系数(r2)均大于0.997,检出限和定量下限分别为0.04~0.25μg/mL和0.15~0.85μg/mL;加标回收率为95.1%~104%,日内相对标准偏差(RSD)均小于4.6%,日间RSD均小于8.4%。该方法快速、准确,灵敏度高,适用于实际案件检验。
关键词:气相色谱-质谱联用;电子烟油;吲唑类合成大麻素
合成大麻素(Synthetic cannabinoids,SCs)物质通过化学修饰和结构变化持续衍生出新的品种和新的物质。自2006年以来,该类物质已由第一代的萘甲酰吲哚类发展至第八代吲唑类[1],其中,最有代表性的JWH系列化合物中的吲哚环已被吲唑环取代[2]。Cannaert等[3]通过实验证实了12种新发现的合成大麻素(2018~2020年报道)物质中大部分比早期出现的JWH-018具有更高的人体大麻素受体(CB1)激活能力,其中吲唑类合成大麻素比吲哚类和7-氮杂化吲哚类合成大麻素具有相同或更高的活性。活性较强的CB1激动剂是ADB-BINACA、4F-MDMB-BINACA、MDMB-4en-PINACA,三者均具有吲唑核结构和支链上“粗壮”的叔丁基基团,且均为新近发现的新型合成大麻素物质。Qian等[4]对中国内地某地下实验室查获的ADB-BINACA等4种合成大麻素的检测报告是有关该物质最早的文献报道;MDMB-4en-PINACA[5]是2019年4月在土耳其最早发现的新型合成大麻素物质;4F-MDMB-BINACA[6]最早的研究报告出现在2019年。Grafinger等[7]对30种SCs进行了CB1活化实验,其中吲唑类SCs表现出最强的药理效价(EC50=1.88~281nmol/L),其次为吲哚类(EC50=11.5~2293nmol/L)以及7-氮杂化吲哚类(EC50=62.4~9251nmol/L)。Al-Matrouk等[8]调查了2018年以来科威特合成大麻素的滥用情况,在已发现的16种滥用合成大麻素中,吲唑类占12种,最常见的合成大麻素滥用品为AMB-FUBINACA和5F-ADB的混合物。ADB-BUTINACA于2019年在欧洲首次被发现,并于2020年1月进入新加坡的毒品市场[9]。ADB-FUBINACA和AMB-FUBINACA的激活能力分别比四氢大麻酚(?9-THC)高140倍和85倍[10],日本在2013年首次报道在娱乐场所使用的ADB-FUBINACA,2015年该物质出现了致死病例;AMB-FUBINACA是2014年出现的滥用药物,也导致多起中毒和死亡事件。钱振华等[11]首次报道了在中国大陆发现的“尖叫龟粮”滥用制品中同时检出AMB-FUBINACA、ADB-FUBINACA、5F-ADB、AMB-CHMICA、SDB-005等5种合成大麻素,其中前3种是2015年以来滥用市场较为流行的吲唑类合成大麻素。有关ACHMINACA、ADB-4en-PINACA两种物质的文献报道则较少,目前仅发现Dybowski等[12]利用多种分析仪器对ACHMINACA进行结构表征的报道;Grafinger等[7]对30种SCs进行的CB1激活能力实验中包含了ADB-4en-PINACA,并证实该物质在吲唑类合成大麻素中具有较高的药理效价。
电子烟油是丙二醇、甘油、乙醇及烟草提取物与烟用香精的混合物[13]。地下毒品市场通常将单种或多种合成大麻素溶于电子烟油中或喷涂在植物表面制成种类繁多的滥用制品[11,14-15]。色谱与质谱联用技术是目前检测合成大麻素的重要手段[11,14-24],该技术可在一次进样中对多种组分进行检测。本文利用气相色谱-质谱联用(GC-MS)技术,建立了电子烟油中吲唑类新型合成大麻素的同时定性、定量分析方法,以期为相关案件的检验鉴定提供参考。
1实验部分
1.1仪器与试剂
Thermo ISQ质谱仪(美国赛默飞世尔科技公司),梅特勒十万分之一电子天平(瑞士Mettler Toledo公司),AS超声波清洗机(天津奥特赛恩斯仪器公司),XW-80A涡旋振荡器(海门市麒麟医用仪器厂)。MDMB-4en-PINACA、4F-MDMB-BUTINACA、5F-ADB、ADB-BUTINACA、ADB-4en-PINACA、ADB-FUBINACA、AMB-FUBINACA、ADB-BINACA、ACHMINACA等9种合成大麻素对照品固体粉末(纯度均>98%,美国GLPBIO公司),基本信息见表1;1mg/mL地西泮甲醇标准溶液;甲醇(色谱纯,美国Fisher公司)。案例样本及空白电子烟油来自公安机关在涉毒案件中收缴,空白电子烟油经提取离子模式筛查未检出常见毒品及本文9种合成大麻素物质。
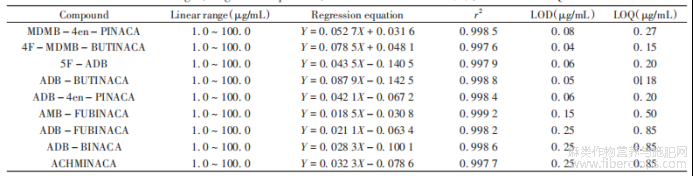
表1 9种吲唑类合成大麻素的基本信息


*:referenced from the technical specifications JD/Y JY02. 09-2021 of drug intelligence and forensic center of the ministry of public security published interior(引自公安部禁毒情报中心 技术规范 JD/Y JY02. 09-2021,内部发行)
1.2仪器条件
色谱条件:HP-5MS毛细管色谱柱(30m×0.25mm×0.25μm),程序升温:设置起始温度200℃,保持1min,以20℃/min升至260℃,保持1min,再以5℃/min升至300℃,保持10min;载气:高纯氦气,流速1.0mL/min;进样口温度:260℃;进样方式:分流进样,分流比为10∶1,进样量1μL;溶剂延迟:3min。
质谱条件:电离源:电子轰击(EI)源,电离能量:70eV;离子源温度:230℃;传输线温度:280℃;扫描模式:全扫描(Scan),范围:m/z50~500。
1.3混合标准溶液配制
混合标准储备液:精确称量各对照品粉末5mg,置于5mL容量瓶内,以甲醇稀释并定容至刻度,配制成质量浓度为1mg/mL的混合标准储备溶液,振荡混匀3min,-20℃冷冻保存备用,临用时放至常温。
含内标物的混合标准溶液:准确量取混合标准储备液适量,添加1mg/mL地西泮标准溶液,甲醇稀释,配制成均含有20.0μg/mL地西泮内标物的1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0μg/mL系列混合标准溶液,混匀备用。
1.4样本制备及前处理
电子烟油样本制备:准确量取空白电子烟油1mL,添加标准物质固体粉末,根据测定需要配制不同添加浓度,超声振荡5min,混匀备用(-20℃冷冻保存),临用时放至常温。
电子烟油样本前处理:用微量进样器准确量取10μL液体,置于1.5mL离心刻度试管中,添加20μL地西泮标准溶液,加甲醇定容至1mL,振荡混匀3min,静置后取上清液待测(定量分析制备平行双样)
2结果与讨论
2.1色谱条件优化
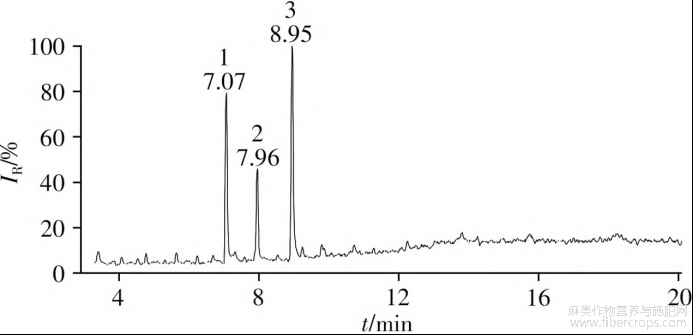
采用添加内标物的混合标准溶液进样,分别考察本实验室常用的HP-1MS(30m×0.25mm×0.25μm)、HP-5MS(30m×0.25mm×0.25μm)和HP-INNOWaxs(30m×0.32mm×0.25μm)3种不同极性的色谱柱,在起始温度分别为60、100、200℃,升温速率分别为20、15、10、5℃/min条件下的色谱峰分离效果。结果表明,HP-5MS色谱柱的分离效果明显优于其他两种色谱柱。设置起始温度为200℃,保持1min,以20℃/min升温至260℃,保持1min,再以5℃/min升温至300℃,保持10min条件下,在保留时间(R)t6.0~19.0min范围内,内标物地西泮及9种合成大麻素的色谱峰分离效果较好,可在20min内完成9种目标物的分析,能够满足实际应用中多种组分的检测需求。

图1 含内标物的混合标准溶液(50μg/mL)的总离子流色谱图
2.2定性检测结果
按照“1.2”色谱与质谱条件,得到加标混合标准溶液(50μg/mL)的总离子流(TIC)色谱图如图1所示。由TIC图可以看出,内标物及9种合成大麻素的色谱峰能够有效分离,且保留时间(R)t均小于20min。由于吲唑类合成大麻素物质的结构相近,在EI源作用下产生的部分质谱碎片离子相同,所以在采用GC-MS定性分析时,不仅要根据各组分的质谱特征碎片信息,还要结合标准物质的保留时间进行综合分析确认。9种合成大麻素的结构骨架见图2。在NIST谱库检索过程中,5F-ADB、AMB-FUBINACA、ADB-FUBINACA和ADB-BINACA经NIST17检索能够检索到匹配化合物,其他5种合成大麻素未检索到匹配信息。9种合成大麻素的质谱图及结构式

图2 9种吲唑类合成大麻素的结构骨架
2.3碎片离子碎裂方式分析
本文的9种目标物质均为吲唑酰胺类合成大麻素,其中MDMB-4en-PINACA、4F-MDMB-BUTINACA、5F-ADB、AMB-FUBINACA4种化合物的结构相近,酰胺键N原子上的链接组[25](Linker group)均为丁酸甲酯基团,主要区别在于吲唑核N原子上的尾端(Tail)取代基分别为1-戊-4-烯基、4-氟丁基、5-氟丁基和氟苄基。该类物质具有相同的碎裂方式:分子结构中酰胺键C—N发生α断裂,形成丰度值最高的带有侧链的吲唑酰阳离子;吲唑核N原子尾端取代基断裂并发生γH重排,形成吲唑甲酰胺类合成大麻素的特征碎片离子m/z145。MDMB-4en-PINACA、4F-MDMB-BUTINACA、5F-ADB3种物质的顶部区域羧基发生C—O键断裂并伴随叔丁基脱裂[26-28],AMB-FUBINACA顶部区域发生酯基脱裂。碎片离子碎裂方式如图3A、B、C和F图所示。
ADB-BUTINACA、ADB-4en-PINACA、ADB-FUBINACA和ADB-BINACA4种化合物的结构类似,酰胺键N原子上的链接组均为3,3-二甲基丁酰胺基团,主要区别在于吲唑核N原子上的尾端取代基分别为丁基、1-戊-4-烯基、氟苄基和苄基。主要碎裂方式亦是分子结构中酰胺键C—N发生α断裂,ADB-BUTINACA和ADB-4en-PINACA形成丰度值最高的带有侧链的吲唑酰阳离子;吲唑核N原子尾端取代基断裂并发生γH重排,形成吲唑甲酰胺类合成大麻素的特征碎片离子m/z145;ADB-FUBINACA和ADB-BINACA则产生丰度值最高的尾端取代基碎片离子氟苄基、苄基,此外,分子结构顶部区域发生氨甲酰基团脱裂。碎片离子碎裂方式如图3D、E、G和H图所示。
ACHMINACA的结构稍区别于上述合成大麻素物质,其链接部酰胺键N原子直接链接金刚烷基团,吲唑核N原子上的尾端取代基为甲基环己烷,主要碎裂方式同样是分子结构中酰胺键C—N发生α断裂,形成带有侧链的吲唑酰阳离子及金刚烷胺基碎片离子;吲唑核N原子尾端取代基断裂并发生γH重排,形成丰度值最高的吲唑甲酰胺类合成大麻素的特征碎片离子m/z145;此外,在EI源作用下,尾端取代基甲基环己烷C—C链断裂[12],产生更为丰富的碎片信息。碎片离子碎裂方式分析如图3I所示。

图3 9种合成大麻素的EI-MS质谱图及碎片离子碎裂方式
2.4方法学考察
2.4.1标准曲线、检出限及定量下限
按照“1.2”仪器条件,将“1.3”中含有内标物的系列混合标准溶液由低到高浓度依次进样分析。以目标物的质量浓度为横坐标(X,μg/mL),目标物与内标物的峰面积比值为纵坐标(Y),分别对9种目标物拟合线性回归方程。结果显示,9种目标物在1.0~100.0μg/mL范围内呈良好的线性关系,相关系数(r2)均大于0.997,检出限(LOD,S/N≥3)为0.04~0.25μg/mL,定量下限(LOQ,S/N≥10)为0.15~0.85μg/mL(见表2)
表2 9种合成大麻素的线性范围、回归方程、相关系数、检出限及定量下限
2.4.2精密度实验
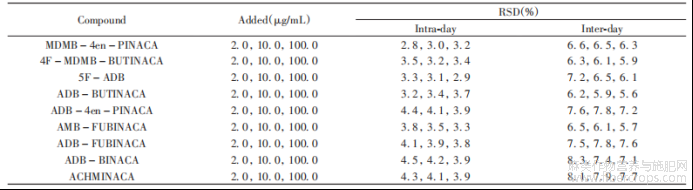
选取线性范围内的低、中、高浓度,当日平行配制2.0、10.0、100.0μg/mL3种质量浓度的含内标物质的混合标准溶液各6份,伴随标准曲线进行含量测定,计算日内相对标准偏差(RSD),连续测定3d,计算日间RSD。结果显示,9种合成大麻素的日内RSD均小于4.6%,日间RSD均小于8.4%(见表3)。
表3 9种合成大麻素的日内、日间相对标准偏差(n=6)
2.4.3回收率实验
取空白电子烟油,按照“1.4”方法制备样本,同时添加4种代表性物质MDMB-4en-PINACA、ADB-BUTINACA、ACHMINACA、5F-ADB,配成质量浓度约为5.0、2.0、0.5mg/mL的加标样本。按照“1.4”方法进行前处理并进样分析,每个浓度重复测定5次,计算回收率。结果显示,3种加标水平下的回收率为95.1%~104%,RSD为3.2%~6.1%。
2.5案例应用
采用“1.2”仪器条件及“1.4”前处理方法,对案件中查获的可疑“电子烟油”样本进行分析,其TIC图如图4所示。对样本与标准物质的质谱特征及色谱峰保留时间进行比较,确认样本中检出MDMB-4en-PINACA、ADB-BUTINACA,平均质量浓度分别为1.08、2.25mg/mL。结果表明,本方法稳定、检测结果可靠。
图4 添加内标物的案例样本的TIC图
3结论
合成大麻素是新精神活性物质法庭科学研究的重点和热点领域。本文建立的气相色谱-质谱联用分析方法可在较短时间内完成对9种吲唑类合成大麻素的同时定性和定量检测,进行了方法学考察及案例应用,并对9种目标物质的质谱信息、碎片离子主要碎裂方式进行分析。该方法具有快速、准确、灵敏度高的特点,可以满足司法鉴定工作需要,为涉及合成大麻素类案件的检验鉴定提供参考。
参考文献
[1]Wang K D,Yuan X L,Zhang Y R,Sheng Z H,Hu J J,Cao F Q.Chin. J. Forensic Med.(王跨陡,袁晓亮,张玉 荣,盛振海,胡钧健,曹芳琦.中国法医学杂志),2021,36(1):25-29.
[2]Qian Z H,Jia W,Liu C M.Chin. J. Anal. Chem.(钱振华,贾薇,刘翠梅.分析化学),2020,48(11):1564- 1572.
[3]Cannaert A,Sparkes E,Pike E,Luo J L,Fang A,Kevin R C,Ellison R,Gerona R,Banister S D,Stove C P. ACS. Chem. Neurosci.,2020,11(24):4434-4446.
[4]Qian Z H,Hua Z D,Liu C M,Jia W.Forensic Toxicol.,2016,34:133-143.
[5]Erol Ozturk Y,Yeter O.J. Anal. Toxicol.,2021,44(9):976-984.
[6]Krotulski A J,Mohr A L A,Kacinko S L,Fogarty M F,Shuda S A,Diamond F X,Kinney W A,Menendez M J, Logan B K.J. Forensic Sci.,2019,64(5):1451-1461.
[7]Grafinger K E,Cannaert A,Ametovski A,Sparkes E,Cairns E,Banister S D,Auwärter V,Stove C P.Drug Test. Anal.,2021,13(7):1402-1411.
[8]Al-Matrouk A,Alqallaf M,AlShemmeri A,BoJbarah H.Forensic Sci. Int.,2019,303:109960.
[9]Sia C H,Wang Z,Goh E M L,Tan Y L,Fong C Y,Moy H Y,Chan E C Y.Clin. Chem.,2021,67(11):1534-1544.
[10]Lobato-Freitas C,Brito-da-Costa A M,Dinis-Oliveira R J,Carmo H,Carvalho F,Silva J P,Dias-da-Silva D.Pharmaceuticals,2021,14(3):186.
[11]Qian Z H,Chen Y M,Gao L S,Zheng H,Liu C M.Chin. J. Forensic Med.(钱振华,陈月猛,高利生,郑珲,刘 翠梅.中国法医学杂志),2018,33(4):335-340.
[12]Dybowski M P,Holowinski P,Typek R,Dawidowicz A L.Forensic Toxicol.,2021,39:230-239.
[13]Zhang X X,Shao D Y,Lian P K,Guo L,Luo J M,Xu D,Su J K,Cai J B.Food Mach.(张晓旭,邵灯寅,连培 康,郭磊,罗娟敏,徐达,苏加坤,蔡继宝.食品与机械),2017,33(11):33-37,85.
[14]Xu E Y,Liu J T,Yuan H Y,Gao L N.Chin. J. Anal. Lab.(徐恩宇,刘俊亭,袁慧雅,高利娜.分析试验室), 2017,36(8):869-872.
[15]Wang P,Liu X Y,Qiang H S,Xu W C.Chin. J. Forensic Med.(王平,刘晓云,强火生,徐渭聪.中国法医学杂 志),2020,35(5):545-548.
[16]Qian Z H,Qiao H W,Hua Z D.Chin. J. Forensic Med.(钱振华,乔宏伟,花镇东.中国法医学杂志),2015,30 (1):1-4. [17]Zhang C S,Zhai W F.J. Instrum. Anal.(张春水,翟晚枫.分析测试学报),2016,35(3):264-270.
[18]Sisco E,Burns A,Moorthy A S.J. Forensic Sci.,2021,66(5):1908-1918.
[19]Al-Matrouk A,Alqallaf M,AlShemmeri A,BoJbarah H.Forensic Sci. Int.,2019,303:109960.
[20]Liu C M,Jia W,Meng X,Hua Z D.J. Forensic Sci.,2021,66(6):2156-2166.
[21]Hutter M,Broecker S,Kneisel S,Auwärter V.J. Mass Spectrom.,2012,47(1):54-65.
[22]Shen R O,Diana C K,Russell Sarah G G,Helen A R,Banister Samuel D,Gerona R R,Michelle G,Johnson C S, McCarthy M J.Drug Test. Anal.,2020,12(2):195-214.
[23]Mulet C T,Tarifa A,DeCaprio A P.Anal. Bioanal. Chem.,2020,412(28):7937-7953.
[24]Fan Y,Zong X,Liu J,Ke X,Huang Z,Xu Y.J. Pharm. Biomed. Anal.,2021,193(30):113723-113730.
[25]Potts A J,Cano C,Thomas S H L,Hill S L.Clin. Toxicol.,2020,58(2):82-98.
[26]Dybowski M P,Holowinski P,Typek R,Dawidowicz A L.Forensic Toxicol.,2021,39:481-492.
[27]Leong H S,Watanabe S,Kuzhiumparambil U,Fong C Y,Moy H Y,Yao Y J,Witting P K,Fu S.Forensic Toxicol., 2020,39(1):198-212.
[28]Dybowski M P,Typek R,Dawidowicz A L,Holowinski P.Forensic Toxicol.,2021,39:213-221
文章摘自:宋辉.气相色谱-质谱联用法同时测定“电子烟油”中9种吲唑类新型合成大麻素[J].分析测试学报,2022,41(06):858-864.DOI:10.19969/j.fxcsxb.21111501.