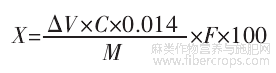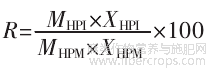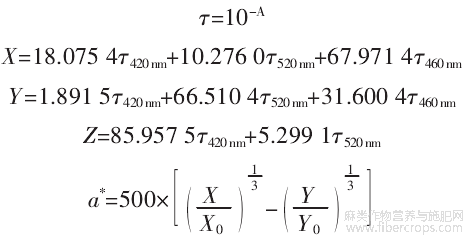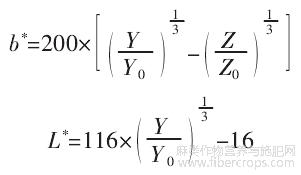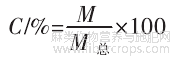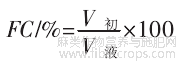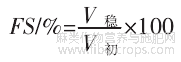作者:徐鹏伟等
来源:
发布时间:2021-10-10
Tag:
点击:
[麻进展] 火麻仁蛋白的提取分离及理化性质研究
摘 要:以脱脂火麻仁粉(defatted hemp seed meal,HPM)为原料,采用两种方法进行火麻仁蛋白(hemp seed proteinisolate,HPI)的提取分离,碱提/酸沉法制备得到碱提蛋白(hemp seed protein isolate-alkaline extraction,HPI-AE),盐溶/盐析法制备得到盐提蛋白(hemp seed protein isolate-salt extraction,HPI-SE)。HPI-SE的蛋白含量(94.8%)高于HPI-AE的蛋白含量(85.9%);并且HPI-SE的外观色泽更加亮白。蛋白质凝胶电泳(sodium dodecyl sulfate polyacrylamidegel electrophoresis,SDS-PAGE)结果表明,两种方法提取的火麻仁蛋白主要成分均为火麻仁球蛋白,二者氨基酸组成相似,均含有丰富的精氨酸。不同pH值条件下,HPI的溶解性曲线均呈U型,但是在相同pH值条件下,二者的溶解性存在较大的差异。火麻仁蛋白的起泡性和蛋白质的溶解性呈现出正相关,当pH值远离等电点时,同种电荷的静电斥力提高了蛋白质的溶解性,从而改善了蛋白质的起泡性。荧光光谱显示,在不同pH值条件下,HPI的蛋白构象不随pH值变化发生明显改变,但HPI-SE的荧光强度高于HPI-AE的荧光强度,显示HPI-SE的蛋白质聚集程度高于HPI-AE。
关键词:火麻;火麻仁蛋白;提取;理化性质;功能性
大麻(Cannabis sativa L.)广泛种植于亚洲、欧洲及南美等地,由于大麻中的四氢大麻酚具有致幻成瘾的特性,因此许多国家将其列为毒品而被禁止种植,但是不同大麻品种中的四氢大麻酚(tetrahydrocannabi-nol,THC)含量差别很大,THC含量低于0.3%的品种被列为工业大麻。工业大麻,又称火麻,在我国大量种植。火麻的种子仁富含不饱和脂肪酸、微量元素和蛋白质,是一种营养价值极高的农作物。
火麻仁蛋白(hemp seed protein isolate,HPI)因易于消化而闻名,体外模拟人体胃肠道消化表明,火麻仁蛋白易于被胃蛋白酶和胰蛋白酶消化,其消化率高达88%~91%。火麻仁蛋白由两种蛋白(火麻仁球蛋白和麻仁白蛋白)组成,包含所有人体所需氨基酸,且精氨酸含量丰富,研究证明,火麻仁蛋白粉可以改善运动员的耐力和增强力量。火麻仁蛋白不仅营养价值很高,且没有致敏因子。火麻仁蛋白作为植物蛋白的来源,具有很高的开发潜力。
常见的植物蛋白通常是通过碱提/酸沉法制备。文献报道,氯化钠溶液可用于提取分离植物球蛋白,对于火麻仁蛋白而言,球蛋白含量高于70%,是主要的储藏蛋白,与人体免疫功能有关,因此利用氯化钠溶液提取分离火麻仁蛋白也是开发利用火麻仁蛋白的一个重要途径。Hadnadev等报道,通过氯化钠溶液溶解火麻仁蛋白,然后通过透析袋脱盐,将蛋白质沉淀下来,试验的局限性在于提取量小且试验操作复杂,因此,仍需要在此基础上,深入研究氯化钠溶液的提取温度对火麻仁蛋白溶解性的影响。
本研究旨在确定两种分离方法对于制备得到的火麻仁蛋白理化性质、功能特性以及微观结构的影响,从多方面评价分离方法,为火麻仁蛋白产业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
火麻仁:云南汉盟制药股份有限公司。
氢氧化钠、盐酸、亚硫酸钠:北京化工厂;石油醚、三(羟甲基)氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、甘氨酸(glycine,Gly)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、尿素(urea):国药集团化学试剂有限公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、异硫氰酸苯酯、二硫苏糖醇(dithio threitol,DTT):阿拉丁试剂公司;氯化钠、结晶乙酸钠:天津市福晨化学试剂厂;蛋白质凝胶电脉(sodium dodecyl sulfate polyacylamide gelelectrophoresis,SDS-PAGE)试剂盒:北京索莱宝科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
KDN-520凯氏定氮仪:徐州华纳精密仪器有限公司;WF2UV-2802H分光光度计:上海尤尼柯仪器有限公司;F-4600荧光分光光度计:日立高新技术公司;LC-20AT液相色谱:岛津公司。
1.3 溶液配制
缓冲溶液A:0.086mol/L Tris、0.09mol/L Gly、0.004mol/L EDTA(Tris-Gly,pH8.0)、8mol/L尿素。
缓冲溶液B:0.086mol/L Tris、0.09mol/L Gly、0.004mol/L EDTA、8 mol/L尿素和0.1mol/L Na2SO3(pH9.5)。
2-硝基-5-硫代磺基苯甲酸酯(2-nitro-5-thiosul-fobenzoate,NTSB)储备溶液:将0.1gDTNB溶解于10mL 1mol/L Na2SO3中,pH值调至7.5。将氧气连续引入离心管中,水浴条件下维持温度37℃,直到溶液颜色从红色变为浅黄色为止,证明了NTSB的生成。
NTSB测试溶液:用缓冲溶液B25℃(100∶1,体积比)稀释NTSB储备溶液,制备NTSB测试溶液。
1.4 试验方法
1.4.1 脱脂火麻仁粉(defatted hemp seed meal,HPM)的制备
通过机械压榨(脱壳)火麻仁以脱除油脂,然后将脱除油脂的火麻仁粉和正己烷[(1∶20(g/mL)]混合,25℃下充分搅拌脱除剩余油脂,得到脱脂火麻仁粉(HPM)。
1.4.2 碱提/酸沉法制备火麻仁碱提蛋白(hemp seedprotein isolate-alkaline extraction,HPI-AE)
将HPM分散在去离子水[料液比1∶20(g/mL)]中,pH值调至9.5,50℃下充分搅拌,离心收集上清液。将上清液pH值调至5.0,使蛋白质充分沉淀,离心获得沉淀物。将沉淀物分散在去离子水中,将pH值调至7.0,然后冷冻干燥获得HPI-AE。
1.4.3 盐溶/盐析法制备火麻仁盐提蛋白(hemp seedprotein isolate-salt extraction,HPI-SE)
将HPM分散在5%NaCl溶液[料液比1∶15(g/mL)]中,50℃条件下充分搅拌2h。趁热离心获得上清液。将上清液在4℃下保存24h,然后离心获得沉淀物。将沉淀物分散在去离子水中,洗涤后经离心以便脱除氯化钠。然后将沉淀物冷冻干燥获得HPI-SE。
1.4.4 理化性质
1.4.4.1 蛋白含量的测定及蛋白回收率计算
采用凯氏定氮法确定样品蛋白含量。将蛋白样品与浓硫酸和催化剂硫酸钾一同置于消化炉加热消化,使蛋白质分解,分解后的氨和硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离出来,用硼酸吸收后再以盐酸标准溶液滴定,根据盐酸的消耗量乘以换算系数,换算成蛋白质含量。
蛋白含量计算公式如下。
式中:X为蛋白含量,%;△V为试样消耗盐酸标准滴定液的体积,mL;C为盐酸浓度,mol/L;0.014为1.0mL盐酸(1.0mol/L)标准滴定液相当于氮元素的质量,g;M为试样质量,g;F为换算系数,本研究选择系数F=5.9。
回收率计算公式如下。
式中:R为蛋白回收率,%;MHPI为提取分离获得的HPI的质量,g;XHPI为HPI中蛋白含量,%;MHPM为用于提取分离蛋白的HPM的质量,g;XHPM为HPM中蛋白含量,%。
1.4.4.2 外观色泽
HPI的颜色测量通过将蛋白质溶解于1mol/L氢氧化钠溶液中,配制成20mg/mL的蛋白质溶液,在420、520、620nm条件下测吸光值。经过公式计算确定了参数L*(亮度),a*(红-绿色)和b*(黄-蓝色)的值。计算公式如下。
式中:A为吸光值;τ为透光率;X0为97.285;Y0为100;Z0为116.145。
1.4.4.3 巯基(SH)和二硫键(S-S)含量
巯基可分为总巯基(SHT)、游离巯基(SHF)。
SHT的测定方法:将火麻仁蛋白溶解于缓冲溶液A中(5 mg/mL),充分混合后离心10min,收集上清液,梯度稀释获得不同浓度的火麻仁蛋白溶液;将80μL Ellman试剂(4mg/mL DNTB)添加到火麻仁蛋白溶液(2mL)中,充分混合5min后,在412nm处测量吸光度。
SHF的测定方法:将火麻仁蛋白溶解到缓冲溶液B(5mg/mL)中,充分混合10min后离心,收集上清液。用NTSB测试溶液线性稀释火麻仁蛋白溶液以获得不同浓度的蛋白质溶液,412nm处测量吸光度。
巯基含量计算公式如下。
二硫键含量计算公式如下。
式中:CSH为SH含量,μmol/g;CS-S为S-S含量,μmol/g;A412为412nm处的吸光度;C为样品浓度,mg/mL;D为稀释系数;73.53为106/(1.36 ×104),其中1.36×104为摩尔吸收率,106为转化因子。
1.4.4.4 SDS-PAGE
非还原状态下的蛋白质电泳分离胶浓度为12%,浓缩胶浓度为5%。方法如下,将样品(2mg/mL)分散于不含二硫苏糖醇非还原性缓冲液中,95℃条件下加热15min后冷却,电泳时蛋白上样10μL。
还原状态下的蛋白质电泳分离胶浓度为15%,浓缩胶浓度为5%。方法如下,将样品(2mg/mL)分散于含DTT的还原性缓冲液中,95℃条件下加热15min后冷却,电泳时蛋白上样10μL。
凝胶采用考马斯亮蓝染色,最后用脱色液脱色至背景无色。
1.4.4.5 氨基酸组成
氨基酸通过柱前衍生-高效液相色谱法测定。适量样品置于密封管中,用16mL 6mol/L盐酸预处理,110℃条件下消化24h,蛋白质完全水解,获得氨基酸溶液。使用异硫氰酸苯酯对氨基酸衍生化,液相检测。
酸性条件下水解蛋白质会导致色氨酸被破坏,因此蛋白质需要在碱性条件下水解。110℃下碱性环境水解24h,获得色氨酸溶液,无需柱前衍生,直接液相检测。氨基酸含量计算公式如下。
式中:C为氨基酸含量,%;M为单一氨基酸质量,mg;M总为所有氨基酸质量之和,mg。
1.4.5 火麻仁蛋白功能性
1.4.5.1 溶解性
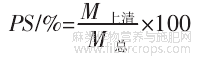
依据文献报道,不同pH值条件下,火麻仁蛋白的溶解性(protein solubility,PS)测定方法如下:将蛋白样品(0.1g)溶解在10mL 0.1mol/L NaOH溶液中,测定的蛋白含量作为样品蛋白的总含量(对照);将10mg/mL火麻仁蛋白样品pH值分别调节为3.0~11.0,充分搅拌1h,8000g条件下离心30min得上清液。使用Bradford方法分析上清液中的蛋白含量。蛋白质溶解度计算公式如下。
式中:PS为蛋白质溶解度,%;M上清为上清液中蛋白的质量,g;M总为总的蛋白质质量,g。
1.4.5.2 起泡性/泡沫稳定性
火麻仁蛋白在不同pH值条件下的起泡性(foam-ing capacity,FC)和泡沫稳定性(foaming stability,FS)测定方法如下,将10mg/mL蛋白样品pH值分别调为3.0~11.0。高速乳化机快速剪切搅拌10min,使蛋白溶液充分起泡,记录溶液体积和初始泡沫体积。FC计算公式如下。
式中:FC为蛋白质起泡性,%;V初为泡沫的初始体积,mL;V液为溶液体积,mL。
泡沫静置30min,记录稳定泡沫体积。泡沫稳定性计算公式如下。
式中:FS为泡沫稳定性,%;V稳为稳定泡沫体积,mL;V初为初始泡沫体积,mL。
1.4.6 荧光光谱
蛋白质分子中含有的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)3种芳香族氨基酸残基,在紫外光的照射下会发射荧光。在固定激发波长的照射下,荧光光谱利用蛋白质中芳香族氨基酸的荧光波长随外界环境变化而改变的特点,用于研究蛋白质的构象变化。在0.1mol/L磷酸钠缓冲液(pH7.4)中制备蛋白质储备溶液(10mg/mL),然后将pH值调节至3.0、5.0、7.0、9.0和11.0。用缓冲液将储备溶液稀释至0.01%,在荧光分光光度计上记录荧光光谱。激发波长:275nm;发射波长:290nm~450nm。
2 结果和分析
2.1 理化性质
2.1.1 理化参数
HPI的理化参数如表1所示。
从表1中可以看出蛋白质是HPM的主要成分;HPI-SE的蛋白含量(94.8%)高于HPI-AE的蛋白含量(85.9%)。氯化钠溶液常用于提取植物球蛋白,并且火麻仁蛋白中球蛋白含量较高,通过氯化钠提取火麻仁蛋白具有广阔前景;盐溶/盐析过程中,溶液温度的改变对于火麻仁球蛋白的溶解性影响较大,其它物质的溶解性没有明显变化,因而盐溶/盐析法更利于提取火麻仁球蛋白,因此HPI-SE的蛋白含量更高。HPI-AE的蛋白回收率为83.43%,高于HPI-SE蛋白回收率59.06%。对于碱提/酸沉法而言,碱提蛋白时,蛋白质分子携带大量的同种电荷阻碍了蛋白质分子的聚集沉淀,从而提高了蛋白质的溶解性;等电点沉淀蛋白质时,蛋白质分子之间静电斥力消失,蛋白质分子聚集沉淀。等电点沉淀过程中,大部分蛋白沉淀下来的同时,也有部分其它物质沉淀下来,从而导致HPI-AE中蛋白回收率较高,蛋白含量较HPI-SE低。
由表1可知,HPI-SE具有高的L*值、较低的a*值和b*值;说明了HPI-SE的外观色泽比HPI-AE的外观色泽更亮白。碱提/酸沉法提取火麻仁过程中,羰基化合物(还原糖类)和氨基化合物(蛋白质)间的美拉德反应生成棕色的大分子类物质,等电点沉淀过程中,这些物质也沉淀下来,从而导致HPI-AE外观呈现浅黄色。
游离巯基、总巯基和二硫键含量测试结果显示,HPI-SE中游离巯基、总巯基和二硫键的含量分别为26.49、59.10、16.33μmol/g;含量均略高于HPI-AE,后者游离巯基、总巯基和二硫键的含量分别为22.44、50.77、14.17μmol/g。巯基和二硫键是蛋白质构象中的重要官能团,二硫键可以保持折叠构象的稳定性并降低构象熵,从而提高热稳定性;分子间二硫键的形成,会导致蛋白质分子更易聚集沉淀。火麻仁蛋白中游离巯基的含量高于木瓜种子蛋白中游离巯基的含量9.73μmol/g,也高于三叶木通蛋白中游离巯基的含量10.82μmol/g,因此巯基含量高可能是导致火麻仁蛋白溶解性差的原因之一。
2.1.2 蛋白质电泳
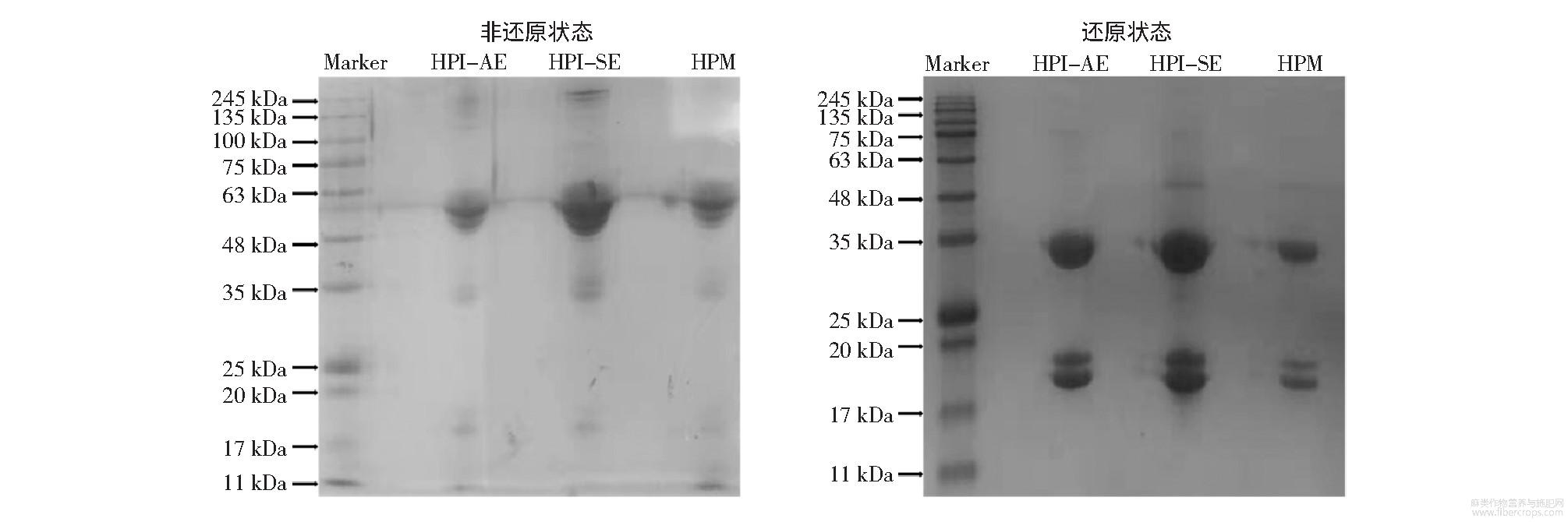
HPM和HPI在非还原状态和还原状态条件下的蛋白质电泳见图1。
图1 HPI-AE、HPI-SE和HPM在非还原状态和还原状态条件下的蛋白质电泳
如图1所示,非还原状态下HPM和HPI的主要肽链分子量均为55kDa;还原状态下HPM和HPI主要肽链分子量均为34、19、18kDa。结果发现HPM和HPI具有相同的蛋白组成,成分均是火麻仁球蛋白。本研究中,火麻仁球蛋白由6个分子量为55kDa的亚基组成,每个亚基由一个酸性基团和一个碱性基团通过二硫键连接组成;还原状态下,亚基的二硫键被打开,形成一个分子量为34kDa的酸性基团和分子量为19kDa或18kDa碱性基团。其中酸性基团由单一肽链构成,分子量为34kDa;碱性基团有两种肽链形式,分子量分别为19、18kDa。
在非还原状态下,有少量分子量为35、19、18kDa的肽链,表明在非还原状态下,依然有少量亚基的二硫键被打开。非还原状态下,HPI中出现了少量分子量大于100kDa的条带,但未在HPM中出现。表明了在提取分离蛋白过程,由于温度等一些外在因素导致了部分蛋白质变性,从而交联形成了聚合物。
2.1.3 氨基酸组成
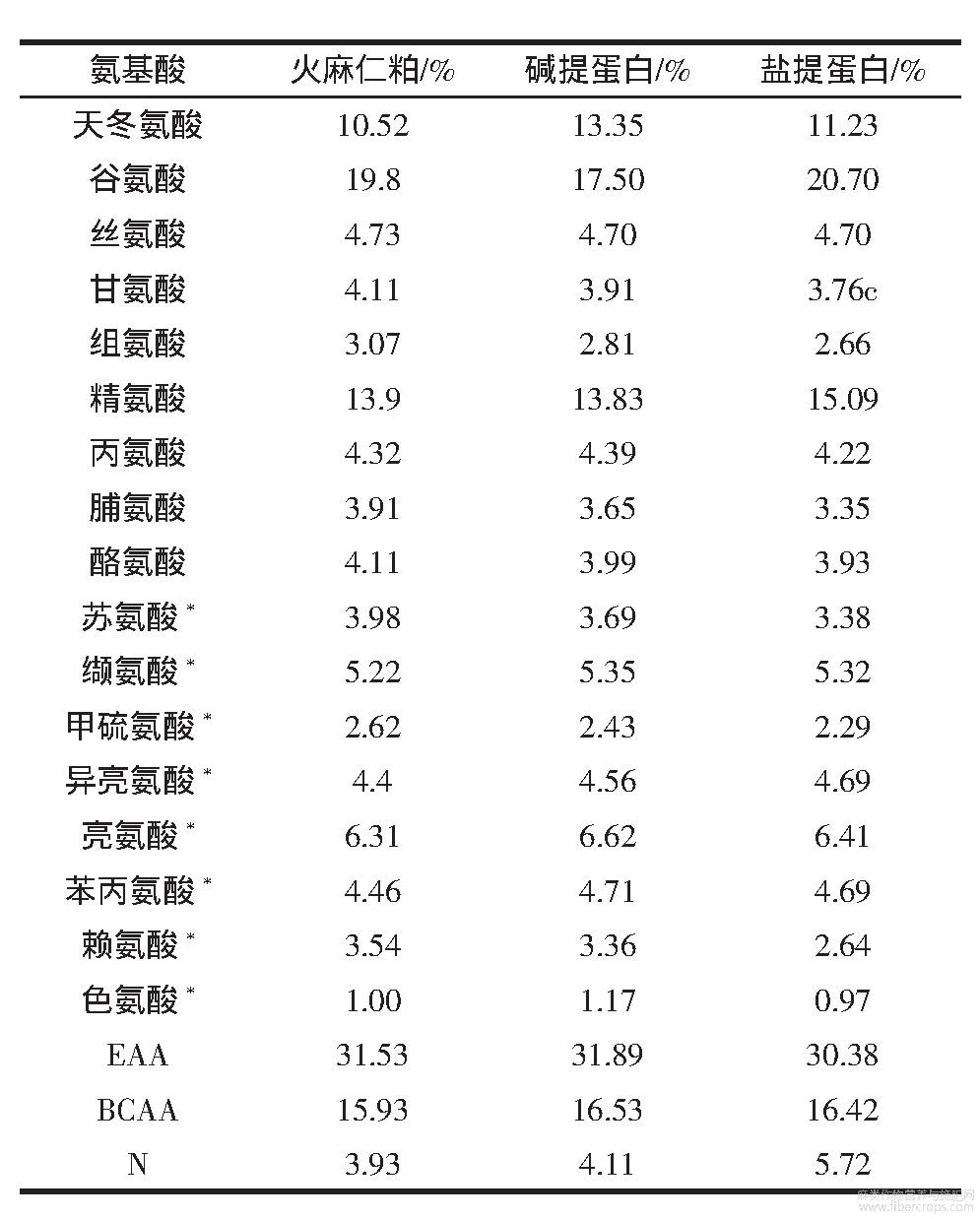
HPM和HPI的氨基酸组成见表2。
表2 HPM和HPI的氨基酸组成
由表2所示,HPI和HPM的氨基酸组成相近,意味着两种分离过程只是富集了火麻仁蛋白质,未引起蛋白质组成太大变化。和其它植物蛋白相比,火麻仁蛋白中含有丰富的精氨酸,尤其HPI-SE精氨酸含量高达15.09%;已有研究表明,饮食中精氨酸/赖氨酸的比值越高,降低胆固醇的作用越明显,有利于心血管健康,HPI-SE的精氨酸/赖氨酸的值高达5.72,与HPI-AE相比,HPI-SE可能对改善心血管健康有更好的积极作用。支链氨基酸能够直接为肌肉提供能量,在运动过程中被直接消耗供能,减少肌肉的过度分解,起到保护肌肉的作用,火麻仁蛋白的必需氨基酸(EAA)含量均高于30%,支链氨基酸含量均高于16%,以上结果表明,火麻仁蛋白是一种优质的植物蛋白。
2.2 火麻仁蛋白功能性
2.2.1 蛋白质溶解
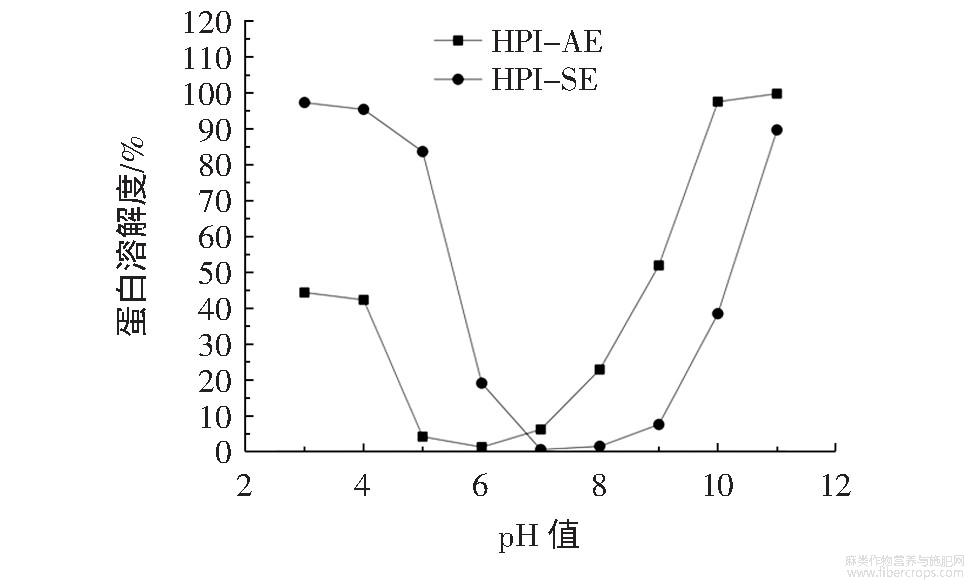
不同pH值条件下HPI的溶解性见图2。
图2 不同pH值条件下火麻仁蛋白的溶解性
蛋白溶解性是蛋白其它功能特性的基础,影响蛋白在食品领域的应用,因此探究火麻仁蛋白的溶解曲线是进一步研究蛋白其它功能特性的基础。由图2可知,在pH3.0~11.0的范围内,HPI的溶解性呈现出相同的趋势,均呈U型。但是HPI具有相异的等电点;HPI-AE在pH6.0时溶解度最小,为1.34%;而HPI-SE在pH7.0时溶解度最小,为0.65%。当pH值接近等电点时,静电斥力的丧失有助于蛋白质聚集体的形成,从而导致火麻仁蛋白的溶解性降低;当pH值远离等电点时,火麻仁蛋白携带相同电荷,由于静电斥力的作用,导致蛋白质聚集程度下降,从而蛋白质的溶解性提高。与HPI-AE相比,HPI-SE在pH<5的条件下溶解度更高,相反地,当pH>9.0时,HPI-AE的溶解度略高于HPI-SE。
2.2.2 起泡性/泡沫稳定性
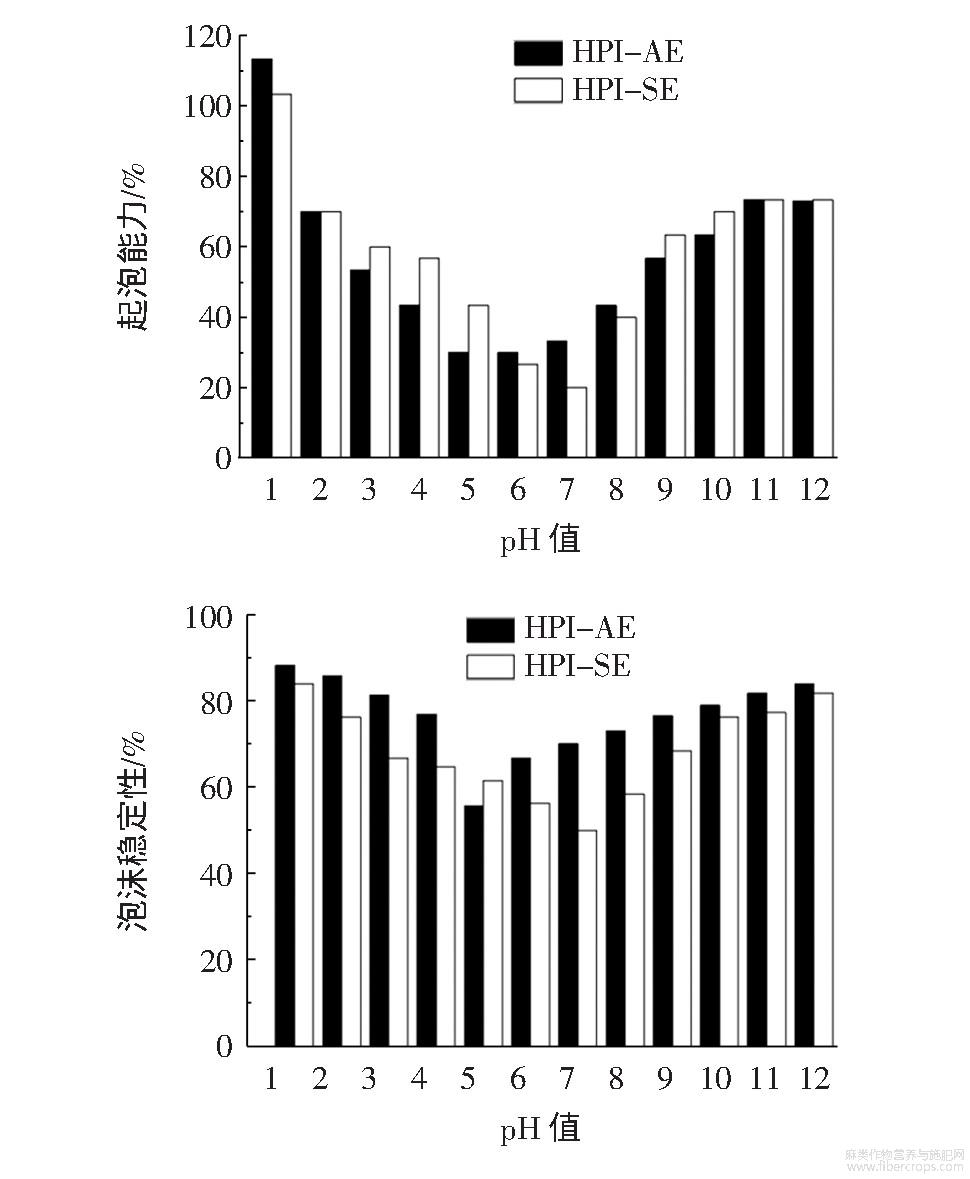
不同pH值条件下HPI的起泡能力和泡沫稳定性见图3。
图3 HPI在不同pH值条件下的起泡能力和泡沫稳定性
蛋白的起泡性在蛋白质某些产品开发过程中极为关键,例如蛋糕制作过程中,蛋白的起泡性能直接决定产品的成败,因而有必要研究火麻仁蛋白的起泡性。比较图3和图2得知在不同的pH值条件下,蛋白质的起泡性/泡沫稳定性和蛋白质溶解性呈正相关。其中HPI-AE和HPI-SE均在溶液pH1.0时起泡能力最强,分别为113.33%和103.35%;在等电点附近,HPI的起泡能力和稳定均最差。当pH值远离等电点时,蛋白质的起泡性/泡沫稳定性迅速增加,说明蛋白良好的溶解性是获得较好起泡能力和泡沫稳定性的前提。蛋白质的起泡过程意味着蛋白质被吸附在空气-水界面上,并通过分子间相互作用重新排列形成弹性薄膜;火麻仁蛋白是生物大分子,具有天然的疏水性;溶解性改善后的火麻仁蛋白亲水性增强;此时蛋白质分子更易吸附在空气-水界面上,这有助于泡沫的形成,并使泡沫稳定性增强。
2.3 荧光光谱
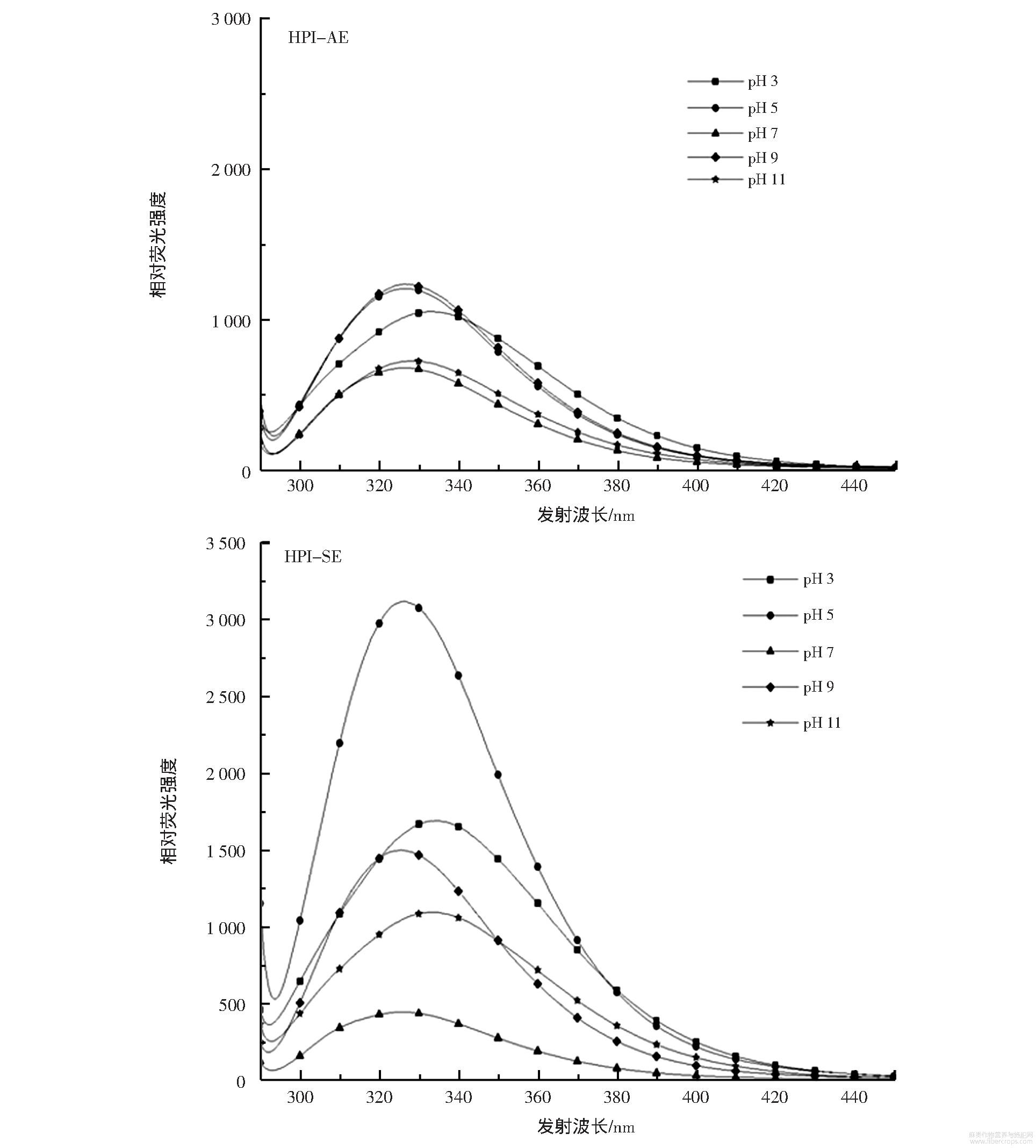
不同pH值条件下HPI的荧光光谱见图4。
图4 不同pH值条件下HPI-AE和HPI-SE的荧光光谱
溶液的pH值决定着HPI的溶解性和起泡性,但是在不同pH值条件下,蛋白质的微观结构是否因此而改变值得探讨。在不同pH值条件下,荧光光谱通过探究芳香族氨基酸残基的微观环境是否改变,可以部分解释溶液pH值对于火麻仁蛋白结构的影响。由图4可知,试验过程未观察到300nm~310nm处的酪氨酸的发射光谱,这可能是由于强烈的蛋白质-蛋白质相互作用导致酪氨酸-色氨酸能量转移增加,进而导致酪氨酸的发射光谱被色氨酸的发射光谱覆盖。HPI的最大发射波长(λmax)均小于335nm,这表明在不同pH值条件下,色氨酸残基均位于疏水性较强的内部,蛋白质保持一个较为致密的结构。火麻仁蛋白的最大发射波长(λmax)随着溶液酸性/碱性增强而略有红移,意味着部分色氨酸残基从疏水性强的内部向亲水性强的表面转移,蛋白质结构逐渐变得松散,原因是当pH值逐渐远离等电点时,静电斥力的加强导致蛋白质的聚集程度降低,部分色氨酸暴露在蛋白质分子表面。
在pH值逐渐接近等电点的过程中,荧光强度加强预示着色氨酸-色氨酸相互作用加强,表明了蛋白质聚集程度加强;当pH值接近等电点时,蛋白质的聚集程度达到最大,火麻仁蛋白的溶解度最低,进而导致荧光强度降低。在相同pH值条件下,HPI-SE的荧光强度高于HPI-AE的荧光强度,说明HPI-SE的色氨酸-色氨酸相互作用较HPI-AE更强,预示着它的蛋白质聚集程度较大。
3 结论
两种分离方法对火麻仁蛋白的氨基酸组成影响较小,二者氨基酸组成相似且均含有丰富的精氨酸;SDS-PAGE表明二者蛋白质组成均主要为火麻仁球蛋白。碱提/酸沉法得到的HPI-AE蛋白回收率高,但蛋白含量低,外观呈淡黄色;相反,盐溶/盐析法得到的HPI-SE蛋白回收率低,但蛋白含量高,外观呈亮白色。因而HPI-SE更适合掺入到高蛋白含量的食物中。研究证明蛋白质分离过程会影响火麻仁蛋白的功能性,二者虽具有相似的溶解性曲线,但是在相同pH值条件下,二者的溶解性存在较大的差异。试验发现蛋白质的起泡性/泡沫稳定性和蛋白质溶解性呈正相关,证实了良好的溶解性是蛋白质增强起泡性的前提。
文章摘自:徐鹏伟,刘家宁,常森林,王晓东,常坦然,于朝晖,赵庆生,赵兵.火麻仁蛋白的提取分离及理化性质研究[J].食品研究与开发,2021,42(03):97-104.
更多阅读
Copyright by Ramie Research Institute of Hunan Agricultural University
湖南农业大学农学院/苎麻研究所 版权所有 2009-2016 湘ICP备10006838号-1