摘 要:大麻二酚(CBD)具有广阔生物及药理活性,能够治疗癫痫,还可缓解焦虑和抑郁症状,在一些实验模型中,CBD表现出对精神分裂症症状的改善作用,对阿尔茨海默病也有潜在的治疗作用。CBD还具有镇痛、抗炎等医疗用途,在食品及保健品领域也具有探索性。但因其脂溶性强、水溶性差,限制了其在食品、化妆品、生物医药及农业等相关领域的应用。近年来,众多增溶技术被广泛研究用于改善CBD的溶解性。通过查阅大量国内外相关文献,对CBD增溶技术的研究进展为其更广泛的应用提供了可能,总结出可通过成盐法、改变晶型、减小粒径、固体分散体、溶剂体系、环糊精包合、微乳及脂质体8种技术来改善CBD的水溶性,提高生物利用度,但各技术仍面临诸多挑战,未来需进一步优化以推动CBD相关产品的开发与利用。
关键词:大麻二酚;增溶技术;生物利用度;药理活性;成盐法;减小粒径;固体分散体
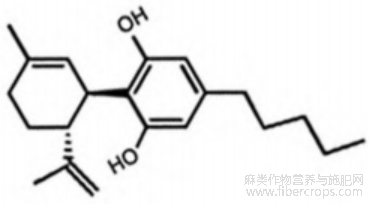
大麻二酚(Cannabidiol,CBD)是一种存在于大麻植物中的化合物,属于大麻素(cannabinoids)类别,其分子式为 C21H30O2,分子量为 314.46 g/mol,是一种非精神活性化合物(图 1)。大麻二酚呈白色晶体粉末状,不溶于水,易溶于有机溶剂,如乙醇、甲醇、氯仿等[1]。CBD 作为一种具有多种药理活性的天然化合物,其应用前景十分广阔,在医药领域,其具有神经保护、镇痛、抗炎、抗氧化及抗癫痫等多种药理作用。随着对其作用机制的深入研究,如北京理工大学团队发现 CBD 能与 GPR18 靶点蛋白的相互作用等,将为新型药物开发奠定基础[2]。在化妆品领域,可在美容店、零售店等多种渠道加以应用,用于改善皮肤状况等[3]。在食品领域,作为食品添加剂可应用于零食、补充剂、饮料等产品,市场规模呈增长态势。
图1 大麻二酚化学结构式
CBD 的分子结构比较复杂,主要由非极性碳氢基团组成,这导致其疏水性较强。水分子之间通过氢键相互吸引,而 CBD 分子与水的亲和力较弱,因此其在水中的溶解性差[4]。CBD 一般以结晶形态存在,这种紧密的晶体结构使水难以渗透并破坏其结构,进一步影响其溶解性。此外,CBD 分子中缺乏足够的极性基团,无法与水分子形成有效的氢键,这也是其水溶性差的原因之一 [5]。在药物研发中,药物的溶解性直接影响到其在体内的吸收和疗效,而 CBD 的溶解性差使得其生物利用度较低[6]。目前,许多药物都受到溶解度差的影响,特别是在新药的开发中。如何提高药物的溶解度,提高生物利用度已成为一个重要而紧迫的问题。在大量文献研究的基础上,本研究综述了 CBD 作为一种亲脂性化合物的增溶技术进展,以促进其在更多产品中的应用。基于常用的增溶方法有成盐,多晶型,减小粒径,固体分散体,添加剂,溶剂体系,环糊精包合,微乳,脂质体等[7]。
1 成盐法
汉成盐法的主要目的是将CBD与其他化学物质结合,形成盐的形式,从而便于后续的处理和应用。成盐的主要作用是增强CBD的稳定性,使其更易于存储和运输。某些盐形式还能提高CBD的水溶性,使其更加容易溶解在水中,方便作为溶液使用。常见的成盐试剂包括氯化钠(食盐)、硫酸镁等,这些试剂与CBD反应,形成可溶性的盐,反应条件(如温度、pH值和反应时间)会影响成盐的效率和产物的纯度[8]。在一些医药和化妆品产品中,成盐后的CBD盐作为活性成分使用,能够增强效果或改善产品的质地和稳定性。例如,CBD盐可以用于外用乳液或面霜的制备,提高皮肤的吸收率和疗效。成盐后的CBD盐应进行纯度和稳定性测试,以确保其符合相关标准和要求[9]。关于CBD成盐改善水溶性的研究有很多,例如,Ziegler等[10]通过Mitsunobu反应合成水溶性CBD衍生物。在这项研究中,CBD作为酸组分与多种醇类(如苯基、烯丙基、炔丙基和甲基乙酸盐)反应,生成了相应的双烷基化CBD衍生物。研究人员还研究了CBD与甲基溴乙酸酯反应,得到的酯化产物经过皂化处理后,形成了水溶性的CBD双乙酸双钾盐。这些反应为CBD衍生物的合成提供了新的方法,并为开发水溶性CBD化合物打开了新的可能性。Reddy等[11]探索了一种将CBD转化为阴离子CBD盐以提高其水溶性的合成方法。研究中合成了多种含有金属和铵反离子的CBD盐,合成的收率很高,介于74%到88%之间。
许多原本水溶性差的化合物,通过成盐反应可以形成离子型化合物,大大增加其在水中的溶解度,也提高其化学稳定性,使其对光、热、氧化等因素的敏感性降低,从而更易于储存和使用。成盐过程中,CBD的结晶性质往往会发生改变,通常更容易形成结晶,且结晶的纯度较高[12]。这有利于通过结晶的方法对CBD进行纯化,提高产品的质量和纯度,不同的盐形式可能会影响药物在体内的吸收速度和释放行为。通过选择合适的酸或碱进行成盐,可以根据药物的治疗需求,设计出具有特定吸收和释放特性的药物剂型,实现药物的长效缓释或快速起效等不同的药效目的[13]。但成盐反应可能会对CBD的化学结构和官能团产生影响,进而改变其生物活性。且并非所有的酸或碱都适合作为成盐试剂,不同的成盐试剂也会导致CBD形成不同的盐形式,这些盐在水溶性、稳定性、活性等方面可能存在差异,增加了筛选和优化的难度。成盐后的CBD在不同的pH条件下,其水溶性和稳定性可能会发生变化,需要考虑制剂的pH环境以及在体内的pH变化对药物溶解度和稳定性的影响[14]。成盐过程中,一些酸性或碱性较强的成盐试剂可能会对胃肠道等组织产生刺激作用,增加药物的不良反应发生率。
2 多晶型
CBD的化学结构是由21个碳原子、30个氢原子和2个氧原子组成的萜酚类化合物。其分子具有一定的刚性和柔韧性,分子中的苯环和烃链部分决定了其在晶体中的堆积方式。CBD晶体属于有机晶体范畴[15]。在有机晶体中,分子间作用力主要包括范德华力、氢键等。CBD分子之间可能通过范德华力进行堆积,形成三维晶体结构。其晶体结构可能是单斜晶系或者正交晶系等,具体的晶系取决于分子的排列方式和对称性。例如,在单斜晶系中,晶体的晶格参数具有特定的关系,通常有一个轴与另外两个轴不垂直。CBD分子在晶体中的紧密堆积方式可能是层状堆积或者柱状堆积。以层状堆积为例,分子的平面部分(如苯环结构)可能会相互平行排列,形成层状结构,层与层之间通过较弱的范德华力相互作用。这种堆积方式类似于一些芳香族化合物的晶体堆积,使得晶体结构相对紧密,减少了分子间的空隙[16]。“药物固体晶体”是指药物分子在三维空间中有组织的排列,从而形成具有特定几何结构的固体物质。固体结构包括非晶、多晶、盐和共晶结构[17]。多晶型现象在小分子药物中广泛存在,结晶形成不同形式可能由于溶剂、温度、冷却速度等结晶条件和静置挥发、搅拌、反溶剂添加等操作方式。不同的晶型导致晶格能的差异,从而影响药物的熔点、溶解速度和溶解度[18]。通常,稳态晶型的吉布斯自由能低、熔点高、溶解速度慢、溶解度小。因此通过选择适当的亚稳态晶型可以提高某些药物的溶解度[19]。弱电解质药物分子通过与酸碱配体形成离子键作用,这种生成的晶体盐溶于溶液中时,酸性或碱性的反离子被释放,从而改变溶液的pH,进而提高药物的水溶性[20]。目前,已有多种共晶药物成功上市,成为成盐或共晶技术应用的典范。在共晶技术的应用领域中,晨光生物科技集团股份有限公司获得了一项名为“一种次大麻二酚结晶多晶型物及其制备方法和应用”的专利[21],该专利涉及一种次大麻二酚结晶多晶型物及其制备方法和应用。该发明的次大麻二酚结晶多晶型物具有较好的热稳定性和常温储存稳定性,在高温条件下的晶体损失率较低,能够在室温下长期储存并保持较高的晶体含量,且具有较好的压力耐受性。使用低含量次大麻二酚原料即可制得高纯度的次大麻二酚晶体,方法适用范围更加广泛,更适于进行大规模生产。
分子的排列方式、晶格参数和分子间作用力等方面形成的不同晶型会对药物的水溶性等性质产生不同影响,通过选择不同的晶型,可以调节药物的释放速度,以满足不同的临床需求。一般来说,具有较高分子间空隙、较弱分子间作用力的晶型在溶剂中的溶解度相对较好。对于一些需要快速起效的药物,可以选择水溶性较好的晶型;而对于像CBD这种需要长效缓释的药物,则可以选择水溶性相对较低、溶解速度较慢的晶型,从而实现药物的缓慢释放,延长药物的作用时间。非晶态的CBD通常比晶态的CBD具有更高的溶解度和更快的溶解速度,这是因为非晶态缺乏规则的晶体结构,分子间作用力较弱,溶剂分子更容易进入并溶解物质。但多晶型在储存或制备过程中可能会发生晶型转变,尤其是亚稳定型晶型容易向稳定型晶型转变,从而导致药物的水溶性降低。由于结晶条件等不稳定因素而导致不同批次的药物之间会存在差异性,因此药物多晶型的存在增加了药物的研发和质量控制的复杂性。
3 减小粒径
减小粒径常用方法包括纳米沉淀法、超声法、高压均质法和研磨法等。如纳米沉淀法使用乙醇作为有机溶剂溶解CBD,然后将溶液滴加至含有泊洛沙姆等稳定剂的水溶液中,通过搅拌、旋蒸等操作控制溶剂扩散速率和药物沉淀过程,制备出纳米级颗粒的CBD混悬液[22]。Stukelj等[23]利用水解反应将CBD的酯基转化为酸基,制备稳定的CBD纳米颗粒。以CBD的双乙酸酯衍生物为例,首先通过与溴乙酸甲酯反应进行烷基化,得到相应的酯化产物。随后,使用碱性溶液(如氢氧化钾)对酯基进行水解,生成二羧酸衍生物。水解后的产物通过进一步的中和反应,与氢氧化钾反应生成二钾盐,这种二钾盐具有较高的水溶性。由于钾盐的离子化特性,它能够在水中形成稳定的溶液,从而提高CBD的水溶性。此外,通过这种方法合成的水溶性CBD衍生物在水中的溶解度可以达到60%,这对于提高CBD的生物利用度和应用潜力非常重要。这些水溶性衍生物可以在药物制剂中发挥更好的效果,尤其适用于口服给药或静脉注射的情况。超声法则利用超声波的空化效应和机械作用,将CBD与适当溶剂混合后置于超声设备中。在超声波的强烈冲击和剪切力作用下,CBD颗粒逐渐破碎并形成粒径更小的分散液。通过调节超声功率、处理时间和温度等参数,进一步优化粒径的减小程度。高压均质法通过将CBD粗混悬液置于高压均质机中,施加高压并进行多次均质循环,有效减小粒径并提高颗粒均一性。在高压作用下,CBD溶液通过狭窄的均质阀,经历高速撞击、剪切和空穴等过程,从而将大颗粒破碎为小颗粒,同时使颗粒分布更加均匀[24]。研磨法则通过CBD与适量的玻璃珠或氧化锆珠一同置于球磨机中,进行长时间研磨。在研磨介质的摩擦、碰撞和剪切力作用下,CBD颗粒逐渐被破碎为粒径较小的粉末[25]。
控制粒径大小能够影响CBD增溶技术的应用,国外研究人员通过工程化细胞外囊泡负载CBD,开发了一种脑靶向药物递送系统[26]。该系统不仅能够有效将CBD输送至大脑,还显著提高了其生物利用度。在此过程中,CBD粒径的控制起到了关键作用。研究团队使用NanoCoulter单颗粒分析仪对该系统的粒径和电位进行表征,从而验证CBD粒径变化的可控性及药物递送系统的有效性。这项研究代表了CBD粒径控制技术的前沿应用,能解决CBD的生物利用度的问题,为CBD在神经疾病治疗中的潜在应用提供了新的研究思路[27]。在国内,部分研究机构或和企业也在探索CBD的加工过程。例如,采用微射流处理技术来减小CBD的粒径,通过粒径控制技术优化CBD的加工工艺,使含有CBD的溶液高速通过微小的通道,产生强烈的剪切力、撞击力以及和空化效应等,这些力共同作用使CBD颗粒破碎变小并减小粒径。这种方法能够实现较精准的粒径控制,对于提高CBD的应用效果具有重要意义[28]。采用超声处理法也可以用于减小CBD的粒径,将CBD溶解在有机溶剂中,然后利用超声波产生的交替疏密振动形成的空化泡,这种空化泡在瞬间破裂时,会产生局部高温、高压以及强烈的冲击波和微射流,从而作用于CBD颗粒,使其破碎进而减小粒径[29]。使粒径减小还可以使用纳米载体增溶技术,该技术通过将药物分子负载于纳米尺度的载体材料中,通过改变药物的存在状态和物理化学性质,从而提高药物的溶解度和生物利用度。介孔二氧化硅是一种理想的纳米载体材料,药物分子可以通过物理吸附作用进入介孔二氧化硅的孔道内,从而显著增加药物与溶剂的接触面积。姜瞻梅等[30]公开提出了一种基于介孔二氧化硅纳米颗粒的CBD负载技术及其制备方法。研究表明,介孔二氧化硅具有较大的比表面积和较高的孔隙率,能够为CBD分子提供大量的吸附位点,使其均匀地分散在介孔二氧化硅的孔道内,从而增大了CBD与溶剂的接触面积,有利于CBD分子从制剂中快速溶出。减小粒径可以提高药物的比表面积,增强分散性,也有利于药物穿透生物膜等屏障,实现更好的吸收效果,但粒径减小后,颗粒的表面能会增加,导致其稳定性变差,药物的保存及运输难度也随之增加。
4 固体分散体
在制药领域中,固体分散体通常是由药物和聚合物组成的混合物,因为不再需要能量来破坏晶格,其分子能够更容易地与周围的溶剂相互作用[31]。常用的载体包括聚乙烯吡咯烷酮(PVP)、聚乙二醇(PEG)以及吸附在药物表面的表面活性剂等等。Asati等[32]通过喷雾干燥法,利用亲水性聚合物制备了阿哌沙班的固体分散体,显著提高了其在水中的溶解度。吴东旭等[33]发现PVP K25这种聚合物能够显著提升阿司匹林的溶解度。PVP与阿司匹林之间具有较强的氢键相互作用,且聚合物对阿司匹林的增溶能力随着温度和聚合物辅料浓度的升高而逐渐增强。Andriotis等[34]通过电纺技术将CBD和大麻萜酚(CBG)与聚合物载体结合,显著改善了其溶解性。在电纺过程中,选用PVP和Eudragit L-100等聚合物,这些聚合物能够在药物中形成非晶态固体分散体(ASD),使CBD和CBG成功地包裹在电纺纤维中,形成均匀的纳米纤维。这些纤维的高表面积和多孔结构有助于药物的快速溶解,提高其生物可利用度,适用于口服给药系统。Koch N等[35]采用热熔挤出(HME)法制备CBD与ASD的混合物,研究者测试了多种聚合物,包括乙烯基吡咯烷酮-乙酸乙烯酯共聚物Kollidon®VA64(KVA64)、共聚物增溶剂Soluplus®(SOL)和聚乙烯吡咯烷酮聚合物Kollidon®12PF(K12PF),CBD与上述聚合物的二元混合物进行预混合,利用共转子双螺杆热熔挤出机(L/D=40)进行加工,通过挤出过程将CBD与聚合物熔融混合并快速冷却,形成无定形固体分散体。结果显示,Kollidon®VA64作为载体能显著提高CBD的溶解度,其溶解度在15 min内可达100µg/mL,并在2 h内保持稳定。通过合理选择辅料和溶剂,可以有效解决难溶性药物的增溶问题。为了保证CBD能以良好的分散状态存在于载体中,并且实现较好的增溶等效果,固体分散体中的载药量往往不能太高。如果载药量过高,可能会导致CBD分散不均匀,出现团聚等情况,反而影响CBD的溶解度和溶出速率等性能。
5 溶剂体系
潜溶剂存在于特定比例的混合溶剂中,通过任意比例混合的两种溶剂分子之间能形成氢键并增加它们的介电常数来提高难溶性药物的溶解度。低共熔溶剂(DES)作为新型绿色溶剂,是由氢键的供体和受体按一定比例组成以非共价键相结合的低共熔混合物[36]。离子液体(ILs)是完全由离子组成的液体,是低温下呈液态的盐,也称为低温熔融盐,它一般由有机阳离子和无机阴离子所组成[37]。Balenzano等[38]开发一种新型DES,该溶剂以羟丙基-β-环糊精(HP-β-CD)为基础,通过协同溶解提高药物的溶解度。研究人员对环糊精的超分子深共熔溶剂(CycloDES)进行了物理化学表征,并将其与CBD进行复合,评估了不同因素对药物溶解度和透过性的影响。HP-β-CD通过其环状分子结构,与CBD形成氢键作用,从而显著提升CBD的溶解度和稳定性。通过这种复合,CycloDES这种溶剂体系不仅提升了药物的溶解度,还能在水溶液稀释时维持较高的药物浓度,克服了传统溶剂系统的溶解度限制,显示了其作为药物传递系统的潜力。Franco等[39]针对CBD在加热、微波辐射、布朗斯特酸和路易斯酸以及光化学条件下的稳定性进行了研究,重点考察了甘油和丙二醇等常用于CBD配方中的有机溶剂对其稳定性的影响。研究结果表明,CBD在实际药物制剂和商业产品(如电子烟液)中表现出较低的稳定性。这些研究为CBD在不同环境中的稳定性及其降解机制提供了重要参考。多数有机溶剂具有较低的极性,能够与疏水性药物分子产生较强的相互作用,从而显著提高疏水性药物的溶解度,如乙醇、丙二醇、甘油等对一些难溶性药物有较好的增溶作用[40]。通过选择不同种类和比例的有机溶剂,可以调节CBD在溶剂中的溶解速度和扩散速度,进而控制药物的释放速率,实现药物的缓控释效果。但大多数溶剂都具有毒性和刺激性,不仅成本高,且限制它们在药物制剂中的应用范围。
6 环糊精包合
首先,难溶性药物与环糊精(CD)形成包合物后,药物分子被包合于CD分子的空腔中。由于包合物不仅具有良好的可润湿性,且能提高药物分散度,因此其体外溶出特性和人体生物利用度也从而得到改善[41]。CD是一类具有亲水性表面和疏水性空腔的环状寡糖,具有高度的水溶性。其空腔可与疏水性溶质相结合形成包合物,从而增大溶质的溶解度。此外,CD包合还可能改变吸收部位的脂质屏障,这主要是因为CD可与胆固醇、磷脂和蛋白质等膜成分形成复合物,从而改变脂质屏障的通透性。Rawat等[42]用β-环糊精(β-CD)包合塞来昔布,溶解度和溶出速度均得到提高。杨彩琴等[43]利用羟丙基-β-环糊精(HP-β-CD)对格列齐特进行包合,HP-β-CD是一种具有广阔前景的优良药用辅料,其不仅水溶性高,对肾、肌肉和黏膜几乎无刺激,作为药用辅料主要用作增溶剂、稳定剂和促渗剂等。口服降糖药格列齐特也是难溶性药物,几乎不溶于水,生物利用度极低[44]。因此用HP-β-CD对格列齐特进行包合,当HP-β-CD浓度为0.24 mol时,其溶解度为原溶解度的8.63倍。Lv等[45]研究了利用3种天然CD与CBD制备包合物,并对其物理化学性质进行了表征。结果显示,CBD可以通过CD的分子结构形成稳定的包合物,显著提高了CBD的水溶性和抗肿瘤活性。在细胞毒性方面,CBD与CD形成包合物后,对正常人类肺细胞MRC-5的毒性明显降低。
其次,当药物与CD形成微聚集体或药物环糊精复合物时,即使没有形成包合物,也可以对药物产生增溶效果。在这种状况下,加入水溶性聚合物或可解离的分子能够进一步增加药物的溶解度,同时使复合物更加稳定。Captisol技术[46]是通过硫代丁基醚-β-环糊精(7M-β-CDs,SBE)与难溶性药物形成复合物来增强其水溶性,然后制成用作口服、吸入或者注射剂型。这种技术可以提高药物的生物利用度以及难溶药物的溶解度。Changsan等[47]研究了CBD鼻用喷雾剂的开发与评估。CBD通过与大麻素受体CB1和CB2结合,可能通过减轻炎症过程而发挥抗炎作用。采用β-CD与CBD按1:1的化学计量比复合,并通过聚氧化烯形成聚合物胶束,从而制备了水溶性CBD。
最后,对于CD包合技术对CBD进行增溶时,CD的空腔大小是有限的,对于CBD可能无法完全包合或者只能包合一部分药物分子。这就限制了其载药量,对于需要高剂量给药的药物,可能需要使用大量的CD来包合,这不仅不经济,还可能会影响药物的其他性质。尽管CD本身一般被认为是相对安全的,但在高剂量使用或者长期使用的情况下,可能会产生一些潜在的安全性问题。例如,大量的CD进入人体后,可能会影响人体的正常生理功能,如对肠道菌群的影响等。
7 微乳
微乳作为一种新型药物载体,因其粒径小、制备工艺简单,尤其在口服难溶性药物的应用中,能显著改善生物利用度,因而在药物传递领域的应用日益广泛[48]。微乳液是由油相、水相、表面活性剂和助表面活性剂按适当比例自发形成的透明或半透明、低黏度、热力学稳定的均质液体体系,其粒径范围通常在1~100 nm之间。药物制成微乳制剂后,体内的生物利用度和稳定性均有所提高。Agnieszka[49]研究探讨了纳米乳液作为递送载体,尤其是油/水型纳米乳液中包裹CBD油相的制备方法。研究采用了超声法和两级高压均质法两种制备技术。用超声法制备的纳米乳液纳米粒径范围为216~1418 nm,而均质法得到的纳米乳液粒径范围为128~880 nm,且随着表面活性剂比例的增加,纳米乳液的Zeta电位值也有所提高。因此CBD纳米乳液具有良好的生物相容性,能够有效减少皮肤褪色并提高皮肤水合作用。Sabrina等[50]通过CBD从三月桂酸甘油酯(trimyristin)纳米乳液转移到含脂质的水凝胶微球中。通过纳米乳液中的脂溶性药物转移到含脂肪的藻酸盐微球的过程是通过扩散机制进行的,这些微球充当了脂溶性药物的“接收器”,通过其内嵌的脂质相与外部水相之间的浓度梯度,药物开始从乳液中迁移到微球内的脂肪相中。藻酸盐微球中的脂质相提供了一个扩散屏障,使得药物通过水相扩散进入微球脂质相的过程较为缓慢。此外,微球的尺寸和脂质含量对药物的转移也有重要影响。通过微滤步骤分离供体和受体系统,可以有效测量药物的转移量,提供了高时间分辨率的转移研究结果。通过调整微乳的组成和结构,可以实现药物的缓释[51]。但微乳中的表面活性剂和助表面活性剂可能会对人体产生毒性。一些表面活性剂在高浓度时可能会刺激皮肤和黏膜,或者对人体的细胞和器官功能产生不良影响。如果微乳在体内释放出大量的表面活性剂,可能会引起不良反应,尤其是在长期或高剂量使用微乳制剂的情况下。
8 脂质体
脂质体是指一种由磷脂和胆固醇构成的封闭囊泡,这种双分子层结构使其在药物传递中具有显著优势。包括增强靶向性、提高稳定性、提升疗效以及降低药物毒副作用等[52]。Francke等[53]研究了CBD在胶体脂质载体中的加工特性。在中链甘油三酯、菜籽油、大豆油和三月桂酸三酯乳液中,CBD的负载量可以达到非常高的水平,同时增加了颗粒的粒径和脂质基质的密度。Silvia等[54]使用的纳米载体是“药物-微胶束-脂质体”(DiMiL)系统。该系统结合了微胶束和可变形脂质体的特点,可以将CBD分别封装在脂质体的内核和双层膜中。这种载体不仅提高了药物的皮肤穿透能力,还确保了它们在皮肤中的深层积聚,有助于靶向神经纤维中的受体,从而实现更有效的深部疼痛缓解。
脂质体能够保护CBD免受外界环境因素的影响。如在胃肠道环境中,CBD容易受到胃酸、酶等因素的破坏而失去活性。脂质体包裹后,可以防止CBD与这些不利因素直接接触。Huang等[55]使用婴儿配方奶粉作为一种固体脂质剂型来提高CBD在儿童患者中的口服生物利用度。大麻素加入到这种配方奶粉中能够有效缓解儿童患者因癫痫等引起的有害心理状况。在牛奶和婴儿配方奶粉中,CBD的口服生物利用度提高了两倍。于鹏[56]通过分析脂质体膜材料的选择、食品基质的理化特性及加工条件等因素,探讨了影响CBD脂质体稳定性的各种因素。研究提出了优化脂质体膜组成、改善食品基质兼容性,以及控制加工温度和剪切条件等策略,旨在为开发高稳定性的CBD功能性食品提供理论依据。这项研究的成果将推动CBD在食品行业的应用,拓展其在功能性食品中的潜力。但是脂质体在储存和使用过程中可能会出现聚集、融合、沉降等物理稳定性问题。当脂质体溶液的浓度较高或者电解质浓度发生变化时,脂质体颗粒之间的静电斥力会减小,导致它们相互聚集。温度也会对脂质体的稳定性产生影响,高温可能使脂质体的磷脂双分子层流动性增加,甚至破裂,而低温则可能导致脂质体的冻结和结构破坏,这些都会影响CBD的增溶效果和产品质量。
9 结论与展望
CBD水溶性差的主要原因在于其分子结构的疏水性。CBD分子缺乏极性基团,不能有效与水分子形成氢键,因此水分子难以渗透并溶解其晶体结构。此外,CBD通常以结晶形态存在,结晶的紧密结构进一步阻碍了水的渗透,导致其在水中的溶解度非常低。这种低溶解性直接影响了CBD的药效和生物利用度。为了提高CBD的溶解度,近年来,研究者们探索了多种增溶技术,通过广泛查阅相关资料后,将其概括为成盐与共晶技术、粒径减小、固体分散体、脂质体和微乳以及环糊精包合,并详细阐述了各种方法在大麻二酚CBD增溶领域的进展。不同的增溶方式也存在不同的问题,例如成盐法,通过形成盐类增加水溶性,适用于水溶性要求高的制剂。但盐的稳定性较差,可能受pH和温度的影响。微乳和脂质体这类方法能够有效提高CBD的生物利用度,尤其是在肠道吸收方面表现突出。微乳能提供较小的粒径和高的溶解度,但在稳定性和制备成本上存在挑战。脂质体能增加药物靶向性并降低毒性,但制备过程复杂且成本较高。固体分散体将CBD以无定形形式分散于水溶性载体中,能够显著提高溶解度和生物利用度。其缺点是稳定性较差,且在高温下易降解。环糊精包合技术通过环糊精与CBD形成包合物,显著提升其水溶性,减少毒性并改善药物吸收。然而,包合物的制备需要精确控制,且可能会影响药物的释放行为。总体而言,这些方法能够有效解决CBD的溶解性问题,但在实际应用中,需要根据具体需求选择合适的增溶策略,以实现大麻二酚的应用价值最大化。
参考文献
[1]Kong J M,Shen Y.Yunnan Chem.Ind.,2019,46(8):4.孔剑梅,沈琰.云南化工,2019,46(8):4.
[2]Wen Z,Yifei W,Rui G,Hongliang W,Mingjia Y.J.Med.Chem.,2024,67(16):14574-14585.
[3]Niu K X,Zhao X,Lian J.Analytical Lab.,2023,42(10):1386-1394.牛可歆,赵霞,廉洁.分析试验室,2023,42(10):1386-1394.
[4]Su Y T,Cai B G,Zhang J.Chin.Mod.Appl.Pharm.,2022(6):39.粟艳婷,蔡宝国,张健.中国现代应用药学,2022(6):39.
[5]Song Y F,Wan F,Cheng B,Gao T,Qi Y Y,Zhang WQ, Xie W D. Adv. Mod. Biomed.,2023,23(8):1410-1415.宋云飞,万方,程辟,高童,戚媛媛,张婉秋,谢伟东.现代生物医学进展,2023,23(8):1410-1415.
[6]Kalepu S,Nekkanti V.Chin.J.Pharm.Sci.(Engl.Ed.),2015(5):12.Kalepu S,Nekkanti V..药学学报:英文版,2015(5):12.
[7]Chen M,Huang L.Zhejiang Chem.Ind.,2021,52(6):4.陈旻,黄亮.浙江化工,2021,52(6):4.
[8]Kong X B,Zhang L X,Chu W H,Liu Y,Han R D.Mod.Agric.,2022(12):38-42.孔祥彬,张连晓,初文红,刘英,韩瑞东.现代化农业,2022(12):38-42.
[9]Chen L C,Yang Z H,He Q X,Huang H H,Song X Z.Deterg.Cosmet.,2020(1):20-24.陈来成,杨占红,何秋星,黄浩寒,宋相志.日用化学品科学,2020(1):20-24.
[10]Ziegler T,Cosky E..ARKIVOC,2020,2021(4):198-205.
[11]Reddy P G,Bar-Hai A,Hoffman A,Feldmann S M,Domb A J.Bioorg.Chem.,2023,141:106914.
[12]Zhang X,Wang J B,Zhang H.Chem.Eng.Manage.,2023(1):149-151.张霞,王建斌,张辉.化工管理,2023(1):149-151.
[13]Liu Y.Molecules,2024,29(15):3571.
[14]Cui Y,Jie W Q,Gao J N,Zha G Q,He J B.J.Funct.Mater.,2009,40(2):197-200.崔岩,介万奇,高俊宁,查钢强,何鉴波.功能材料,2009,40(2):197-200.
[15]Liu Y.Preparation and properties of cannabidiol modified acrylic fluoride/boron antifouling coatings.Harbin Engineering University,2023.刘苑.大麻二酚改性丙烯酸氟/硼防污涂层的制备及性能研究.哈尔滨:哈尔滨工程大学,2023.
[16]Xu Q,Mao Y N,Kang C X,Gao P,Yang Y.China Oils Fats,2024,49(3):125-131.许晴,毛燕妮,康翠欣,高盼,杨永.中国油脂,2024,49(3):125-131.
[17]Morissette S L,AlmarssonÖ,Peterson M L,Remenar J F,Read M J,Lemmo A V,Ellis S,Cima M J,CR Gardner.Adv.Drug Delivery Rev.,2004,56(3):275-300.
[18]Liang L,Li Y G,Guo Q H,Lou B Y.Chin.Herb.Med.,2024,55(11):3659-3667.梁玲,李延广,郭全虎,娄本勇.中草药,2024,55(11):3659-3667.
[19]Steed J W.Trends Pharmacol.Sci.,2013,34(3):185-193.
[20]Du Y K,Wang L F,Kang X,Pan Z H,Dang Y J.Chin.Pharm.,2024,27(6):969-974.杜宇坤,王立夫,康鑫,潘振华,党云洁.中国药师,2024,27(6):969-974.
[21]CN202211037746.0.晨光生物科技集团股份有限公司.2022-11-25.CN202211037746.0,Chenguang Biotechnology Group Co.,LTD.,2022-11-25.
[22]Caggiano N J,Wilson B K,Priestley R D,Prud'Homme R K.Mol.Pharmaceutics,2022(5):19.
[23]Tukelj R,Benina M,Fanetti M,Valant M,Kralj-Igli V.Mater.Tehnol.,2019,53(4):543-549.
[24]Karabulut G,Kapoor R,Yemis O,Feng H.Food Hydrocolloids,2024,150:109661.
[25]Li C,Xu D Q,Wang J F,Qin S Y,Xin G B,Wang Y Y.Sci.Technol.Eng.,2019,19(28):5.李超,徐多麒,王继芬,覃士扬,辛国斌,王燕燕.科学技术与工程,2019,19(28):5.
[26]Li Y,Chen Z,Guo J,Meng D,Pang X,Sun Z,Pu L,Yang S,Yang M,Peng Y.Biochem.Biophys.Res.Commun.,2024,725:150260.
[27]Desnous B,Beretti T,Muller N,Neveu J,Villeneuve N,Lépine A,Daquin G,M Milh.Epilepsia Open,2024,9(1):397-403.
[28]Song S,Guo J,Chen X,Xu E Y,Jiang J F,Jin Q F,Li H Y.Chin.J.New Med.,2013,22(20):5宋爽,郭静,陈曦,徐恩宇,姜俊峰,靳奇峰,李浩莹.中国新药杂志,2013,22(20):5
[29]Lu X L,Guo W L,Wang X K.Chin.PowderTechnol.,2004(1):5.卢小琳,国伟林,王西奎.中国粉体技术,2004(1):5.
[30]CN202210696889.6.东北农业大学.2022-09-30.CN202210696889.6.Northeast AgriculturalUniversity.2022-09-30.
[31]Gao X J,Li Z M,Ma Y C,Li Y D,Yu X Y,Yu S,
Xue F M. Shandong Chem. Ind., 2022,51(23):100-102.高绪洁,李梓铭,马源昌,李跃东,于小颖,于帅,薛富民.山东化工,2022,51(23):100-102.
[32]Asati A V,Salunkhe K S,Chavan M J,Chintamani R B,Singh R P.Int.J.Pharm.Invest.,2020(4).
[33]Wu D X.Experimental and theoretical study on solubilization of aspirin and berberine.南京:Southeast University,2020.吴东旭.阿司匹林和黄连素增溶的实验及理论研究.南京:东南大学,2020.
[34]Andriotis E G,Chachlioutaki K,Monou P K,Bouropoulos N,Fatouros D G.AAPS PharmSciTech,2021,22(1):23.
[35]Koch N,Jennotte O,Gasparrini Y,Vandenbroucke F,Evrard B.Int.J.Pharm.,2020,589:119812.
[36]Bai J L,Yan T F,Gu J C,Zhang Y T,Li X L.Ind.Catal.,2024,32(9):26-32.白佳乐,燕童凡,谷嘉诚,张琰图,李雪礼.工业催化,2024,32(9):26-32.
[37]Wenzhuo W,Kai S,Fengmao L,Yuke L,Qingrong P,Yangyang G.J.Mol.Liq.,2020,300:112260.
[38]Balenzano G,Racaniello G F,Arduino I,Lopedota A A,Lopalco A,Laquintana V,Denora N.Int.J.Pharm.,2023,647:123553.
[39]Franco C,Protti S,Porta A,Pollastro F,Profumo A,Mannucci B,Merli D.Results Chem.,2022,4:100465.
[40]Qin C K.Chem.Reagents,2011,33(11):4.秦承宽.化学试剂,2011,33(11):1029-1032.
[41]Li H L,Yin D D,Wang X L.Tianjin Pharm.,2010,22(1):8.李华龙,尹东东,王杏林.天津药学,2010,22(1):8.
[42]Rawat S,Jain S K.Eur.J.Pharm.Biopharm.,2004,57(2):263-267.
[43]Yang C Q,Wang W,Zhan W H.Chin.J.Anal.Sci.,2004,20(3):2杨彩琴,王伟,詹文红.分析科学学报,2004,20(3):2.
[44]Aggarwal S,Singh P N,Mishra B.Die.Pharm.azie.,2002,57(3):191-3.
[45]Lv P,Zhang D,Guo M,Liu J,Chen X,Guo R,Xu Y,Zhang Q,Liu Y,Guo H.J.Drug Delivery Sci.Technol.,2019,51:337-344.
[46]Ji X Y,Wei X L,Lian T T,Jin Q R.J.Agron.,Yanbian Uni.,2024,46(2):45-52.嵇欣雨,魏霞丽,练婷婷,金庆日.延边大学农学学报,2024,46(2):45-52.
[47]Changsan N,Sawatdee S,Suedee R,Chunhachaichana C,Srichana T.Int.J.Pharm.,2023,640:123035.
[48]Xie X L,Hu X,Huang Y,Wang K,Wang D,Yu F L.Daily Chem.Ind.,2024,54(10):1201-1210.谢小丽,胡璇,黄英,王凯,王丹,于福来.日用化学工业,2024,54(10):1201-1210.
[49]Agnieszka L ewińska.Processes,2021,9(7):1180.
[50]Knoke S,Bunjes H.Pharmaceutics,2021,13(2):173.
[51]Li Y.Study on construction and controlled release of supramolecular gel drug carrier enhanced by microemulsion supramolecular gelation and hybridization.Wuhan:Huazhong university of science and technology,2016.
文章摘自:刘佳莹.大麻二酚增溶技术进展[J/OL].化学试剂,1-9[2025-03-10].https://doi.org/10.13822/j.cnki.hxsj.2024.0487.