摘 要:低温是限制工业大麻地理分布范围和麻籽产量及品质的关键因素。研究以籽用型工业大麻品种“龙大麻9号”为试验材料,对其幼苗进行1~7d的4℃低温胁迫处理(25℃为对照),并对低温胁迫下工业大麻幼苗生长和生理指标进行测定,结果表明:低温胁迫导致植株生物量积累及叶绿素含量降低,抑制工业大麻生长,总鲜重下降29%~37%,总干重下降17%~22%。随低温胁迫时间延长,大麻幼苗叶片膜透性增大,相对电导率在处理7d时升至75.7%;离子渗透及膜脂过氧化水平加剧,渗透调节物质增加,在处理3d时可溶性蛋白含量是对照组的1.5倍,于处理7d时,可溶性糖含量增加75%,脯氨酸含量为对照组的1.2倍;细胞活性氧在叶片中积累增多;丙二醛含量在整个处理时期始终上升,在处理后期上升速率有减缓趋势,可在一定程度缓解胁迫造成的损伤。在响应低温胁迫过程中,工业大麻主要通过渗透调节物质增加及抗氧化酶活性提升,从而缓解低温胁迫对植物细胞造成的损伤。以上为阐明工业大麻低温胁迫的响应机制提供重要的理论依据。
关键词:低温;工业大麻;生理指标;响应机制
大麻是人类历史上最早被驯化的植物之一,长期以来作为纤维、食物和药物的重要来源而被广泛种植[1]。郑玄注《周礼·天官·疾医》中将工业大麻列为五谷(麻、黍、稷、麦、豆)之首。然而,长期以来大麻因其毒品属性而被禁用。近年来伴随工业大麻概念的提出,极大推进了大麻全球合法化进程[2-3]。工业大麻是指植株群体花期顶部叶片及花穗干物质中的四氢大麻酚(THC)含量<0.3%,不能直接作为毒品利用的大麻作物品种类型-中华人民共和国农业行业标准(NY/T3252.1-2018)。工业大麻富含天然抗氧化物及生物活性物质,具有广泛的药用和食用价值[4]。目前,在世界范围内已有30余个国家开始工业大麻合法化,并大面积种植、开发和利用工业大麻[2]。世界范围内对工业大麻的需求日益增加,促使工业大麻种植区域不断向高海拔、高纬度地区扩张。在工业大麻种植区域由热带、亚热带向高海拔、高纬度地区扩张时,麻籽产量及品质易受不利环境影响,严重制约工业大麻产业发展[5]。
温度是影响作物地理分布、产量和品质的主要环境因素,与麻籽脂肪酸、蛋白质等营养成分的含量密切相关[6]。在整个生长季节,农作物经常遭受各种类型的环境胁迫。作为主要的非生物胁迫之一,低温对植物的生长和发育具有负面影响。作物生长初期冷害影响其建立足够的群体,并导致植株黄化和死亡[7]。此外,低温胁迫会扰乱植物的生理活动,如水分状况、光合作用和氮代谢[7]。然而,在长期的进化过程中,植物已经进化出了耐受低温胁迫的复杂机制。植物细胞可通过积累渗透调节物质如脯氨酸、可溶性糖和可溶性蛋白,以及增加抗氧化酶包括过氧化氢酶 (CAT)、超氧化物歧化酶 (SOD)和过氧化物酶 (POD)的活性来提高其低温耐性[7]。这些生理变化有助于维持细胞稳定性和活力,防止活性氧的损伤,并维持细胞膜和蛋白质结构的稳定性[8]。因此,解析植物生长发育早期低温胁迫下的生理响应特性,有助于了解植物对低温逆境的响应机制。
黑龙江省作为全国合法开放性种植工业大麻的两个区域之一,地理纬度较高,是东北三省低温冷害最强、频率最高的省份,工业大麻幼苗在春季经常遭受低温的侵袭,影响其麻籽的产量及品质。然而,目前对于工业大麻低温胁迫响应机制少见报道。鉴于此,本研究拟对低温胁迫下工业大麻生理指标进行测定,明确低温胁迫下工业大麻的生理响应模式,尤其是与脂质代谢相关的生理指标,如膜脂过氧化程度、电解质渗透率、渗透调节物质以及叶绿素含量等指标。本研究将为提高工业大麻麻籽产量及品质,提升工业大麻耐低温能力提供数据支撑。
1 试验材料与方法
1.1 材料及试验设计
本试验采用实验室自育籽用型工业大麻品种“龙大麻9号”,选择大小相同、饱满、健壮的种子,10%次氯酸钠灭菌20 min后用蒸馏水反复冲洗3次,无菌水浸种12 h,春花后于22℃避光催芽2 d后,挑选萌发状态一致的幼苗分别移于水培箱进行培养,水培箱内装有1/80的Hoagland营养液,每周更换1次营养液。置于光照培养箱内进行培养,昼夜温度分别为25℃和20℃,光照强度为20000 lx,湿度为70%。待幼苗长至4对真叶期进行4℃处理,正常培养为对照,每个处理设3次重复。分别于低温处理0、1、3、5和7d每组样品选取生长状态一致的10株工业大麻幼苗,将其地上与地下部分离,采用直尺对其株高、根长进行测量(以植物生长基部为分界,植株基部到生长点的长度为株高,基部到根尖为根长),采用分析天平对其重量进行测定记录。然后,置于烘箱105℃,15min进行杀青,于80℃下烘干至恒重,称取干重。并分别于处理0、1、3、5和7d取样,每个样本取三个植株混为一个样本,剪取工业大麻第二叶片置于液氮速冻,于-80℃进行保存,以备后续生理指标的测定。
1.2 生理指标测定
工业大麻光合指标采用多功能植物光合表型测量系统PlantExplorerPro+于低温处理0、1、3、5和7d进行无损检测,每个时间点测量5株植株冠层数据,最终数值结果取平均值[9]。叶片相对含水量按王士梅等[10]的描述进行测定。相对电导率采用电导率仪(DDSJ-308F,上海,中国)进行测定,操作步骤为:称取0.3g工业大麻叶片于10mLddH2O中,真空泵抽气沉淀组织,室温下保持30min后测定初始电导率,随后沸水浴保持5min。冷却室温后再次测定电导率,每处理3次重复,用电导仪测定浸提液的电导率(R1),然后将浸提液进行沸水浴加热30min,冷却至室温后摇匀,再次测定浸提液电导率(R2),计算相对电导率(相对电导率=R1/R2×100%)。采用硫代巴比妥酸法测量丙二醛(MDA)含量[11],取0.3g工业大麻叶片样品冰浴研磨,与2mL5%三氯乙酸(TCA)涡旋振荡混匀后倒入50mL离心管中,取TCA溶液稀释至5mL,4500r/min离心10min后取上清。上清液2mL中加入0.67%硫代巴比妥酸(TBA)2mL,充分混匀,沸水浴30min,冷却室温后以10000r/min离心20min,分别于450nm、532nm和600nm处测定上清液的吸光度值,计算MDA含量,具体公式为:MDA浓度(µmol/L)=6.45×(A532-A600)-0.56×A450。叶绿素(Chl)含量的分析参照Li等[12]人描述,取0.2g样品,加入95%乙醇10ml,快速充分研磨,分别在663和645nm下测定吸光度值,计算最终含量,具体公式为:叶绿素总量(mg/g)=0.01×(20.21×A645+8.02×A663)×D÷m。可溶性糖(蒽酮比色法)、可溶性蛋白(分光光度法)、脯氨酸(磺基水杨酸法)、过氧化氢(分光光度法)含量以及抗氧化酶活性,包括SOD、POD及CAT(分光光度法)均采用试剂盒进行测定。
3,3-二氨基联苯胺(DAB)染色:分别取低温胁迫处理0和7d的工业大麻植株下部的中间叶,置于50mL离心管中,加入25mLDAB染色液,于室温染色过夜后用脱色液沸水浴脱色,直至对照叶片变白为止,拍照观察。
1.3 试验试剂及耗材
试验所用试剂均为国产分析纯,试剂盒及相关耗材均为北京索莱宝科技有限公司产品,包括:蛋白浓度测定试剂盒 (PC0020),植物可溶性糖含量检测试剂盒 (BC0035),脯氨酸(Pro)含量检测试剂盒 (BC0290),过氧化氢(H2O2)含量检测试剂盒 (BC3595),植物 SOD 检测试剂盒 (BC5165),过氧化物酶(POD)活性检测试剂盒 (BC0090),过氧化氢酶(CAT)活性检测试剂盒 (BC0205)。
1.4 数据处理与分析
采用Microsoft Excel 2016进行数据初步整理,用SPSS 22软件进行显著性分析,Graphpad Prism软件进行标准差计算及可视化。
2 结果与分析
2.1 低温胁迫对工业大麻幼苗生长指标的影响
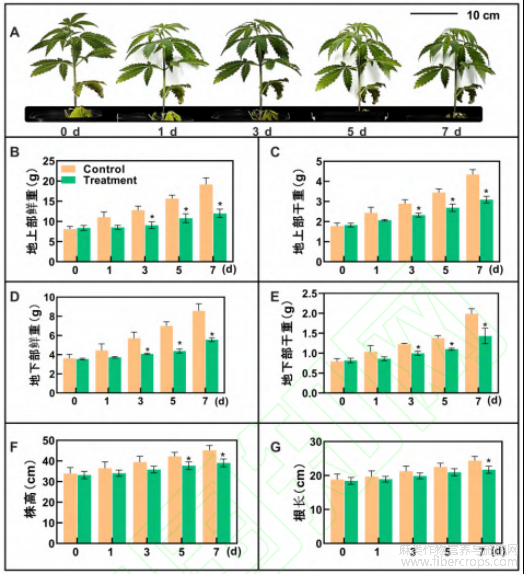
本研究对低温胁迫下工业大麻生长状况进行观察,结果显示,在低温胁迫下,工业大麻植株叶片出现萎蔫、失水症状。短期低温胁迫处理(1d)叶片萎蔫程度不明显,随着胁迫处理时间的延长,萎蔫程度逐渐加深(图1A)。生长指标测定结果显示,地上和地下部分干重、鲜重均在处理3 d开始显著降低,且随处理时间延长下降幅度呈增加趋势,植株总鲜重的下降幅度在处理3~7d由29%增至37%,植株总干重下降比例由17%增至22%(图1B,C,D,E)。处理7d工业大麻株高和根长均显著降低,相较于对照组分别下降11%和14%(图1F,G)。表明低温胁迫显著抑制工业大麻地上和地下部分的生长,降低植株株高、根长和生物量积累。
注:“*”代表相同处理时间对照组与处理组差异显著(p<0.05)。下同
图1 低温胁迫下工业大麻生长指标测定
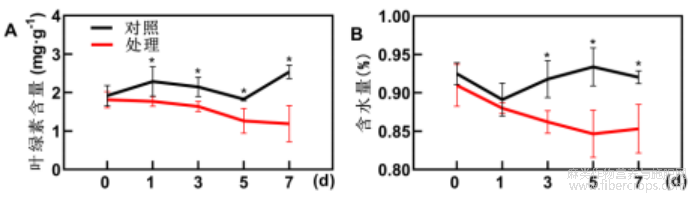
此外,叶绿素与植株光合作用密切相关,对植物生长发育具有关键作用。对低温胁迫下工业大麻叶绿素含量进行测定,结果表明,低温胁迫下,叶绿素的合成受到抑制,在处理1d后叶绿素含量相较于对照而言呈显著下降趋势。处理7d,低温胁迫下工业大麻叶绿素含量仅为1.2mg/g,为对照组的50%(图2A)。同时,低温胁迫下,工业大麻叶片组织含水量与对照相比呈逐渐降低的趋势,叶片相对含水量降低7%(图2B)。
图2 低温胁迫下工业大麻叶片叶绿素和相对含水量测定结果
2.2 低温胁迫对工业大麻幼苗光合指标的影响
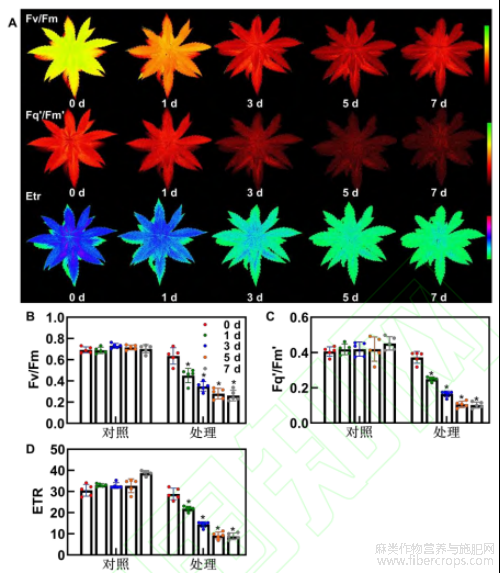
植物的生长与光合作用密切相关,而低温会抑制植物的活动,干扰其光合作用。通过叶绿素荧光成像技术可以表征工业大麻幼苗叶片光合作用能力的变化。结果显示,低温胁迫下工业大麻叶片冠层叶绿素荧光成像发生明显变化(图3A)。低温胁迫导致工业大麻叶片组织中光系统II(PSII)的原初光能转化效率Fv/Fm和PSII的运行效率Fq'/Fm'均显著下降,且处理3d后下降的速度变缓(图3B、C)。此外,低温胁迫导致电子传输速率ETR降低,其中低温处理1 d时ETR的下降率为24%,处理3d时为34%,处理5d时为36%,而处理7d时下降的幅度明显较低,为4%(图3D)。
图3 低温胁迫下工业大麻叶片叶绿素荧光参数
2.3 低温胁迫对工业大麻细胞膜完整性的影响
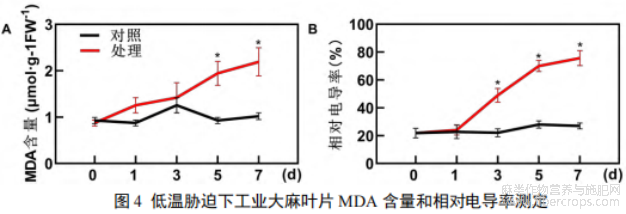
丙二醛是膜脂过氧化的主要产物之一,其含量高低可反应植物膜损伤程度,是低温胁迫下膜结构完整性的重要评价指标。由图4结果可以看出,工业大麻幼苗在低温处理下MDA含量整体呈上升趋势,且在处理的1~5d上升速率较快,表明随处理时间延长植株膜损伤加剧,但在处理7 d时上升速率有减缓趋势(图4A)。
生物膜是植物应对外界胁迫的第一道屏障,膜损伤可导致膜透性变化,电解质渗透量增加。研究结果显示(图4B),随低温胁迫时间延长,工业大麻幼苗叶片的相对电导率逐渐增加,且呈“S”型上升趋势。在低温处理的1、3、5和7d的相对电导率分别为24.0%、48.9%、70.01%和75.7%,表明随低温处理时间延长,工业大麻幼苗叶片受损伤程度不断增加。
图4 低温胁迫下工业大麻叶片MDA含量和相对电导率测定
2.4 低温胁迫对工业大麻幼苗叶片渗透调节物质的影响
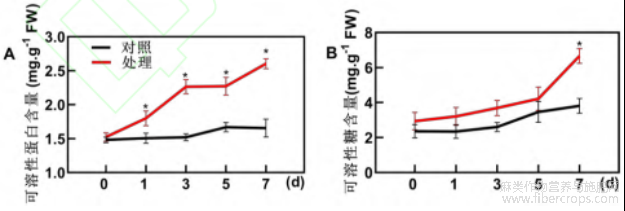
可溶性蛋白作为植物体内一种重要的渗透调节物质,其在低温胁迫下的积累能提高植物细胞的保水能力,对细胞内的生物活性物质和生物膜具有保护作用。由图5A结果可以看出,低温胁迫处理后,工业大麻幼苗叶片在短时间内迅速积累可溶性蛋白,在处理3d时可溶性蛋白含量达2.3mg/g,是对照组的1.5倍。对照组的可溶性蛋白含量在整个处理时间段波动不明显。
低温胁迫可影响作物对水分的吸收和利用效率,而可溶性糖作物植物细胞新陈代谢的主要原料,可通过自身积累提升细胞的渗透浓度,增加细胞的保水能力,避免生理性干旱,是评价植物耐低温的重要指标。工业大麻幼苗叶片可溶性糖含量测定结果显示(图5B),低温胁迫下工业大麻可溶性糖在体内不断积累,且随处理时间延长其含量逐渐升高,相较于对照组,可溶性糖含量于处理的1、3、5和7d分别增加了37%、42%、22%和75%。
图5 低温胁迫下工业大麻叶片可溶性物质含量测定
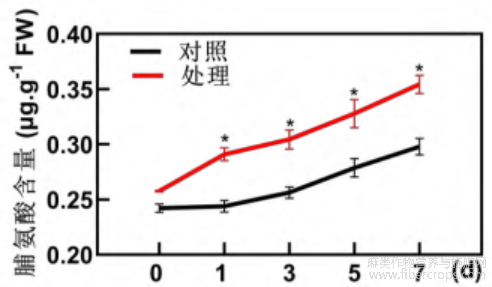
脯氨酸是一种广泛分布于植物体的渗透调节物质,植物可以通过调节自身脯氨酸的合成防止逆境胁迫对其细胞造成损伤。由图6可以看出,低温胁迫下工业大麻幼苗叶片脯氨酸含量随处理时间的延长逐渐上升,且始终高于对照组,在处理7d时脯氨酸含量达到最大值,为对照组的1.2倍。
图6 低温胁迫下工业大麻叶片脯氨酸含量测定
2.5 低温胁迫对工业大麻幼苗叶片活性氧系统的影响
非生物逆境胁迫可引起植物活性氧爆发,导致产生大量有害的活性氧物质,如:H2O2和O2-大量积累,会对植物体细胞膜造成损伤,是植物抵抗外界胁迫环境的早期防御事件。DAB染液可与H2O2特异性结合,产生积累过氧化氢的叶片可染成褐色,通过颜色分布可见工业大麻叶片H2O2分子的积累情况和分布状态。如图7所示,低温胁迫后工业大麻叶片经DAB染色后形成明显褐色沉积,而对照组则没有明显变化,表明低温胁迫诱导过氧化氢在工业大麻叶片中的大量积累。过氧化氢含量测定结果也表明,低温胁迫促使过氧化氢含量增加(图8A)。
图7 低温胁迫下工业大麻叶片DAB染色结果
逆境胁迫下,活性氧的产生与清除始终保持动态平衡状态,SOD和POD是植物体内重要的抗氧化酶,可清除有害的过氧化物,将对植物有害的自由基还原成无害的水和氧分子,防止膜脂过氧化的发生,是衡量植物耐逆性的重要指标。研究结果表明,低温胁迫下工业大麻体内CAT、SOD和POD活性在低温处理下先上升后降低,且始终高于对照组。CAT和POD活性在处理5d时达到最大值,分别为对照组的2倍和3倍(图8BD),SOD活性在处理3d时达到最大值,是对照组的2倍(图8C)。说明低温胁迫下,工业大麻可通过提升SOD、POD和CAT活性响应低温胁迫。
图8 低温胁迫下工业大麻叶片抗氧化体系测定
3 讨论
低温是限制植物生长发育、地理分布及产量品质提升的主要环境因子。在长期的进化过程中,植物可通过调节自身生理代谢水平增强对低温胁迫的耐受性[13]。植物对低温的耐性受多因素的影响,细胞膜是植物应对外界胁迫的第一道屏障,其完整性和流动性是低温适应的物理基础。低温胁迫下,细胞膜由液态向凝胶态转变,细胞膜通透性增强,导致电导率、渗透调节物质和膜脂过氧化等生理指标的变化。此外,植物叶绿素含量和活性氧清除系统与植物的低温耐性也密切相关[14]。
植物生长发育与光合作用密切相关,低温胁迫会抑制植物的生命活动,干扰光合作用进行,降低生物量积累[15]。本研究表明,4℃低温对工业大麻幼苗产生生理性伤害,抑制其生长速率,这与高粱、茄子和木豆的研究结果相一致[16–18]。光系统II(PSII)在光能转换和电子传递中起着重要作用,是高等植物光合作用的重要组成部分[19]。Fv/Fm表示PSII的最大光化学效率,Fq'/Fm'表示PSII在光照下的光化学效率,可以判断植物是否受到光抑制[20]。本研究中,低温胁迫导致工业大麻叶片组织中Fv/Fm和Fq'/Fm'均显著下降,致使工业大麻叶片对光能的捕获效率下降,进而影响一次光能转换效率和PSII的潜在活性,使光合作用受到影响,这与高璐鑫等[21]对油茶低温响应机制的研究结果相一致[22]。谢聪颖等[23]对条斑紫菜的低温响应特性研究中表明,低温可通过影响光合作用抑制其生长速率。而电子传递速率(ETR)表示PSII反应中心电子传递效率,与光合速率有很强的线性关系[24]。低温胁迫导致ETR下降,表明低温胁迫导致产生过多激发能,PSII反应中心受到损害,开放程度降低,电子传递效率降低,光化学反应受阻,光抑制加强,进而影响工业大麻的光合作用。这与李瑞等[25]对甘草幼苗低温响应机制研究结果相一致。
叶绿素的合成是一个高度复杂有序的过程,受环境因素影响。低温胁迫会破坏叶绿体结构并抑制叶绿素合成酶的活性,进而抑制植物生物量的积累和生长发育[13,26]。本研究发现,低温胁迫抑制了工业大麻叶片叶绿素的合成,且在整个生长时期处于下降趋势,这与低温处理下的玉米、水稻、高粱等结果高度一致[27–29]。细胞膜是植物接收外界环境变化信息的重要受体,低温胁迫下细胞膜的生理变化可反映膜系统的稳定性,是植物抗性的重要指标[30]。低温胁迫下,膜透性改变,完整性遭到破坏,细胞内离子外渗,引起电导率升高。丙二醛作为膜脂过氧化作用主要产物,与电导率常作为评价植物低温耐性的指标。本研究中,工业大麻幼苗叶片的相对电导率随着低温处理时间延长逐渐升高,丙二醛含量也随处理时间延长在体内积累,表明随着低温胁迫时间延长,膜透性不断下降,低温胁迫下膜脂损伤更加严重,此结果与其他植物的研究结果一致[31-32]。低温胁迫下植物可以通过可溶性蛋白、可溶性糖和脯氨酸等渗透调节物质调节细胞渗透势,从而降低植物细胞冰晶形成的可能性,此外,脯氨酸含量的提升有助于保持细胞膜完整性,提高植物对环境胁迫的适应能力。本研究发现工业大麻幼苗叶片的可溶性蛋白、可溶性糖和脯氨酸含量变化趋势与丙二醛、电导率相似,整体呈上升趋势。
低温胁迫与其他非生物胁迫相同,均会诱导ROS产生,ROS可导致膜脂过氧化发生,严重时会引起植物组织坏死[33]。一般而言,低温耐性强的植物可以更高速率清除ROS,防止膜脂过氧化损伤加剧[34]。抗氧化酶系统和非酶系统组成了植物的抗氧化系统,两者可在低温胁迫下同时发挥作用,以清除植物细胞内因氧代谢失衡而积累的ROS,抑制脂类物质的过氧化反应,提高低温胁迫下的光合作用速率,从而提高植物对低温的耐受性。SOD和POD可使超氧阴离子和过氧化氢变成水和氧分子,以缓解由于ROS积累对细胞造成的损害。本研究表明,低温胁迫下工业大麻的SOD和POD活性随低温胁迫处理时间延长而逐渐升高,说明SOD和POD酶对于工业大麻响应低温胁迫,降低低温损伤具有重要作用。
目前,工业大麻低温响应生理机制研究相对较少,本研究将对筛选更加优质的耐低温种质资源,为今后工业大麻产业发展奠定基础。在今后育种工作中,宏观上可通过植物形态指标以及生理生化指标的研究来鉴定工业大麻耐低温品种;微观上可进一步对低温胁迫下工业大麻的转录调控水平进行研究,从而深化工业大麻低温耐性评价的内容。目前,大量与植物响应低温胁迫表达的相关基因已经得到鉴定和分离,但工业大麻在耐低温基因功能方面的研究较少,今后应从分子方面入手,通过分子育种手段培育出耐低温能力较强的工业大麻品种。
4 总结
通过对低温胁迫下工业大麻幼苗生长指标、光合指标、膜脂过氧化水平、渗透调节物质含量及活性氧系统等指标的测定结果显示,低温对工业大麻光合作用及生长具有抑制作用。胁迫过程中,随着时间延长,工业大麻幼苗叶片的膜透性增大,离子渗透加剧,膜脂过氧化水平提高,细胞活性氧积累增加,膜损伤程度加深。在响应低温胁迫过程中,工业大麻主要通过渗透调节物质的增加以及抗氧化酶活性的提升来缓解低温胁迫对植物细胞造成的损伤,从而提升其耐低温能力。
参考文献
[1]Mayer B F,Ali Ali-Benali M,Demone J,et al.Cold acclimation induces distinctive changes in the chromatin state and transcript levels of COR genes in Cannabis sativa varieties with contrasting cold acclimation capacities[J].Physiologia Plantarum,2015,155(3):281-295.
[2]Farinon B,Molinari R,Costantini L,et al.The seed of industrial hemp(Cannabis sativa L.):nutritional quality and potential functionality for human health and nutrition[J].Nutrients,2020,12(7):1935.
[3]Nizar Happyana M Sc.Metabolomics,proteomics,and transcriptomics ofCannabis sativa L.trichomes[D].Dortmund:Dortmund University of Technology,2014.
[4]Xie Z,Mi Y,Kong L,et al.Cannabis sativa?:Origin and history,glandular trichome development,and cannabinoid biosynthesis[J].Horticulture Research,2023,10(9):150.
[5]Backer R,Schwinghamer T,Rosenbaum P,et al.Closing the yield gap for Cannabis:a meta-analysis of factors determining Cannabis yield[J].Frontiers in Plant Science,2019,10:495.
[6]Kerbler S M,Wigge P A.Temperature sensing in plants[J].Annual Review of Plant Biology,2023,74:341-366.
[7]QIAN Z F,HE L L,LI F S.Understanding cold stress response mechanisms in plants:an overview[J].Frontiers in Plant Science,2024,15:1443317.
[8]Ritonga F N,Chen S.Physiological and molecular mechanism involved in cold stress tolerance in plants[J].Plants(Basel),2020,9(5):560.
[9]单鼎城,赵亚男,张美惠,等.叶绿素荧光成像技术监测苗期小麦白粉病初探[J].植物保护,2022,48(5):99-107.
[10]王士梅,沈国霞,陈秀晨,等.水稻叶片相对含水量性状的QTL定位分析(英文)[J].Agricultural Science&Technology,2014,15(11):1849-1851.
[11]许忠赫.四种药用植物果胶的结构分析及其抗氧化活性研究[D].长春:东北师范大学,2023.
[12]LI Y,YANG X X,REN B B,et al.Why nitrogen use efficiency decreases under high nitrogen supply in rice(Oryza sativa L.)seedlings[J].Journal of Plant Growth Regulation,2012,31(1):47-52.
[13]赖铭,陈佳,张军,等.植物低温胁迫响应机制及提高抗冷性研究进展[J].分子植物育种,2023:1-11.
[14]姜良宝.梅花响应低温胁迫的生理变化和基因表达模式研究[D].北京:北京林业大学,2020.
[15]Burnett A C,Kromdijk J.Can we improve the chilling tolerance of maize photosynthesis through breeding?[J].Journal of Experimental Botany,2022,73(10):3138-3156.
[16]李元梅,姚金晓,朱田香.茄子幼苗耐低温生理指标的影响[J].浙江农业科学,2023,64(2):337-339.
[17]邵文静.低温胁迫下高粱幼苗叶片生理及膜脂代谢调控的研究[D].大庆:黑龙江八一农垦大学,2021.
[18]唐军,王文强,丁西朋,等.不同木豆幼苗低温胁迫下的生理响应及耐寒性鉴定[J].热带作物学报,2024,45(8):1633-1640.
[19]WEI Y L,CHEN H Z,WANG L,et al.Cold acclimation alleviates cold stress-induced PSII inhibition and oxidative damage in tobacco leaves[J].Plant Signaling&Behavior,2022,17(1):2013638.
[20]Oliver T,Kim T D,Trinugroho J P,et al.The evolution and evolvability of photosystem II[J].Annual Review of Plant Biology,2023,74(1):225-257.
[21]高璐鑫,王琪,陈雨晴,等.春季亚低温胁迫对油茶‘华硕’叶片光合生理特性的影响[J].西南林业大学学报(自然科学),2022,42(1):100-107.
[22]许明海,冯瑜,童宇艳,等.低温胁迫对不同耐寒红树植物幼苗光合生理和抗氧化特性的影响[J].林业科学研究,2024,37(2):124-133.
[23]谢聪颖,钟雪峰,乌兰,等.低温胁迫下条斑紫菜的生长和光合生理生化响应[J].中国海洋大学学报(自然科学版),2024,54(8):33-42.
[24]Furutani R,Ohnishi M,Mori Y,et al.The difficulty of estimating the electron transport rate at photosystem I[J].Journal of Plant Research,2022,135(4):565-577.
[25]李瑞.干旱低温处理对甘草幼苗光合生理和次生代谢物合成的影响[D].咸阳:陕西中医药大学,2024.
[26]QI W L,WANG F,MA L,et al.Physiological and biochemical mechanisms and cytology of cold tolerance in Brassica napus[J].Frontiers in Plant Science,2020,11:1241.
[27]包玲玲.不同水稻品种在冷胁迫下生理响应比较研究[D].重庆:重庆师范大学,2016.
[28]Jumrani K,Bhatia V S.Interactive effect of temperature and water stress on physiological and biochemical processes in soybean[J].Physiology and Molecular Biology of Plants,2019,25(3):667-681.
[29]刘敏.玉米苗期响应冷胁迫的生理及分子机制[D].沈阳:沈阳农业大学,2022.
[30]Wu G,Baumeister R,Heimbucher T.Molecular mechanisms of lipid-based metabolic adaptation strategies in response to cold[J].Cells,2023,12(10):1353.
[31]DING Y L,YANG S H.Surviving and thriving:How plants perceive and respond to temperature stress[J].Developmental Cell,2022,57(8):947-958.
[32]LI J H,ZHANG Z Y,CHONG K,et al.Chilling tolerance in rice:past and present[J].Journal of Plant Physiology,2022,268:153576.
[33]XU C,WANG Y T,YANG H D,et al.Cold acclimation alleviates photosynthetic inhibition and oxidative damage induced by cold stress in Citrus seedlings[J].Plant Signaling&Behavior,2023,18(1):2285169.
[34]李薇,史菲,刘敏,等.植物响应低温的生理和分子机制研究进展[J].北方园艺,2023(8):121-126.
文章摘自:闫博巍,常传义,隋月,等.低温胁迫下工业大麻幼苗的生理响应[J/OL].中国麻业科学,1-16[2025-03-13].http://kns.cnki.net/kcms/detail/43.1467.s.20250225.1417.002.html.