摘 要:为了明确外源硅对工业大麻生长的影响,研究以工业大麻品种云麻7号为材料,采用盆栽的方法,研究5个不同浓度(4、8、12、16、20g/L)硅酸钠(Na2SiO3·9H2O)叶面喷施处理对工业大麻农艺性状、生理特性的影响以及硅在大麻植株中的含量分布。结果表明:施用硅酸钠可不同程度提高工业大麻的株高、茎粗和生物量;同时,硅酸钠能够增强大麻叶片的光合作用,提高其超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性以及渗透调节物质的积累。其中,以12g/L硅酸钠处理促进工业大麻生长的效果最佳。最后,通过对大麻植株各部位硅含量分析发现,叶面喷施硅酸钠处理后,硅主要富集于大麻叶片,且随着硅酸钠处理浓度的增加,硅在大麻各部位的含量也呈增加趋势。以上结果表明,外源硅能够影响工业大麻生长与生理活动。研究结果将为工业大麻合理地施用硅肥提供科学依据。
关键词:工业大麻;硅;叶面喷施;农艺性状;生理特性
大麻(Cannabis sativaL.)是大麻科(Cannabinaceae)大麻属一年生草本植物,是最古老的作物之一,其中,工业大麻是限定农业安全利用的品种类型[1]。工业大麻作为我国重要的经济作物,具有适应性强、抗旱、抗盐碱等优势,可作为云贵高原山区适应山坡地环境的经济作物,是重要的地域性资源,应加强对其栽培技术的探究。
硅是植物体内重要的组成元素,硅的氧化物占植物灰分含量的14.2%~61.4%[2]。硅也是植物生长的有益元素,研究证实,在缺硅土壤中施用硅肥可显著促进作物生长,提高作物抗病、抗倒伏能力,缓解作物重金属毒害[3]。康公平等[4]研究表明,一定量的硅肥能显著提高罗汉果的光合速率,增强罗汉果的光能利用率。硅肥的施用能够有效地促进茄子的生长,有利于茄子抵御干旱等胁迫[5]。硅降低了大麦叶片电解质渗漏率,可降低盐胁迫下大麦细胞质膜透性[3]。还有研究[6]表明,盐胁迫下加硅可显著提高大麦叶片的超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)含量,提高根系H+-ATP酶活性。
目前,硅在水稻、小麦、玉米、草莓等作物中的施用有大量报道,但是对工业大麻生长生理的影响方面却鲜有报道。本研究通过测定不同硅水平处理下工业大麻的农艺性状和生理指标以及硅在大麻各器官的含量分布,探索工业大麻种植的适宜硅施用量,旨为提高工业大麻的产量提供理论依据。
1材料与方法
1.1试验材料
以云南省主要推广的花叶用工业大麻品种‘云麻7号’作为供试材料。
1.2试验方法
1.2.1试验设计
试验在云南大学塑料大棚内进行。取直径20cm、高22cm的塑料花盆,装泥炭基质1.5kg,每盆施复合肥(m(N):m(P):m(K)=15:15:15)0.5g,翻拌均匀。每盆播种10~15粒,出苗一周后进行间苗,每盆留苗5株。
硅处理采用九水硅酸钠(Na2SiO3·9H2O,西陇科学有限公司),浓度设置为0(CK)、4、8、12、16、20g/L,共6个处理,4次重复,栽培盆随机区组排列。间苗2d后进行硅酸钠处理,处理时用手持式喷雾器对植株正反叶面均匀喷施,以不滴为宜,间隔7d再喷施一次硅酸钠,共处理2次。
在第二次硅酸钠处理完成30d后,每个重复随机选择3株植物进行生理指标的测定,然后收获,测定分析其农艺指标和硅在植株中的含量。每个处理重复4次。
1.2.2生理指标及其测定方法
选择晴天上午8:00—11:00将大麻植株放置在光下充分光适应30min左右,选取大麻植株从上往下数第4对真叶,采用便携式光合测定仪(LI-6400XT)测定其叶片气孔导度、净光合速率、蒸腾速率和胞间CO2浓度。
取大麻植株从上往下数第4对真叶,测定其相对电导率、抗氧化酶活性、可溶性糖、可溶性蛋白、丙二醛、脯氨酸的含量。其中,相对电导率采用电导率仪进行测定,POD活性采用愈创木酚法测定,SOD活性采用NBT(氮蓝四唑)显色法测定,可溶性蛋白含量采
用考马斯亮蓝法测定,丙二醛、可溶性糖含量采用硫代巴比妥酸法测定,脯氨酸含量采用磺基水杨酸法测定。以上生理指标的测定参照邹琦[7]的方法进行。
1.2.3农艺指标及其测定方法
株高:植株主茎基部至生长点的高度,使用软尺测量;茎粗:测量植株基部以上10cm处直径,使用游标卡尺测量;地上部鲜重:整个植株地上部鲜重,使用天平进行称重;地上部干重:将地上部分置于105℃烘箱杀青15min,再65℃烘干至恒重,然后进行称重。
1.2.4硅在植株中的含量测定
将烘干后的大麻根、茎、叶分别进行充分粉碎后,各取0.1g,采用硅含量试剂盒(苏州科铭生物技术有限公司)分别进行硅含量的测定。
1.3数据处理与分析
使用MSExcelv.2021计算数据的平均值、标准差,采用IBMSPSSv.20.0对数据进行单因素方差分析(One-wayANOVA),在α=0.05水平用Duncan法进行多重比较。
2结果与分析
2.1不同浓度硅酸钠处理对工业大麻农艺性状的影响
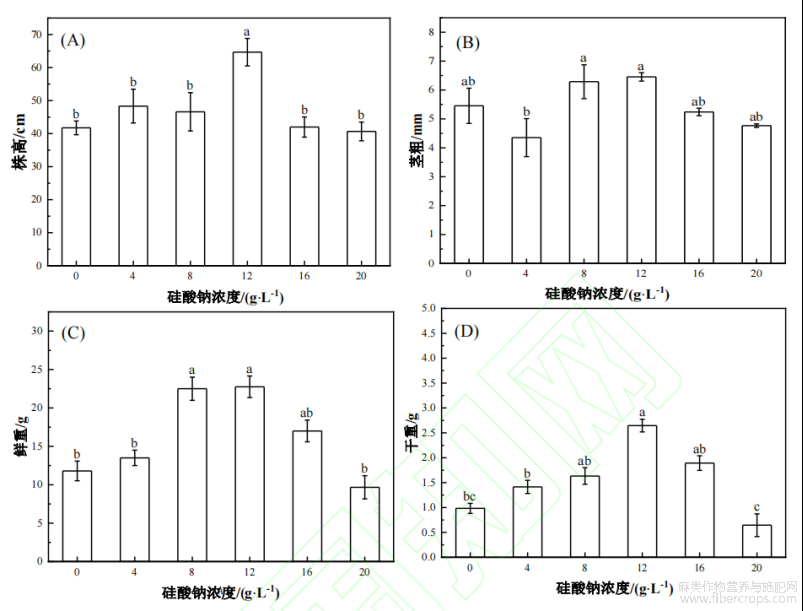
由图1可知,叶面喷施不同浓度硅酸钠对工业大麻的农艺性状有一定的影响。随着硅酸钠处理浓度的增加,工业大麻的株高、茎粗、地上部鲜重和干重均呈现先上升后下降的趋势,4g/L处理下的茎粗除外。从图1还可以看出,在5个硅酸钠处理浓度中,叶面喷施12g/L硅酸钠对大麻生长具有显著的促进作用,与对照(0g/L)相比,株高、茎粗、地上部干重和鲜重分别增加了54.89%、18.34%、169.10%和92.85%。同时,高浓度的硅酸钠(20g/L)对工业大麻的生长具有抑制作用,与对照相比,株高、茎粗、地上部干重和鲜重分别降低了2.59%、12.58%、34.32%和18.06%。
2.2不同浓度硅酸钠处理对工业大麻生理指标的影响
2.2.1不同浓度硅酸钠处理对工业大麻光合指标的影响
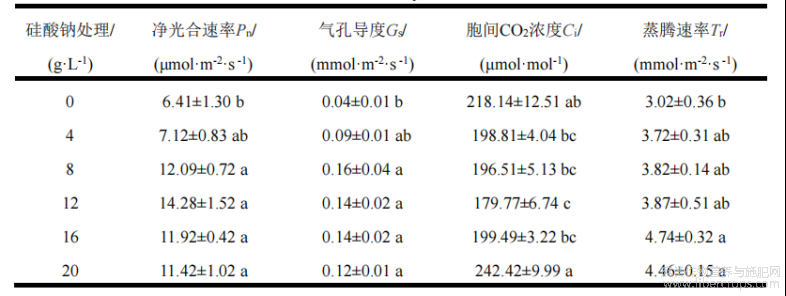
由表1可知,叶面喷施不同浓度硅酸钠对工业大麻的净光合速率、气孔导度、胞间CO2浓度、蒸腾速率等有显著的影响。净光合速率、气孔导度和蒸腾速率均随着硅肥施用浓度的增加呈现先增后减的趋势,硅肥浓度在12g/L时,净光合速率达到峰值,在8g/L时,气孔导度最大,在16g/L时,蒸腾速率最高。与前面指标不同,胞间CO2浓度随着硅肥施用浓度的增大呈现先降低后升高的趋势,在12g/L时达到最低值,与对照相比,12g/L的胞间CO2浓度降低了17.59%。
注:不同小写字母表示差异显著(P<0.05)。下同
图1不同浓度硅酸钠处理对工业大麻农艺性状的影响
表1不同浓度硅酸钠处理对工业大麻叶片光合指标的影响
注:同列不同小写字母表示不同处理间差异显著(P<0.05)。
2.2.2不同浓度硅酸钠处理对工业大麻抗氧化酶活性的影响
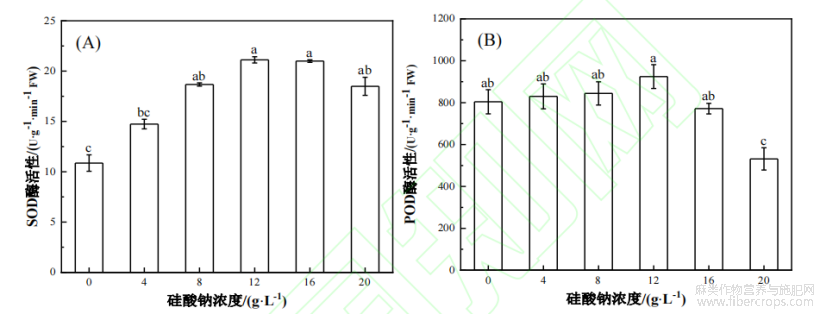
叶面喷施不同浓度硅酸钠对工业大麻的抗氧化酶活性有显著影响。由图2(A)可以看出,随着硅酸钠处理浓度的增加,大麻叶片中SOD酶活性呈现先上升后降低的趋势。与对照相比,分别增加了35.79%、72.14%、94.75%、93.66%和70.45%,其中,硅酸钠浓度12g/L处理下的涨幅最大。由图2(B)可以看出,随着硅酸钠浓度增加,大麻叶片中POD酶活性也呈现先上升后降低的趋势。与对照相比,大麻叶片中POD酶的活性在4~12g/L浓度处理下分别增长了3.21%、4.96%和14.95%,其中,在硅酸钠浓度12g/L处理下的涨幅最大。当硅酸钠浓度超过16g/L时,大麻叶片中的POD酶活性呈现下降的趋势,与对照相比分别降低了4.07%和33.92%。
图2不同浓度硅酸钠处理对工业大麻SOD(A)和POD(B)酶活性的影响
2.2.3不同浓度硅酸钠处理对工业大麻质膜透性及渗透性物质相关指标的影响
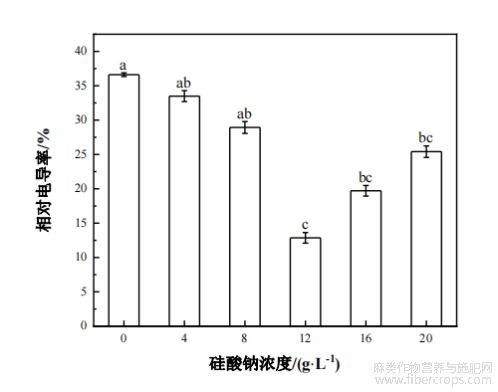
由图3可知,叶面喷施不同浓度硅酸钠对工业大麻叶片的相对电导率有显著影响。随着硅酸钠处理浓度的增加,工业大麻的相对电导率呈先降低后升高的趋势。与对照相比,不同硅酸钠处理后的大麻植株叶片的相对电导率均下降,分别降低了8.52%、20.98%、64.87%、46.16%和30.61%,其中,12g/L硅酸钠处理对大麻相对电导率具有显著的降低作用,与对照相比,其相对电导率降低了64.87%。
图3不同浓度硅酸钠处理对工业大麻叶片相对电导率的影响
由图4可知,叶面喷施不同浓度硅酸钠对工业大麻的渗透调节物质均有一定的影响。随着硅酸钠处理浓度的增加(8g/L处理除外),可溶性蛋白含量呈现先升高后降低的趋势。而随着硅酸钠处理浓度的增加,可溶性糖和丙二醛含量呈现先降低后升高的趋势,脯氨酸含量则呈现先升高后降低再升高的趋势。
由图4(A)可知,不同浓度硅酸钠处理均能增加大麻叶片中可溶性蛋白的含量,与对照相比,各个浓度处理的可溶性蛋白含量分别增加71.90%、35.67%、94.43%、93.35%和70.21%。由图4(B)和4(C)可知,不同浓度的硅酸钠处理降低了大麻叶片中的可溶性糖含量、丙二醛的含量,与对照相比,各个浓度处理的可溶性糖含量分别降低了41.00%、47.71%、35.71%、31.65%和31.39%,而丙二醛含量分别降低了43.83%、56.69%、43.94%、36.72%和21.04%。脯氨酸在12g/L硅酸钠处理下含量最低,为143.95μg/g。
图4施用不同浓度硅酸钠对工业大麻渗透调节物质的影响
2.3不同浓度硅酸钠处理后硅在工业大麻不同部位中的含量分布
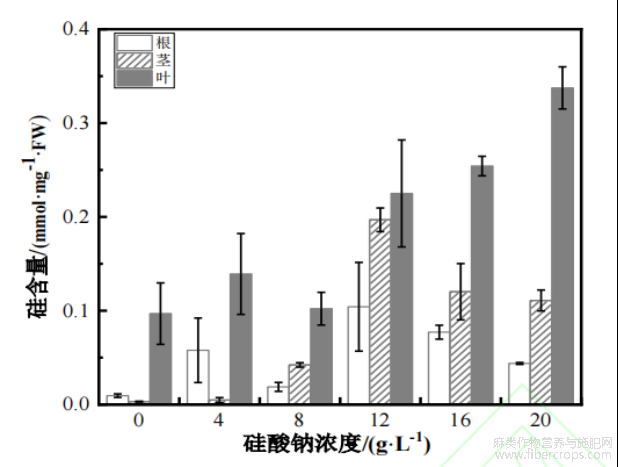
由图5可知,叶面喷施不同浓度硅酸钠对硅在大麻植株不同部位的积累有一定的影响。随着硅酸钠处理浓度的增加(8g/L处理除外),大麻叶中硅的含量逐渐升高,而大麻根和茎中硅的含量呈先升高后降低的趋势。从图5中可以看出,在试验的硅浓度范围内,叶片中的硅含量均比根和茎中的含量高。同时,大麻叶中硅的含量最高的是在20g/L处理下,为0.34mmol/mg,而根和茎中硅的含量最高的是在12g/L处理下,分别为0.19、0.09mmol/mg。
图5不同硅酸钠处理后硅分别在大麻根、茎、叶的含量分布
3讨论
在外源硅处理后,植物体内的细胞会发生一系列适应性改变,最终体现在植株外在的生长状况和形态特征上。株高、茎粗、生物量等指标是衡量硅对植株发挥促进生长作用的重要指标[8]。有研究[9]表明,施硅能促进水稻地上部的生长发育,增加地上部干物质的积累,提高抗倒性。也有研究[10]表明,低浓度硅酸钾对降香黄檀幼苗的株高具有促进作用,但浓度过高(≥2mmol/L)会造成离子胁迫从而抑制植株生长。通过本研究可以看出,大麻植株在外源硅处理后,其植株的株高较对照有显著的提高,可能是硅改善了植株的生长状况,促进了根系对水分和养分的吸收,进而促进了植株生长,这与Ashfaque等[11]的研究结果一致。其中,与对照相比,12g/L的硅酸钠处理能够最大程度地促进大麻的生长,效果最佳,而16~20g/L硅酸钠处理下,各生长指标均呈现一定的下降趋势,说明施用过量的硅会对植物造成损伤,这与苏庆旺等[8]的研究结果相似。
光合作用与净光合效率、气孔导度、胞间CO2含量等指标有密切的关系[4]。有研究[12-14]表明,施用硅肥可以提高植物光合作用。在本研究中,随着硅浓度的增加,净光合速率、气孔导度和蒸腾速率等光合指标都呈现先升后降的趋势,胞间CO2浓度呈现先降低后升高的趋势。20g/L硅酸钠处理后,大麻叶片胞间CO2浓度出现增加,这可能是由于硅酸钠溶液浓度过高,碱性过强,破坏了植物叶片的细胞结构,导致叶片出现灼伤症状,从而抑制了大麻的光合作用[13]。有研究[8]表明,硅能促进水稻叶肉细胞和叶绿体体积的增大,增加叶绿体基粒片层结构的数量,从而增加光合活性。而硅对于改善工业大麻光合效应的机制还鲜有报道,有待进一步探讨。
硅对植物的质膜透性、抗氧化酶类以及渗透性物质都有明显的影响[12]。相对电导率是衡量植物受到逆境胁迫的指标,可以反映逆境下植物细胞膜的透性程度以及组织损伤程度[12]。植物抗氧化酶系统能够有效清除细胞内的活性氧,是植物保护机制的一个重要组成部分。Ma等[12]研究表明,硅可以提高干旱胁迫下小麦SOD、POD等抗氧化酶活性。从本研究可以看出,通过喷施不同浓度的硅酸钠,能够降低大麻叶片的相对电导率,可能是因为硅的施用能够增强大麻叶片蜡质化,防止离子的渗出,增强叶片的抗机械损伤能力,有效地保护大麻叶片的正常生长[14]。本研究中,12g/L的硅酸钠处理时,大麻叶片的相对电导率最低,说明此时植株生长状态较好,能够较好地抵抗外界环境的变化,与李京蕾等[14]的研究结果相似。同时,叶面喷施硅酸钠能够增强大麻的SOD、POD酶活性,有利于减少大麻植株活性氧的产生,维持工业大麻内环境和外环境的稳定。随着硅酸钠浓度的增加,大麻的SOD和POD活性呈现先上升后下降的趋势,且在12g/L硅酸钠浓度时SOD、POD酶的活性最高。植株抗性可以由MDA含量、脯氨酸含量、可溶性糖含量等指标表征。MDA是在植株遇胁迫时,细胞膜脂产生的过氧化物质。脯氨酸可调节细胞渗透压平衡,当植物受到胁迫时,脯氨酸大量积累并作出调控,保持植物体内稳定的渗透压和较高的水分,提高了植物抗胁迫的能力[15]。在本研究中,8~12g/L硅酸钠处理时,大麻的相对电导率、可溶性糖、丙二醛、脯氨酸含量最低。在16~20g/L硅酸钠处理时,丙二醛、脯氨酸含量呈现上升趋势,说明大于16g/L的硅酸钠处理已经产生了离子胁迫,这与范小玉等[5]的研究结果相似。由此可见,硅酸钠处理工业大麻的最适宜浓度是12g/L。
硅是地壳中最丰富的元素之一,其含量仅次于氧。在很多高等植物体内,硅是主要的无机组成成分,尽管高等植物能大量吸收硅元素,但对大多数高等植物来说硅不是必需元素。但大量的研究[13]表明,硅对植物的生长发育是有益的。植物对硅的吸收能力相差很大,而硅在植物体内的分布也存在着器官间的差异[16],在一些植物中,硅平均分布于植株地上部和根部,如番茄、小萝卜、绿洋葱和中国甘蓝等植物硅含量很低,且地上、地下部硅含量大致相等或地下部硅含量略高。而有些植物地上部分的硅含量大大低于根中的硅含量,如绛车轴草,其根中硅含量约为地上部分的8倍[17]。本研究中工业大麻幼苗经过硅酸钠处理后,硅含量富集最多的器官为叶片。有研究表明[18],大量硅可能以沉淀硅形态积累在叶中,导致其向生殖器官的转移受到抑制,而这样的植物又被称为主动吸硅型植物,如玉米、水稻等。主动吸硅型植物其各器官硅含量与氮、钾含量呈一定的正相关性,其含量变化呈现叶>根>茎的趋势[14],而硅在工业大麻各器官的含量分布也与之相似。本研究是采用叶片喷施的方式进行,而根施对硅在大麻各器官中的分布和含量的影响,还需要进一步研究。但是,无论那种处理方式,叶片中硅含量增多有利于叶片的蜡质生长,可能对叶片的生长有保护和促进作用[15]。
4结论
综上所述,外源硅能够在工业大麻的生长生理方面发挥作用,能促进大麻的生长,增强大麻的光合作用,改变大麻的抗氧化酶活性以及调节其质膜透性和相关渗透物质。本研究确定对工业大麻叶面喷施硅酸钠处理的最佳浓度是12g/L,处理后硅主要富集在大麻叶片中,并且其含量随着硅酸钠处理浓度的增加而增加。以上研究结果将为工业大麻在实际生产中硅肥的施用提供一定的理论基础。
参考文献
[1]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:83-95.
[2]张海楼,娄春荣,董环,等.硅肥在蔬菜上的应用研究现状与展望[J].辽宁农业科学,2005(3):53-55.
[3]Epstein E. The anomaly of silicon in plant biology[J]. Proceedingsof the National Academy of Sciences of the United States of America,1994,91:11- 17.
[4]康公平,伍林涛,张宁,等.硅肥对罗汉果叶片光合特性及果实品质的影响[J].中国农业科技导报,2017,19(7):50-54.
[5]范小玉,赵跃锋,张清华.硅肥对干旱胁迫下茄子幼苗生长及生理特性的影响[J].江苏农业科学,2022,50(9):122-127.
[6]梁永超,丁瑞兴.硅对大麦根系中离子的微域分布的影响及其与大麦耐盐性的关系[J].中国科学(C辑:生命科学),2002(2):113-121.
[7]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:129-174.
[8]张娟.小麦水分利用效率及其相关性状的生理遗传分析研究[D].杨凌:西北农林科技大学,2005.
[9]苏庆旺,苍柏峰,白晨阳,等.施硅量对旱作水稻产量和干物质积累的影响[J].中国水稻科学,2022,36(1):87-95.
[10]张丽佳,蒲玉瑾,李大东,等.不同浓度硅酸钾对降香黄檀幼苗生长及其生理特征的影响[J].海南大学学报(自然科学版),2019,37(1):6-13.
[11]Ashfaque F, InamA, Iqbal S, et al. Response of silicon on metal accumulation, photosynthetic inhibition and oxidative stress in chromium-induced mustard (Brassica juncea L.)[J]. South African Journal of Botany, 2017,111: 153-160.
[12]MA D, SUN D, WANG C, et al. Silicon application alleviates drought stress in wheat through transcriptional multiple antioxidant defense pathways[J]. Journal of Plant Growth Regulation, 2016, 35(1):1-10.
[13]余朝阁,王野,隋心意,等.碳酸钠和碳酸氢钠对番茄壮苗和灰霉病的防治作用[J].中国蔬菜,2018(12):29-32.
[14]李京蕾.硅肥对烟草生长及品质性状的影响[D].泰安:山东农业大学,2019.
[15]刘春成,李中阳,胡超,等.逆境条件下硅肥调控效应研究进展[J].中国土壤与肥料,2021(4):337-346.
[16]宫海军,陈坤明,王锁民,等.植物硅营养的研究进展[J].西北植物学报,2004(12):2385-2392.
[17]邢雪荣,张蕾.植物的硅素营养研究综述[J].植物学通报,1998(2):34-41.
[18]李晓艳.不同吸硅型植物硅同位素组成和营养元素分布特征[D].杭州:浙江大学,2013.
[19]蔡德龙.国内外硅肥研究与应用进展[J].磷肥与复肥,2017,32(1):37-39.
文章摘自:赵银鸿, 杨宇蕾, 王珊珊, 杨阳, 欧阳文静, 汤开磊, 杜光辉. 外源硅对工业大麻生长及生理特性的影响[J]. 中国麻业科学, 1-10.