摘 要:试验研究室外栽培条件下,利用不同占空比的脉冲光源对工业大麻进行补光,探究其对工业大麻生长发育、生理生化以及主要大麻素含量的影响。结果表明:占空比100%(LED1)和占空比70%(LED2)的光源促进了工业大麻株高、茎粗、SPAD值以及花叶干重和鲜重的增加,但LED2与不补光(CK)差异不显著,而占空比50%(LED3)光源显著降低了工业大麻的株高、茎粗、SPAD值以及花叶干重和鲜重;LED1、LED2和LED3促进了工业大麻叶片中可溶性糖、可溶性淀粉以及游离氨基酸的含量,LED1与CK差异显著,LED2和LED3与CK差异不显著;LED1和LED2显著降低了超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CTA)活性,而LED3显著促进抗氧化物酶(SOD、POD和CTA)的活性;LED1显著降低了四氢大麻酚(THC)和大麻二酚(CBD)的含量,而LED1、LED2和LED3显著促进了大麻萜酚(CBG)的含量。LED1和LED2光源均可以促进工业大麻的生长发育,增加可溶性渗透调节物质含量,降低抗氧化物活性,增加CBG含量,为今后利用节能(占空比)脉冲光源提高工业大麻品质和产量提供理论参考。
关键词:工业大麻;脉冲光源;生长特性;生理生化性质;主要大麻素
大麻(Cannabis sativa L.)是一种古老的经济作物,早在5000-6000年前就被人类开发和利用[1]。而工业大麻是指那些可以商业使用的无毒或低毒、无直接毒品利用价值、四氢大麻酚(THC,有致幻性、成瘾性)含量低于0.3%的大麻[2]。工业大麻中含有的大麻素是一类大麻特有的活性成分,是影响工业大麻育种及产业发展的关键因素。研究[3]发现,在工业大麻植株中含有150多种大麻素,其中大麻二酚(CBD,无致幻性、无成瘾性)具有抗炎、杀菌、镇痛、抗焦虑等作用,可用于治疗厌食症、艾滋病、癫痫等;大麻萜酚(CBG,无致幻性、无成瘾性)具有镇静、抗炎、抗菌、抗氧化、抗口腔上皮癌、抑制血小板聚集、降眼压和抑制性激素分泌等作用。
工业大麻是一种对光极度敏感的作物,光照条件严重影响其产量和品质[4]。在工业大麻生长发育过程中进行补光,可以有效提高工业大麻花叶的产量以及大麻素的含量[5]。近年来,随着发光二极管(Light Emitting Diode,LED)的发展,LED灯已经成为植物生长的新一代光源,因其具有环保、轻便、体积小、冷光源、光谱可控等优点,成为植物重要的照明系统[6]。LED灯虽然相比钠灯等其他光源有较低的耗能,但照明的灯具消耗直接影响了收益情况。因此,在LED灯中增加脉冲光,可以有效降低能源的消耗。相比其他类型的光源,LED可以实现对电信号纳秒级的响应,达到连续亮灭的功能,即脉冲的照明方式。脉冲光包括频率(Hz)、光子通量密度(PPFD)和占空比等相关参数,其中频率是指单位时间(秒)内亮灭的次数,占空比是指一个亮灭周期内亮期占该周期的比例。人类的眼睛对频率的识别在60赫兹以内,当超过这个频率人类的眼睛将无法识别而被视为连续光,这种脉冲照明方式的优点是感知不到光的间断而达到节能的效果[7,8,9]。在自然界中植物接收的自然光是连续光,但在实际生长过程中受到云层、叶片的遮挡,长期处于波动的光环境中,类似于脉冲光的效果。有研究[10,11]表明,在脉冲光条件下,莴苣生长速率比连续光提高了20%,在相同光照时间条件下,脉冲光与连续光照射使植物产生的生物量是一致的;占空比为25%的脉冲光与连续光使生菜产生相似的生物量,但获得了更高的叶绿素含量。
工业大麻是一种附加值极高的作物,利用照明设备既可提高其产量和品质,这将带来更大的经济价值。前人针对光质的变化探讨了对工业大麻的影响,如高比例的红蓝光照射工业大麻后,其株高、茎粗、花叶产量以及花叶中的CBD含量均显著增加,而种子成熟天数将延长[12,13];在紫外灯照射下可以增加工业大麻花叶中大麻素的含量,但增加的大麻素含量所带来的经济效益与投入照明灯所消耗的成本不成比例,无商业价值[14]。在可见光中,红光和蓝光是植物光合作用过程中主要吸收光谱,为植物的生长发育提供能量,调节植物的生命活动[15]。因此,本研究设计了一款红蓝比为1:1,PPFD相同,但占空比不同的LED脉冲光源。利用此光源对室外种植的工业大麻进行补光,以期在节能的基础上,提高工业大麻花叶产量和大麻素的含量。
1 材料与方法
1.1 试验条件及供试材料
试验地点:本试验于2023年5—9月在黑龙江省农业科学院盆栽场(黑龙江哈尔滨,45°41′13″N,126°36′57″E)室外进行。
供试品种:本试验选用的工业大麻品种来自国家麻类种质资源库,资源名称为Aquawoman,来自美国,雌雄异株(已雌化处理),对光周期敏感,5~9片掌状裂叶,THC含量小于0.25%。
供试光源:供试光源由建科环能科技有限公司研发,由上海光联照明有限公司生产,三款灯具相关参数如下:
1号灯具(LED1):输入电压220V(AC),功率160W,光束角60?,控制方式DMX512-A(接到LED灯一端插孔中),波段R660±20nm,B460±20nm光谱能量分布如图1所示,光源形式为连续光,占空比为100%。
图1 供试灯具光谱能量分布
2号灯具(LED2):输入电压220V(AC),功率160W,光束角60?,控制方式DMX512-A,波段R660±20nm,B460±20nm光谱能量分布如图1所示,光源形式为脉冲光,脉冲光频率为500Hz,占空比为70%(节能30%),灯具的闪烁比如图2所示。
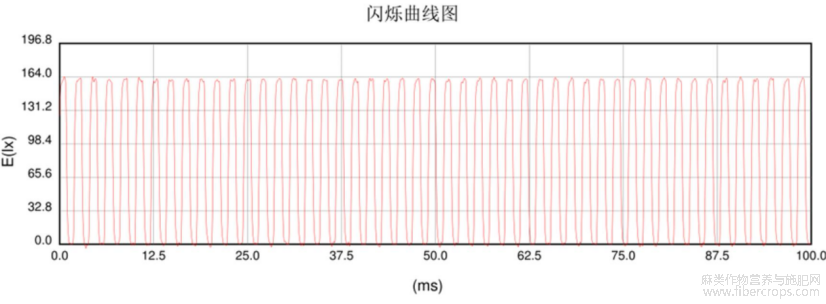
图2 LED2灯具的闪烁曲线
3号灯具(LED3):输入电压220V(AC),功率160W,光束角60?,控制方式DMX512-A,波段R660±20nm,B460±20nm光谱能量分布如图1所示,光源形式为脉冲光,脉冲光频率为500Hz,占空比为50%(节能50%),灯具的闪烁比如图3所示。
图3 LED3灯具的闪烁曲线
1.2 试验设计
本试验根据灯光类型分别设置4个处理,分别为脉冲占空比为100%(LED1)、脉冲占空比70%(LED2)、脉冲占空比50%(LED3)和不补光(CK)。补光方式为顶部补光,每个处理占地面积为1.5m×1m,顶部放置3个补光灯(调整摆放位置,达到整个区域光照条件一致),对照上方放置同样的3个补光灯(不开灯),补光灯的高度随着工业大麻植株的生长逐步调节。
工业大麻植株常规育苗,待植株生长到两对真叶时,选长势一致的壮苗定植到各处理的盆中,每盆定植一株幼苗。每个处理3次重复,每个重复10盆(盆高20cm,上口径19.8cm,下口径15.7cm),随机排列,每隔3天随机变换盆的位置。常规管理,人工除草,不使用任何农药。
工业大麻移栽1周后开始补光。在不打破正常光周期的情况下,在早晚光照强度弱的时候进行补光,将PPFD设置为750μmol/m2/s,在日出后和日落前两个时段进行补光,即日出时开灯直到PPFD达到阈值关灯,日落之前PPFD小于阈值时开灯,在日落时关灯。由于LED灯产热少,可将植株与灯的距离设置为50cm,随着植株的生长,灯的高度随之上升,直至所有植株开花将停止补光试验。
1.3 测定项目及方法
在盛花期(70%植株开花)每一处理、每一重复随机选取植株5株,用直尺测量株高,用游标卡尺准确测量茎粗(茎基部),用SPAD仪测量叶绿素相对含量(SPAD)。将花叶统一取下用电子天平(精度0.0001g)称量其鲜重,之后在105℃高温下杀青30min,60℃恒温烘干至恒重,用电子天平(精度0.0001g)称其花叶干重。
在盛花期,每一处理、每一重复随机选取3株,分别取0.1g叶片,用清水洗净,滤纸吸干表面水分,于液氮条件下带回实验室,-80℃超低温冰箱保存备用。测定植物可溶性蛋白含量、可溶性糖含量和游离氨基酸含量,使用科铭生物技术有限公司(苏州,中国)生产的试剂盒进行测定。具体操作方法参照试剂盒说明书进行。
对工业大麻植株中的超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性进行检测,取样时间与取样方法同上述可溶性渗透调节物质含量测定。检测试剂盒由科铭生物技术有限公司(苏州,中国)提供,具体操作方法参见试剂盒使用说明书。
盛花期为工业大麻中大麻素含量最高时期,因此每一处理、每一重复随机选取3株上的花叶5g,在阴凉通风处阴干,采用高效液相色谱法测定主要大麻素成分CBD、THC和CBG含量。
1.4 数据统计分析
本试验采用Microsoft Excel 2003软件对所得原始数据进行整理分析,利用IMB SPSS 27.0进行显著性差异分析,采用GraphPad Prism 5.0绘制柱形图。
2 结果与分析
2.1 不同占空比的脉冲光对工业大麻主要生长指标的影响
2.1.1 对工业大麻植株株高、茎粗的影响
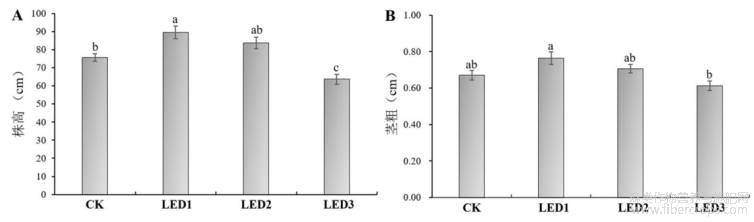
工业大麻是一种对光周期敏感的作物,其生长发育受光周期的调控[4]。如图4所示,对不同脉冲光占空比的LED补光处理和CK进行比较发现,在工业大麻盛花期时,LED1的株高值最大,而LED3的株高值最小,且差异显著,而CK显著低于LED1,高于LED3,与LED2差异不显著(图4A)。对其茎粗进行测定后发现,同样LED1茎粗值最大,LED3茎粗值最小,而CK、LED1与LED2茎粗值无显著差异(图4B)。由此说明,补光后可以明显促进工业大麻的生长,而利用节能30%的LED2灯也可以达到补光的效果,但用节能50%的LED3的灯进行补光时,抑制了工业大麻植株的株高,而对茎粗的影响不显著。
图4 不同占空比的脉冲光对工业大麻株高、茎粗的影响
注:不同小写字母表示差异达显著水平(P<0.05)。下同
2.1.2 对工业大麻叶片SPAD值的影响
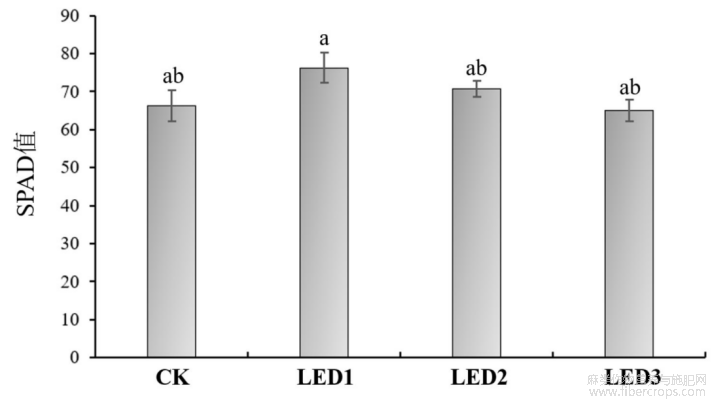
SPAD值可以用来衡量植物叶片中叶绿素的相对含量[16]。因此,本研究利用SPAD仪对不同占空比的脉冲光对工业大麻补光后的叶片进行检测。由于不同植物及同一植物的不同部位的SPAD值均存在一定差异[17]。本研究选择最新完全展开叶片的叶中部位进行SPAD值测定。结果表明,LED1补光后的SPAD值比CK、LED2和LED3增加,但差异不显著(图5)。由此说明,LED1补光灯不能显著增加工业大麻叶片SPAD值,同时,不同占空比的脉冲光源(LED2和LED3)没有影响工业大麻叶片叶绿素合成途径。
图5 不同占空比的脉冲光对工业大麻叶片SPAD值的影响
2.1.3 对工业大麻花叶鲜重、干重的影响
大麻素是工业大麻中特有的次生代谢产物,具有极高的经济价值,其主要存在于工业大麻雌株的花和叶中[18]。由图6可知,LED1可以显著增加花叶的干重和鲜重,而LED2数值较高,与CK和LED1差异不显著,但均显著高于LED3。由此说明,补光可以显著增加工业大麻花叶产量,而占空比为70%的LED灯(LED2)与不补光(CK)差异不显著,占空比为50%的LED(LED3)显著降低花叶产量。
图6 不同占空比的脉冲光对工业大麻花叶鲜重、干重的影响
2.2 不同占空比的脉冲光对工业大麻叶片中可溶性渗透调节物质含量的影响
植物中可溶性渗透调节物质在植物的生长发育过程中具有重要作用,不仅为植物的生长发育提供能量,也是物质代谢过程中的中间产物,而且还具有信号功能[19,20,21]。由图7可知,利用LED补光(LED1、LED2和LED3)可以有效提高可溶性糖(图7A)、可溶性蛋白(图7B)和游离氨基酸(图7C)的含量,但仅有可溶性糖含量在LED1和LED2同CK差异显著,而可溶性蛋白和游离氨基酸的含量在LED2和LED3中与CK无显著差异。由此说明,补光后可以显著提升工业大麻叶片中可溶性渗透调节物质含量,但节能后的LED灯(LED2和LED3)效果不显著。
图7 不同占空比的脉冲光对工业大麻可溶性渗透调节物质含量的影响
2.3 不同占空比的脉冲光对工业大麻叶片中抗氧化物活性的影响
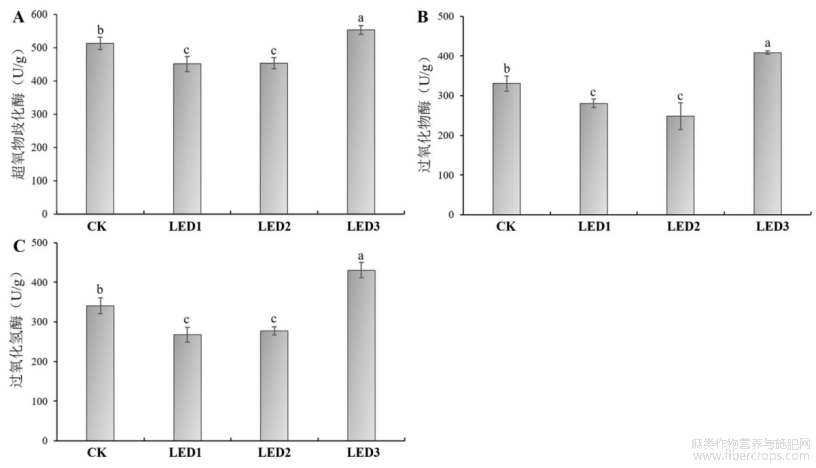
光照条件的变化会对作物产量和品质产生影响,尤其在植物的生存条件不适宜时,会触发植物的自身氧化应激反应,而植物可以通过体内的抗氧化酶系统来平衡[22,23]。由图8可知,LED3中的SOD、POD和CAT活性显著高于其他处理,而LED1和LED2中SOD、POD和CAT活性最低,CK显著低于LED3,显著高于LED1和LED2。由此说明,补光后(LED1)可以显著降低抗氧化酶活性,说明植物生长旺盛,没有外界环境干扰,占空比为70%的LED2与不节能的LED1效果相同。而占空比为50%的LED3中抗氧化酶活性显著高于其他处理,说明节能后影响了植株的正常生长,扰乱了其生长发育进程,因此导致大量的抗氧化酶积累。
图8 不同占空比的脉冲光对工业大麻抗氧化酶活性的影响
2.4 不同占空比的脉冲光对工业大麻花叶中主要大麻素含量的影响
大麻素作为大麻中一种特殊成分,具有极高医药价值,其中CBD和CBG已被证实无致幻成瘾性,且在治疗抑郁症、精神紊乱以及缓解失眠焦虑、治疗帕金森、阿尔茨海默症等方面有显著疗效[24,25,26,27]。由图9可知,LED补光后THC和CBD含量低于CK,其中LED1的THC显著低于CK,而LED2和LED3与CK差异不显著(图9A);LED1和LED3的CBD显著低于CK,而LED2与CK差异不显著(图9B);此外,LED补光后显著增加CBG的含量,其中LED1和LED2显著高于CK和LED3,LED3显著高于CK。由此说明,利用不同占空比的脉冲光对工业大麻补光会降低THC和CBD含量,显著增加CBG含量。
图9 不同占空比的脉冲光对主要大麻素含量的影响
3 讨论与结论
光是影响植物生长发育的重要外界环境因素之一,植物通过感知光传递的信号来调节生长发育以及代谢产物的合成[28]。作为经济效益价值极高的工业大麻,可以通过人工补光提高其附加值。目前,用于植物补光的常用光源为LED光源,通过改变光质、光强、光周期等关键因子,多方面的影响作物的生长发育进程、植株形态建成以及代谢物的积累,实现作物的增产增效[29]。如在不同光谱组成的LED光源与自然光比较中发现,大部分LED光源都能显著增加主要大麻素的含量,降低抗氧化酶活性[30];通过在不同PPFD补光中发现,PPFD对大麻的生长发育和大麻素的含量有重要作用,在光补偿点至光饱和点前,大麻的花叶产量与PPFD成正相关性[31];工业大麻是一种典型的短日照作物,光周期的改变对工业大麻的花期有重要的调控作用,光照时长变短时工业大麻提前开花,导致植株发育不良、产量降低以及大麻素含量降低的现象出现[5]。
虽然LED光源与其他光源相比,有节能环保的优势。但从降低成本,增加工业大麻经济效益方面考虑,还需进一步的节能。本研究利用不同占空比的LED脉冲光源对室外种植工业大麻早晚进行补光,以不补光的植株为对照,探究不同占空比的脉冲光源对工业大麻生长发育、生理生化以及主要大麻素含量的影响。研究结果发现,与CK相比,LED1和LED2补光灯可以显著促进工业大麻的长势(图4)和生物量(图6),而在叶绿素合成方面没有显著的影响(图5)。这与Kozai等[10]研究结果的一致,莴苣在脉冲光下的生长速率比在连续光下,生长速率提高20%,但获得相同的生物量;生菜在25%占空比的脉冲光照射下可以实现与连续光同样的生物量[11]。这些研究均表明,使用适当占空比的脉冲光可以代替连续光源使用,同时利用脉冲光对作物进行补光,可以促进作物的生长发育。
利用LED光源对植物进行补光可以促进植物可溶性糖、可溶性蛋白质、氨基酸的积累,减弱抗氧化酶活性具有显著效果[32]。如在先锋橙和红桔种植过程中,使用LED补光后可以提高植株叶片光合效率,增加可溶性物质含量,同时抗氧化酶活性显著降低[33];用LED补光灯照射茅苍术后发现,在膨大期可以增加SOD、POD和CAT的活性[34]。本研究结果发现,利用不同占空比的脉冲光(LED1、LED2和LED3)对工业大麻进行补光后,叶片中的可溶性糖、可溶性蛋白以及游离氨基酸的含量显著高于CK(图7)。由此推测,补光可以增加工业大麻可溶性物质的积累,但与占空比的大小无关,可能与光的光质和光强有关。而用LED1和LED2补光后工业大麻叶片中的抗氧化酶活性显著低于CK,用LED3补光后叶片中的抗氧化酶活性显著高于CK(图8)。与李思静和李强的研究结果一致[33,34]。由此推测,利用补光灯(LED1)和适当的节能补光灯(LED2)后可以有效降低抗氧化酶活性,但当占空比达到50%(LED3,节能50%)时,明暗交替,使工业大麻感知光的变化,导致光周期发生改,致使其抗氧化酶活性增高,提高自身免疫反应用以抵御外界环境的变化,此现象的出现需今后作进一步的探究。
大麻素作为大麻特殊的代谢产物,具有他作物无法代替的功效[35]。本研究结果发现,利用不同占空比的LED灯(LED2和LED3)补光与不补光(CK)相比,工业大麻中的THC含量无显著差别,而在全补光(LED1)的条件下可以显著降低THC的含量(图9A),由此推测,THC的积累与光的占空比无关,而适当比例的红蓝光可以降低工业大麻花叶中THC的合成。对CBG含量的检测发现,补光可以显著增加工业大麻花叶中CBG的含量,占空比越小,花叶中积累的CBG越少(图9C),由此推测,LED灯中的占空比可以影响工业大麻花叶中CBG含量。而对CBD研究发现,补光后将降低工业大麻花叶中CBD的积累(图9B),由此推测,工业大麻中CBD的合成与LED光源的占空比无关,而与红蓝光的比或是光强有关,这些需要今后进一步的探究。
总之,使用适当占空比的脉冲光对工业大麻进行补光,不仅可以促进工业大麻的生长、提高有利大麻素(CBD和CBG)的积累,还可以降低工业大麻中制毒物质的积累(THC)。同时还可以降低能源消耗,减少工业大麻的种植成本。但占空比使用的最佳比例还需做进一步的试验,以及占空比的脉冲光对工业大麻生长发育进程、形态建成以及代谢物的积累的影响还需进行深入探究。
参考文献
[1] Skoglund G, Nockert M, Holst B. Viking and early middle ages northern Scandinavian textiles proven to be made with hemp[J]. Scientific Reports, 2023, 3: 1-6.
[2] Mauseth J D. Botany: an introduction to plant biology, 3rd edn[M]. Sudbury, M A: Jones and Bartlett Learning, 2003: 422-427.
[3] Christelle M A, Jean-Francois H, Gea G. Cannabis sativa: The plant of the thousand and one molecules[J]. Frontiers in Plant Science, 2016, 7: 19-47.
[4] Salentijn E M, Petit J, Trindade L M. The complex interactions between flowering behavior and fiber quality in hemp[J]. Frontiers in Plant Science, 2019, 10: 143-161.
[5] Lisson S N, Mendham N J, Carberry P S. Development of a hemp (Cannabis sativa L.) simulation model 2. The flowering response of two hemp cultivars to photoperiod[J]. Australian Journal of Experimental Agriculture, 2000, 3(40): 413-417.
[6] 刘文科, 杨其长. 人工光在植物工厂中的应用[J]. 照明工程学报, 2014, 25 (4): 50-53.
[7] CHIU H J, LO Y K, CHEN J T, et al. A high-efficiency dimmable LED driver for low-power lighting applications[J]. IEEE Transactions on Industrial Electronics, 2009, 57(2): 735-743.
[8] Choi J, Cho E, Ghassemlooy Z, et al. Visible light communications employing PPM and PWM formats for simultaneous data transmission and dimming[J]. Optical and Quantum Electronics, 2015, 47(3): 561-574.
[9] 霍东旭, 鄢波, 施建青, 等. 基于“视觉亮度”的白光LED光色性能研究[J]. 照明工程学报, 2014, 25(6): 27-31.
[10] Kozi T. Closed systems for high quality transplants using minimum resources[M]. Plant Tissue Culture Engineering. Springer, Dordrecht, 2008: 275-312.
[11] 牟孙涛, 王嘉萱, 辛鑫, 等. 不同脉冲光对生菜生长、品质及光合特性的影响[J]. 中国农业科技导报, 2020, 22(5): 35-41.
[12] 陈璇, 许艳萍, 张庆滢, 等. 大麻种质资源中大麻素化学型及基因型鉴定与评价[J]. 植物遗传资源学报, 2016, 17(5): 920-928.
[13] WEI X Y, ZHAO X L, LONG S H, et al. Wavelengths of LED light affect the growth and cannabidiol content in Cannabis sativa L[J]. Industrial Crops and Products, 2021, 165(1): 113-142.
[14] Llewellyn D, Golem S, Foley E, et al. Cannabis yield increased proportionally with light intensity, but additional ultraviolet radiation did not affect yield or cannabinoid content[J]. Frontiers in Plant Science, 2021, 4(3): 234-251.
[15] 刘慧莲, 姜倩倩. 不同LED光质对番茄幼苗生长的影响[J]. 北方园艺, 2020(18): 38-42.
[16] 郝学明, 王响铃, 宋柏权, 等. 甜菜叶片SPAD值和光合色素的相关性研究[J]. 农学学报, 2019, 9(10): 65-70.
[17] 陈琴, 陈莉敏, 郑群英, 等. 5种牧草叶片上不同部位的SPAD值比较[J]. 草业科学, 2014, 31(7): 1318-1322.
[18] Backer B D, Maebe K, Verstraete A G, et al. Evolution of the content of THC and other major cannabinoids in drug-type cannabis cuttings and seedlings during growth of plants[J]. Journal of Forensic Sciences, 2012, 57(4): 918-922.
[19] Dijken V A J H, Schluepmann H, Smeekens S C M. Arabidopsis trehalose-6-phosphate synthase 1 is essential for normal vegetative growth and transition to flowering[J]. Plant Physiology, 2004, 135(2): 969-977.
[20] Takahashi F, Sato-Nara K, Kobayashi K, et al. Sugar-induced adventitious roots in Arabidopsis seedlings[J]. Journal of Plant Research, 2003, 116(2): 83-91.
[21] Kato-Noguchi H, Yasuda Y, Sasaki R. Soluble sugar availability of aerobically germinated barley, oat and rice coleoptiles in anoxia[J]. Journal of Plant Physiology, 2010, 167(18): 1571-1576.
[22] Heshmati S, Dehaghi M A, Farooq M, et al. Role of melatonin seed priming on antioxidant enzymes and biochemical responses of carthamus tinctorius L. under drought stress conditions[J]. Plant Stress, 2021, 2: 100023.
[23] Choudhury F K, Rivero R M, Blumwald E, et al. Reactive oxygen species, abiotic stress and stress combination[J]. The Plant Journal, 2017, 90(5): 856-867.
[24] Libro R, Diomede F, Scionti D, et al. Cannabidiol modulates the expression of alzheimer's disease-related genes in mesenchymal stem cells[J]. International Journal of Molecular Sciences, 2017, 18(1): 26-39.
[25] Devinsky O, Marsh E, Friedman D, et al. Cannabidiol in patients with treatment-resistant epilepsy: an open-label interventional trial[J]. Lancet Neurology, 2016, 15(3): 270-278.
[26] Blessing E M, Steenkamp M M, Manzanares J, et al. Cannabidiol as a potential treatment for anxiety disorders[J]. Neurotherapeutics, 2015, 12(4) :825-836.
[27] 史文强, 公绪栋, 吴春晖, 等. 大麻二酚及其类似物研究进展[J]. 药学进展, 2020, 44(9): 710-720.
[28] Botterweg-Paredes E, Blaakmeer A, Hong S Y, et al. Light affects tissue patterning of the hypocotyl in the shade-avoidance response[J]. PLoS Genetics, 2020, 16(3): e1008678.
[29] 杨其长. 植物工厂现状与发展战略[J]. 农业工程技术, 2016, 36(10): 9-12.
[30] Islam M J, Obyedul M, Azad K, et al. Cannabinoids accumulation in hemp (Cannabis sativa L) plants under LED light spectra and their discrete role as a stress marker[J]. Biology, 2020, 10(8): 710-729.
[31] Eaves J, Eaves S, Morphy C, et al. The relationship between light intensity, cannabis yields, and profitability[J]. Agronomy Journal, 2020, 112(2): 1466-1470.
[32] LI Q Z, XU J X, YANG L Y, et al. LED light quality affect growth, alkaloids contents, and expressions of amaryllidaceae alkaloids biosynthetic pathway genes in lycoris longituba[J]. Journal of Plant Growth Regulation, 2021, 41(4): 1-14.
[33] 李思静. 不同LED光对先锋橙和红桔幼苗生长发育及生理特性的影响[D]. 重庆: 西南大学, 2018.
[34] 李强. 光影响茅苍术倍半萜类挥发油生物合成的机理研究[D]. 广州: 广东药科大学, 2018.
[35] Elsohly M A, Radwan M M, Gul W, et al. Phytochemistry of Cannabis sativa L[M]. New York: Springer International Publishing, 2017, 457-489.
文章摘自:唐立郦,张晟齐,王飞,等. 不同占空比的脉冲光源对工业大麻生长和生理生化的影响 [J/OL]. 中国麻业科学, 1-18[2024-03-31]. http://kns.cnki.net/kcms/detail/43.1467.S.20240325.1418.014.html.