摘 要:本发明提供了一种利用油菜生物合成大麻二酚(cannabidiol,CBD)的方法及应用,属于植物育种技术和生物合成技术领域;在本发明中,首先将4个基因TKS、OAC、PT4和CBDAS按照油菜对遗传密码子优化,并将这些基因克隆到pCAMBIA1300?35S?NOS过表达载体中,然后遗传转化油菜,对获得的阳性植株进行杂交从而获得4个基因共过表达的油菜植株,并用于生物合成CBD。本发明成功利用油菜生物合成具有生物活性的CBD,而且不产生四氢大麻酚(tetrahydrocannabinol,THC),安全性极高,本发明的方法具有生产成本较低,可实现规模化生产等优点。
权利要求书
1.一组用于油菜生物合成大麻二酚CBD的序列元件,所述序列元件包括基因TKS、OAC、PT4、CBDAS;其中所述TKS的核苷酸序列如SEQIDNo:1所示;
所述OAC的核苷酸序列如SEQIDNo:2所示;
所述PT4的核苷酸序列如SEQIDNo:3所示;
所述CBDAS的核苷酸序列如SEQIDNo:4所示。
2.一种合成大麻二酚CBD的过表达载体,所述过表达载体包含权利要求1所述序列元件中的基因TKS、OAC、PT4和/或CBDAS。
3.根据权利要求2所述的过表达载体,所述载体包括pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS或pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
4.包含权利要求2或3所述过表达载体的重组菌。
5.根据权利要求4所述的重组菌,所述重组菌的宿主菌包括农杆菌GV3101。
6.权利要求1所述序列元件、权利要求2或3所述过表达载体、权利要求4或5所述重组菌的应用,所述应用包括生物合成CBD中的应用、和/或在生物合成CBD的甘蓝型油菜育种中的应用。
7.一种利用油菜生物合成CBD的方法,其特征在于,所述方法包括:
(1)构建过表达载体Ⅰ和过表达载体Ⅱ;
(2)将过表达载体Ⅰ和过表达载体Ⅱ分别转化农杆菌,得到分别含有过表达载体Ⅰ和过表达载体Ⅱ的农杆菌;
(3)农杆菌菌液分别介导油菜下胚轴转化,得到分别含有过表达载体Ⅰ和过表达载体Ⅱ的转基因植株;
(4)将含有过表达载体Ⅰ的转基因植株和过表达载体Ⅱ的转基因植株进行杂交,获得多个基因共过表达的植株,即表达CBD的植株。
8.根据权利要求7所述的方法,其特征在于,所述过表达载体Ⅰ为pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS,所述过表达载体Ⅱ为pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
9.根据权利要求8所述的方法,其特征在于,所述过表达载体Ⅰ和Ⅱ的构建方法包括:
构建过表达载体pCAMBIA1300?35S?TKS?NOS、pCAMBIA1300?35S?OAC?NOS、pCAMBIA1300?35S?PT4?NOS和pCAMBIA1300?35S?CBDAS?NOS;
扩增载体pCAMBIA1300?35S?OAC?NOS和pCAMBIA1300?35S?PT4?NOS中的35S?OAC?NOS和35S?PT4?NOS序列片段;
将35S?OAC?NOS和35S?PT4?NOS序列片段分别连接到pCAMBIA1300?35S?TKS?NOS和pCAMBIA1300?35S?CBDAS?NOS载体上,得到过表达载体Ⅰ:pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS和过表达载体Ⅱ:pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
10.根据权利要求7所述的方法,其特征在于,所述农杆菌为农杆菌GV3101。
技术领域
本发明属于植物育种技术和生物合成技术领域,具体涉及一种利用油菜生物合成大麻二酚(cannabidiol,CBD)的方法及应用。
背景技术
大麻的标志性成分大麻素及其类似物因其潜在的医疗用途而被广泛研究,其中,非精神活性成分大麻二酚(cannabidiol,CBD)是大麻素的主要成分,CBD在抗肿瘤、神经系统保护(抗抑郁、抗焦虑等)、免疫调节和抗炎抗氧化等方面具有药用价值,并对心血管系统和呼吸系统具有保护作用,且CBD不具有精神活性,因此被广泛地运用在保健、护肤、医疗、食品等多个领域。
虽然大麻应用广泛,但其主活性成分大麻素类化学成分复杂,分析方法多样,给研究者造成了一定的不便;而且,大麻中含有精神致幻成分四氢大麻酚(tetrahydrocannabinol,THC),依其含量的高低决定大麻品种种类的划分,根据THC的含量将大麻分为医用大麻(THC>0.3%)、工业大麻(THC<0.3%,CBD低含量)两类;其中,THC具有精神活性,会使人产生幻觉和依赖性,对公共卫生安全造成威胁,在我国严禁种植和使用医用大麻。目前CBD可以通过提取或化学合成来获得,通过化学合成的方法,会使得CBD的化学结构受到一定影响,应用较少;另外是从工业大麻中直接提取,而工业大麻种植范围有限。因此,如果能通过生物合成CBD,尤其是利用植物的光合作用合成,而无需高耗能、高耗氧等复杂过程,是最可行也是本领域期待的优势方法。
油菜(BrassicanapusL.)是我国种植最广泛的油料作物之一,是我国重要的经济作物之一,油菜的生物育种和种子工程技术发展迅速,对农业生物种质资源挖掘与创新利用是当前发展之重,若能利用油菜生物合成CBD,将极大扩展油菜在生物种质资源方面的应用。
发明内容
针对现有技术的一些缺点与不足,本发明提供一种利用油菜生物合成大麻二酚(CBD)的方法及应用。并且在本发明中,利用在甘蓝油菜中共过表达4个基因,获得了一种生物合成大麻二酚CBD的转基因植株。
为达到上述技术目的,本发明提供如下技术方案:
本发明中,首先提供了一组用于油菜生物合成大麻二酚CBD的序列元件,所述序列元件包括基因TKS、OAC、PT4、CBDAS;其中
TKS的核苷酸序列如SEQIDNo:1所示,氨基酸序列如SEQIDNo:5所示;
OAC的核苷酸序列如SEQIDNo:2所示,氨基酸序列如SEQIDNo:6所示;
PT4的核苷酸序列如SEQIDNo:3所示,氨基酸序列如SEQIDNo:7所示;
CBDAS的核苷酸序列如SEQIDNo:4所示,氨基酸序列如SEQIDNo:8所示。
本发明还提供一种合成大麻二酚CBD的过表达载体,所述过表达载体包含所述合成CBD的序列元件,所述过表达载体包括pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS或pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
本发明还提供包含所述过表达载体的重组菌,所述重组菌的宿主菌包括农杆菌GV3101。
本发明还提供所述序列元件、所述过表达载体、所述重组菌的应用,所述应用包括:生物合成CBD中的应用;和/或在生物合成CBD的甘蓝型油菜育种中的应用。
本发明中,还提供了一种利用油菜生物合成CBD的方法,所述方法包括:
(1)构建过表达载体Ⅰ(pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS)和过表达载体Ⅱ(pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS);
(2)将过表达载体Ⅰ和过表达载体Ⅱ转化农杆菌,得到分别含有过表达载体Ⅰ和过表达载体Ⅱ的农杆菌;
(3)农杆菌菌液分别介导油菜下胚轴转化,得到分别含有过表达载体Ⅰ和过表达载体Ⅱ的转基因植株;
(4)将含有过表达载体Ⅰ和过表达载体Ⅱ的转基因植株进行杂交,获得4个基因共过表达的植株,即表达CBD的植株。
进一步的,所述过表达载体Ⅰ为pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS,过表达载体Ⅱ为pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
进一步的,所述过表达载体Ⅰ和Ⅱ的构建方法包括:
构建过表达载体pCAMBIA1300?35S?TKS?NOS、pCAMBIA1300?35S?OAC?NOS、pCAMBIA1300?35S?PT4?NOS和pCAMBIA1300?35S?CBDAS?NOS;
扩增pCAMBIA1300?35S?OAC?NOS和pCAMBIA1300?35S?PT4?NOS中的35S?OAC?NOS和35S?PT4?NOS序列片段;
将35S?OAC?NOS和35S?PT4?NOS序列片段分别连接到pCAMBIA1300?35S?TKS?NOS和pCAMBIA1300?35S?CBDAS?NOS载体上,得到过表达载体Ⅰ:pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS和过表达载体Ⅱ:pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS。
进一步的,所述农杆菌为农杆菌GV3101。
与现有技术相比,本发明的有益效果在于:
油菜作为生物合成CBD的材料具有其他植株所没有的优势:油菜是一种越冬作物,可以充分利用冬闲田作为生产基地;油菜适应性强,可以在中国从南到北都可以生长;油菜生物量大,每亩可达4?5吨;油菜遗传转化体系成熟。
本发明利用油菜生物合成CBD的方法,避免了CBD在酵母中合成的生产成本高、效率不高等缺点。
本发明利用油菜来进行CBD的合成,实现了CBD的特异性表达,且合成生物量大、可利用冬闲田等优势;另外得到的可生物合成的转基因植株油菜叶片中的CBD含量高。
本发明成功利用油菜生物合成CBD,极大的扩展了油菜在生物医药领域的应用。有助于推动医疗健康领域的发展。
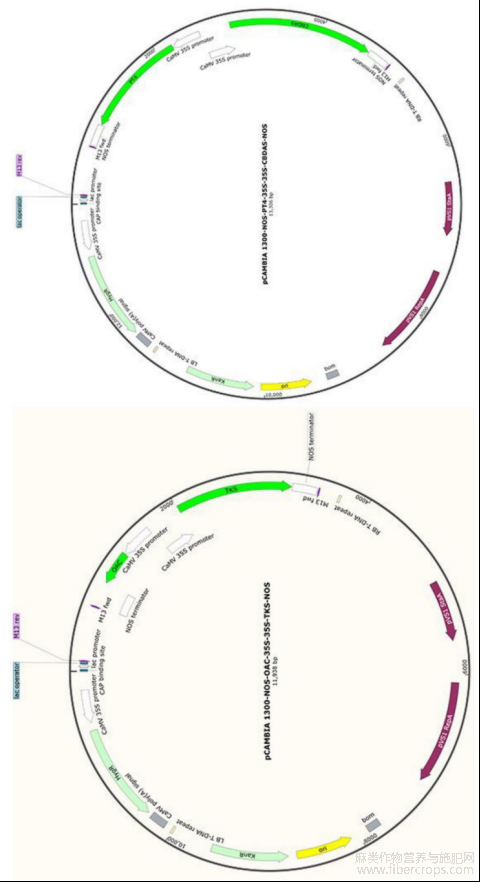
图1为过表达载体Ⅰ和过表达载体Ⅱ的结构示意图。
图1
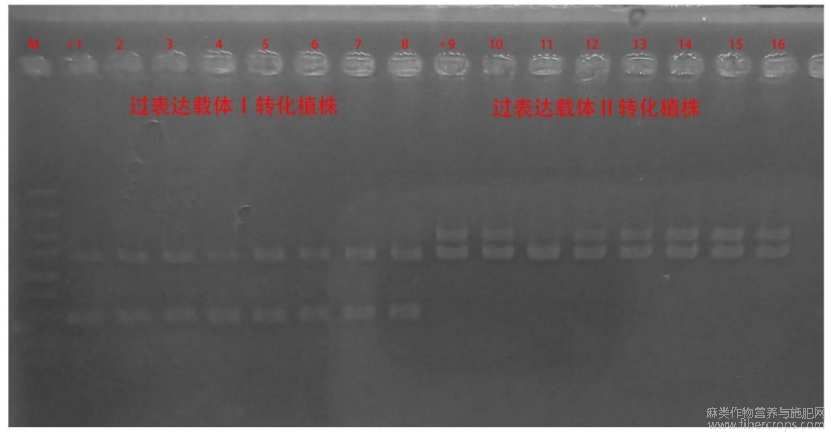
图2为遗传转化获得的14株过表达植株中提取叶片基因组PCR鉴定胶图;图中2?8为过表达载体Ⅰ转化植株;10?16为过表达载体Ⅱ转化植株。
图2
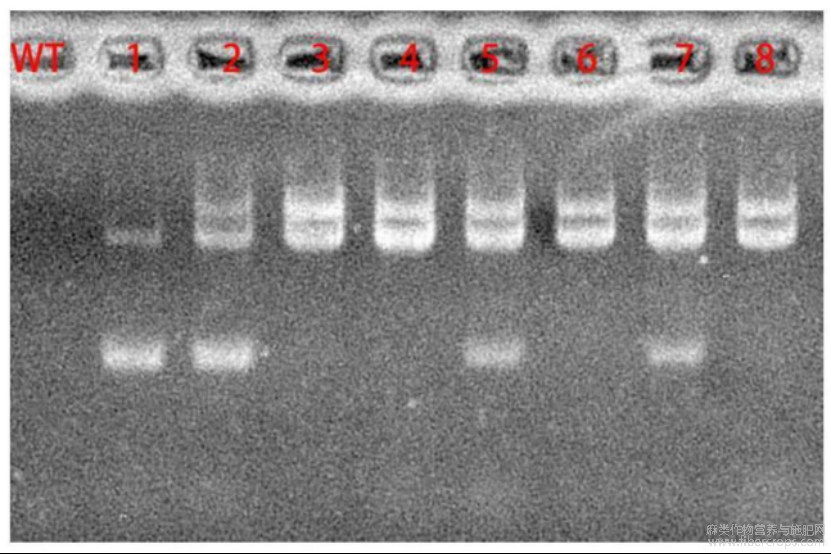
图3为过表达载体Ⅰ和过表达载体Ⅱ转化植株杂交后代植株中提取叶片基因组PCR鉴定胶图;WT:中双11;1?8为杂交后代植株。
图3
图4为不同油菜株系的叶片中CBD的HPLC?UV图。
图4
具体实施方式
下面结合附图以及具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
在以下的实施例中,未详细描述的各种过程和方法均是本领域中公知的常规方法。所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时表明,其后所用相同试剂无特殊说明,均以首次表明的内容相同;所涉及到的是试剂、材料等如无特殊说明,均为商业途径获得。
本发明中所采用的培养基及其配方如下所示:
LB(Luria?Bertani)液体培养基:称取胰蛋白胨10g、酵母提取物5g、氯化钠10g溶于80mL双蒸水中,定容至1L,然后分装至10个锥形瓶用封口膜封口,121℃高温高压灭菌15min,冷却后放入4℃冰箱保存。
LB固体培养基:称取胰蛋白胨10g、酵母提取物5g、氯化钠10g、琼脂粉15g溶于800mL双蒸水中,然后定容至1L,然后分装至10个锥形瓶用封口膜封口,121℃高温高压灭菌15min,冷却后放入4℃冰箱保存。使用时放入微波炉中加热至融化,待液体冷却到50℃左右加入抗生素,摇匀后立刻倒至无菌平皿中,每皿约10mL。
M0培养基:MS(Murashige Skoog Medium)粉4.4g/L,蔗糖30g/L,双蒸水定容,调节pH值为5.84?5.88,凝固剂Agar10g/L,灭菌后分装。
DM(Dilutionmedium)培养基:MS粉4.4g/L,蔗糖30g/L,双蒸水定容,调节pH值为5.84?5.88,灭菌,等培养基冷却后加入AS,1L中加入1mLAS(母液100μmol/mL),放于4℃冰箱待用,也可以在用时再加入AS(乙酰丁香酮)。
M1培养基:MS粉4.4g/L,蔗糖30g/L,甘露醇18g/L,2,4?D(二氯苯氧乙酸)1mg/L,KT(激动素)0.3mg/L,双蒸水定容,调节pH值为5.84?5.88,凝固剂Agar10g/L,灭菌后等培养基冷却后加入AS,1L中加入1mLAS(母液100μmol/mL),放于4℃冰箱待用,也可以在用时再加AS。
M2培养基:MS粉4.4g/L,蔗糖30g/L,甘露醇18g/L,2,4?D1mg/L,KT0.3mg/L,双蒸水定容,调节pH值为5.84?5.88,凝固剂Agar10g/L,灭菌后等培养基冷却后加入:TMT(特美汀)300mg/L,STS(M3培养基:MS粉4.4g/L,葡萄糖10g/L,木糖0.25g/L,MES(吗啉乙磺酸)0.6g/L,双蒸水定容,调节pH值为5.84?5.88,凝固剂Agar10g/L,灭菌后等培养基冷却后加入:ZT(反式玉米素)2mg/L,IAA(吲哚乙酸)0.1mg/L,TMT300mg/L,STS150μmol/L,卡那霉素25mg/L,然后分装到无菌平皿中。
M4培养基:MS粉4.4g/L,蔗糖10g/L,双蒸水定容,调节pH值为5.84?5.88,凝固剂Agar8g/L,灭菌后等培养基冷却后加入:TMT300mg/L,然后分装。
实施例1:TKS、OAC、PT4和CBDAS基因获得及载体构建
根据大麻基因组网站(http://genome.ccbr.utoronto.ca/cgi?bin/hgGateway)获得大麻TKS(SequenceID:AB164375.1)、OAC(SequenceID:JN679224.1)、PT4(SequenceID:BK010648.1)和CBDAS(SequenceID:KP970866.1)基因的cDNA序列。然后,这些序列使用在线密码子优化工具(https://www.novopro.cn/tools/codon?optimization.html)进行优化,获得TKS、OAC、PT4和CBDAS优化后cDNA,优化后的核苷酸序列分别如SEQIDNo:1、SEQIDNo:2、SEQIDNo:3和SEQIDNo:4所示,氨基酸序列如SEQIDNo:5、SEQIDNo:6、SEQIDNo:7和SEQIDNo:8所示。
35S序列如SEQIDNo:9所示,NOS序列如SEQIDNo:10所示。
4个序列由生工生物工程(上海)股份有限公司进行合成,并分别构建到pCAMBIA1300?35S?NOS载体(常规购买)上,将得到的表达载体命名为pCAMBIA1300?35S?TKS?NOS、pCAMBIA1300?35S?OAC?NOS、pCAMBIA1300?35S?PT4?NOS和pCAMBIA1300?35S?CBDAS?NOS。
根据pCAMBIA1300?35S?NOS载体序列,设计同源重组引物,引物序列为:
FMF(SEQIDNo:11):
TTTGTTGAAAAGTCTCAATTGTCTCAGAAGACCAAAGGGCA
FMR(SEQIDNo:12):
CAGAAGACCAAAGGGCAATTGTCCCAGTCACGACGTTGTAA
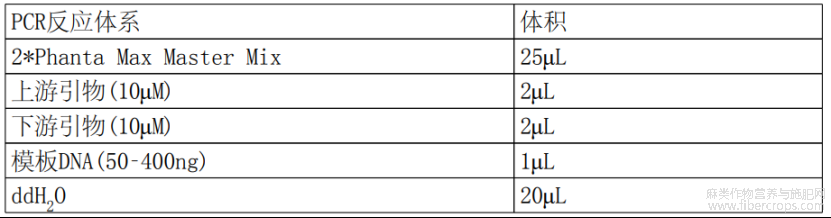
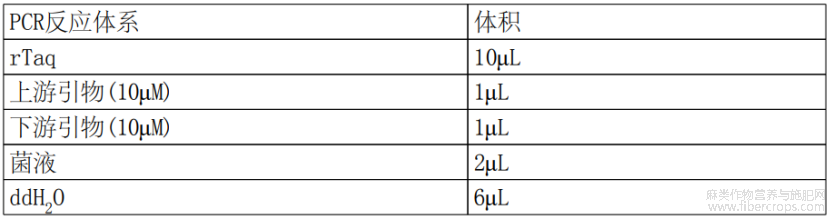
根据pCAMBIA1300?35S?OAC?NOS和pCAMBIA1300?35S?PT4?NOS的合成序列分别为模板,使用高保真酶2*PhantaMAXMasterMix(购自南京诺唯赞生物科技股份有限公司)扩增35S?OAC?NOS和35S?PT4?NOS序列片段,PCR反应体系如表1所示。
表1 高保真酶PCR扩增反应体系
PCR反应程序为:95℃预变性3min;95℃变性15s、52℃退火15s、72℃延伸30s,共进行35个循环;72℃终延伸5min。
PCR反应结束后,将PCR产物在2%琼脂糖凝胶(质量体积分数)中120V进行凝胶电泳30min,然后在紫外凝胶成像仪下照相,记录结果。
结果显示,引物FMF和FMR成功扩增出目的片段,即35S?OAC?NOS和35S?PT4?NOS序列片段,片段的大小分别为1015bp和1906bp。
参照UNIQ?10柱式DNA胶回收试剂盒(购自生工生物工程(上海)股份有限公司)中说明书操作说明,从琼脂糖凝胶中回收PCR扩增产物35S?OAC?NOS和35S?PT4?NOS序列片段,然后将回收的PCR扩增产物35S?OAC?NOS和35S?PT4?NOS序列片段分别连接到pCAMBIA1300?35S?TKS?NOS和pCAMBIA1300?35S?CBDAS?NOS载体上,连接体系为:4.5μL胶回收产物、0.5μLpCAMBIA1300?35S?TKS?NOS载体/pCAMBIA1300?35S?CBDAS?NOS载体、5μLSolutionⅠ(购自宝生物工程(大连)有限公司),在16℃下连接过夜,得到连接产物。
向30μL大肠杆菌感受态细胞(购自南京诺唯赞生物科技股份有限公司)中加入10μL的连接产物,通过热激法将连接产物转入大肠杆菌DH5ɑ中,然后利用含终浓度为30mg/mL的Kan的LB培养基筛选阳性菌落,并挑取10个单菌落震荡培养12?16h,取2μL菌液作为模板PCR扩增进行鉴定,PCR反应的引物为:
FMJF(SEQIDNo:13):ACGCACAATCCCACTATCCTTC
FMJR(SEQIDNo:14):ATTGCCAAATGTTTGAACGATC
PCR扩增反应体系如表2所示,PCR反应程序为:94℃预变性3min;94℃变性30s、50℃退火30s、72℃延伸1min,共进行28个循环;72℃终延伸10min。
表2 菌液PCR扩增反应体系
将PCR扩增的结果在1%的琼脂糖凝胶上进行检测,检测发现得到的DNA片段为445bp和1336bp,证明转化成功,各选3份转化成功的菌液分别吸取100μL送到生工生物工程(上海)股份有限公司测序。测序正确的表明载体构建成功。
结果表明,该实施例成功构建2个过表达载体:
过表达载体Ⅰ:pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS和过表达载体Ⅱ:pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS,两个过表达载体结构示意图如图1所示。
提取质粒转化农杆菌感受态GV3101,得到2种转化株(包含过表达载体Ⅰ的农杆菌和包含过表达载体Ⅱ的农杆菌),挑取阳性单克隆,用于遗传转化。
所涉及序列信息如下:
SEQ ID No:1:
ATGAACCATCTACGTGCCGAAGGCCCAGCTAGCGTTCTAGCTATCGGTACTGCAAACCCTGAGAACATCCTCCTCCAGGACGAGTTTCCAGATTACTACTTCCGTGTTACTAAGTCGGAGCATATGACCCAACTTAAAGAAAAATTCAGGAAGATTTGCGACAAATCCATGATCAGAAAGCGTAACTGTTTTCTGAATGAGGAACATCTGAAGCAGAACCCAAGACTTGTTGAACATGAAATGCAGACTTTGGACGCCAGACAAGACATGCTCGTCGTTGAAGTGCCCAAATTGGGAAAAGATGCATGCGCTAAAGCAATCAAAGAATGGGGACAACCGAAATCAAAGATTACACATCTCATCTTCACATCGGCATCTACCACGGACATGCCAGGTGCTGACTACCACTGTGCCAAGTTGCTTGGACTGTCCCCCTCTGTGAAGCGTGTGATGATGTATCAGCTTGGTTGCTACGGTGGAGGAACCGTTCTGAGGATTGCAAAGGATATCGCCGAGAACAACAAAGGCGCGAGAGTTTTGGCTGTGTGTTGCGACATTATGGCATGTTTGTTTCGTGGCCCTTCCGAGAGTGATTTGGAACTCCTCGTTGGACAAGCTATTTTCGGTGACGGCGCCGCTGCTGTCATTGTCGGGGCTGAGCCAGATGAATCTGTGGGTGAAAGGCCCATCTTCGAGTTGGTCTCCACCGGGCAGACAATCTTGCCAAATTCCGAGGGTACAATCGGTGGACACATTAGAGAGGCTGGACTCATTTTCGATCTGCACAAAGATGTTCCGATGTTGATCAGCAATAACATAGAGAAGTGTTTGATCGAGGCTTTCACTCCCATCGGTATCAGTGATTGGAATTCTATCTTCTGGATAACGCATCCAGGAGGTAAGGCCATTCTTGATAAAGTTGAAGAAAAACTGCATTTGAAGAGCGACAAGTTCGTTGACTCCAGACATGTTTTGTCTGAGCACGGTAACATGTCTTCCAGTACTGTTCTCTTTGTTATGGATGAGCTAAGGAAGAGAAGTTTGGAAGAAGGTAAGAGCACCACCGGAGATGGATTCGAGTGGGGAGTGCTCTTCGGATTTGGCCCAGGACTAACTGTGGAGAGGGTGGTTGTTAGGTCAGTCCCGATTAAGTACTAA
SEQIDNo:2:
ATGGCTGTCAAACATCTGATAGTCCTTAAGTTCAAGGATGAAATTACAGAAGCTCAGAAGGAAGAATTTTTTAAAACGTACGTAAACTTGGTTAACATTATACCTGCTATGAAGGATGTGTACTGGGGTAAGGATGTGACCCAGAAGAATAAGGAGGAAGGATACACCCACATAGTTGAGGTGACATTCGAAAGCGTGGAAACTATACAGGATTACATCATCCATCCTGCCCACGTGGGATTTGGAGATGTTTACCGTAGTTTCTGGGAAAAACTGCTCATTTTTGATTACACCCCCAGGAAATAG
SEQIDNo:3:
ATGGGACTCAGCCTCGTCTGTACATTTAGCTTTCAGACCAACTACCACACACTTCTTAACCCGCACAACAAGAACCCAAAAAACTCACTCCTTTCGTACCAACACCCTAAGACGCCTATTATAAAGTCTTCGTACGATAATTTTCCCTCTAAATATTGTCTGACGAAGAACTTCCATTTGCTTGGTCTCAACAGCCATAACAGAATTTCGTCGCAGTCTCGTTCAATCAGGGCAGGGAGCGATCAAATCGAGGGATCACCACATCATGAGAGCGATAATTCTATAGCCACGAAAATCTTGAACTTTGGTCATACCTGTTGGAAGTTGCAACGTCCCTATGTTGTGAAGGGAATGATCTCGATAGCATGTGGACTTTTTGGTAGGGAACTTTTTAACAACAGGCACCTCTTCAGTTGGGGGCTTATGTGGAAAGCCTTTTTCGCTTTGGTGCCTATCCTTTCTTTCAACTTTTTTGCAGCTATTATGAACCAGATCTATGATGTGGACATCGATAGGATTAACAAGCCTGATCTGCCACTCGTGTCAGGTGAGATGTCTATTGAGACAGCGTGGATTTTGAGCATAATTGTGGCGCTCACTGGATTGATTGTAACGATTAAGCTCAAGTCAGCACCATTGTTCGTTTTTATTTACATATTCGGTATTTTCGCTGGTTTCGCTTACTCCGTGCCTCCAATCCGTTGGAAACAGTATCCATTCACTAACTTCCTGATCACGATTTCTAGCCATGTGGGACTCGCATTCACGAGCTATTCCGCAACAACTTCAGCTCTAGGACTCCCTTTCGTTTGGAGGCCTGCTTTTAGTTTTATCATCGCTTTCATGACCGTTATGGGAATGACAATCGCTTTTGCAAAGGACATCTCCGATATCGAGGGAGATGCTAAGTATGGTGTGAGTACTGTTGCTACAAAACTCGGGGCCAGGAACATGACTTTCGTGGTGTCTGGTGTGCTTCTCTTGAACTACCTTGTCTCAATCTCTATAGGAATCATTTGGCCTCAAGTTTTCAAAAGCAACATAATGATCCTCTCACATGCAATACTAGCTTTCTGCCTCATTTTCCAAACAAGGGAGTTGGCTTTGGCGAATTATGCAAGTGCTCCTAGCAGACAATTCTTCGAGTTTATTTGGCTCCTCTATTATGCGGAGTACTTTGTTTATGTCTTCATATAA
SEQIDNo:4:
ATGAAGTGCAGCACATTTTCTTTCTGGTTCGTCTGTAAAATTATTTTTTTTTTCTTCTCGTTCAATATCCAGACTAGTATTGCCAACCCGAGAGAGAATTTTCTGAAATGTTTCAGTCAATACATCCCTAACAATGCAACTAATTTGAAGCTCGTTTATACTCAAAACAATCCGCTCTACATGTCCGTGCTTAATAGCACTATTCATAACCTTAGGTTTACCTCCGATACTACCCCGAAACCGCTCGTCATTGTCACACCTAGCCACGTGTCTCACATTCAGGGGACCATCCTTTGTAGTAAGAAAGTTGGACTTCAAATAAGGACTAGAAGCGGGGGACACGATTCTGAGGGCATGTCATATATTTCACAGGTCCCGTTTGTCATAGTGGATTTGAGAAACATGAGGAGCATCAAGATTGATGTGCATAGCCAGACCGCTTGGGTTGAAGCTGGTGCTACTCTCGGGGAGGTGTATTATTGGGTTAATGAAAAGAACGAGAACCTTTCACTCGCCGCAGGATATTGTCCGACTGTCTGTGCAGGTGGGCACTTCGGAGGAGGTGGTTATGGTCCCTTGATGAGAAATTACGGACTCGCTGCGGACAA
SEQ.ID.No:5:
MNHLRAEGPASVLAIGTANPENILLQDEFPDYYFRVTKSEHMTQLKEKFRKICDKSMIRKRNCFLNEEHLKQNPRLVEHEMQTLDARQDMLVVEVPKLGKDACAKAIKEWGQPKSKITHLIFTSASTTDMPGADYHCAKLLGLSPSVKRVMMYQLGCYGGGTVLRIAKDIAENNKGARVLAVCCDIMACLFRGPSESDLELLVGQAIFGDGAAAVIVGAEPDESVGERPIFELVSTGQTILPNSEGTIGGHIREAGLIFDLHKDVPMLISNNIEKCLIEAFTPIGISDWNSIFWITHPGGKAILDKVEEKLHLKSDKFVDSRHVLSEHGNMSSSTVLFVMDELRKRSLEEGKSTTGDGFEWGVLFGFGPGLTVERVVVRSVPIKY
SEQ.ID.No:6:
MAVKHLIVLKFKDEITEAQKEEFFKTYVNLVNIIPAMKDVYWGKDVTQKNKEEGYTHIVEVTFESVETIQDYIIHPAHVGFGDVYRSFWEKLLIFDYTPRK
SEQ.ID.No:7:
MGLSLVCTFSFQTNYHTLLNPHNKNPKNSLLSYQHPKTPIIKSSYDNFPSKYCLTKNFHLLGLNSHNRISSQSRSIRAGSDQIEGSPHHESDNSIATKILNFGHTCWKLQRPYVVKGMISIACGLFGRELFNNRHLFSWGLMWKAFFALVPILSFNFFAAIMNQIYDVDIDRINKPDLPLVSGEMSIETAWILSIIVALTGLIVTIKLKSAPLFVFIYIFGIFAGFAYSVPPIRWKQYPFTNFLITISSHVGLAFTSYSATTSALGLPFVWRPAFSFIIAFMTVMGMTIAFAKDISDIEGDAKYGVSTVATKLGARNMTFVVSGVLLLNYLVSISIGIIWPQVFKSNIMILSHAILAFCLIFQTRELALANYASAPSRQFFEFIWLLYYAEYFVYVFI
SEQIDNo:8:
MKCSTFSFWFVCKIIFFFFSFNIQTSIANPRENFLKCFSQYIPNNATNLKLVYTQNNPLYMSVLNSTIHNLRFTSDTTPKPLVIVTPSHVSHIQGTILCSKKVGLQIRTRSGGHDSEGMSYISQVPFVIVDLRNMRSIKIDVHSQTAWVEAGATLGEVYYWVNEKNENLSLAAGYCPTVCAGGHFGGGGYGPLMRNYGLAADNIIDAHLVNVHGKVLDRKSMGEDLFWALRGGGAESFGIIVAWKIRLVAVPKSTMFSVKKIMEIHELVKLVNKWQNIAYKYDKDLLLMTHFITRNITDNQGKNKTAIHTYFSSVFLGGVDSLVDLMNKSFPELGIKKTDCRQLSWIDTIIFYSGVVNYDTDNFNKEILLDRSAGQNGAFKIKLDYVKKPIPESVFVQILEKLYEEDIGAGMYALYPYGGIMDEISESAIPFPHRAGILYELWYICSWEKQEDNEKHLNWIRNIYNFMTPYVSKNPRLAYLNYRDLDIGINDPKNPNNYTQARIWGEKYFGKNFDRLVKVKTLVDPNNFFRNEQSIPPLPRHRH
SEQIDNo:9:
TGAGACTTTTCAACAAAGGGTAATATCCGGAAACCTCCTCGGATTCCATTGCCCAGCTATCTGTCACTTTATTGTGAAGATAGTGGAAAAGGAAGGTGGCTCCTACAAATGCCATCATTGCGATAAAGGAAAGGCCATCGTTGAAGATGCCTCTGCCGACAGTGGTCCCAAAGATGGACCCCCACCCACGAGGAGCATCGTGGAAAAAGAAGACGTTCCAACCACGTCTTCAAAGCAAGTGGATTGATGTGATATCTCCACTGACGTAAGGGATGACGCACAATCCCACTATCCTTCGCAAGACCCTTCCTCTATATAAGGAAGTTCATTTTCATTTGGAGAGAACA
SEQIDNo:10:
GATCGTTCAAACATTTGGCAATAAAGTTTCTTAAGATTGAATCCTGTTGCCGGTCTTGCGATGATTATCATATAATTTCTGTTGAATTACGTTAAGCATGTAATAATTAACATGTAATGCATGACGTTATTTATGAGATGGGTTTTTATGATTAGAGTCCCGCAATTATACATTTAATACGCGATAGAAAACAAAATATAGCGCGCAAACTAGGATAAATTATCGCGCGCGGTGTCATCTATGTTACTAGATC
实施例2:重组载体转化甘蓝型油菜(Brassicanapus)
(1)播种:
选取甘蓝型油菜ZS11种子(本申请人实验室保存,为公知公用材料),放在10mL离心管中,加入体积分数为75%的酒精,上下翻转,浸泡1min,用移液器吸取酒精,加入适量无菌水冲洗3?5遍;再加入15%bleach溶液(配制为8.115mL无菌水+1.875mL次氯酸钠+10μL曲拉通),将离心管上下翻转,浸泡种子6min,污染较重的种子酒精消毒和灭菌的时间可以适当延长,但时间过长会影响种子发芽。随后吸掉消毒液,加入适量无菌水冲洗3?5遍,每次均上下翻转,保持离心管内为无菌环境。最后吸掉无菌水,用烧好的无菌镊子将灭菌种子播到M0培养基上,每瓶25粒左右,置于暗光24℃下培养6天,即可获得所需长度的油菜下胚轴。
(2)菌液准备:
播种5?7天后用LB液体培养基分别培养实施例1中得到的分别含有pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS、pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS质粒的农杆菌,具体培养方式如下:在5mL抗性LB液体培养基(加入50mg/L卡那霉素Kan+50mg/L庆大霉素Gen+50mg/L利福平Rif)中分别加入20μL含有pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS、pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS质粒的农杆菌,于28℃、180?220rpm摇床中培养约14?16h。
(3)侵染及共培养:
准备好共培养培养基M1和DM培养基,M1培养基经过121℃15min灭菌后快冷却时(约50℃)加入乙酰丁香酮AS(终浓度100μM),DM培养基也加入AS(终浓度100μM),记为DM(AS+),备用。
采用分光光度计测步骤(2)中所述的LB培养基中菌的OD值,选取OD值为0.4左右时的菌液较好,一般摇菌14?16小时即可。吸取2mL培养好的菌液到无菌离心管中,3000rpm3min离心,弃上清;然后加入2mLDM(AS+)培养基悬浮,3000rpm3min离心,弃上清;再加入2mL的DM(AS+)培养基悬浮,放4℃冰箱备用。
用无菌解剖剪刀剪取步骤(1)播种后生长出来的油菜下胚轴,切成0.8cm?1.0cm的小段,放在含有18mL的DM培养基液体的培养皿中,等下胚轴全部切成小段后,再倒入2mL上述用DM(AS+)培养基重悬后的菌液,这时皿里液体体积为20mL,浸染10?15min(时间不能长,不然外植体易死亡),隔段时间摇晃1次,4~5次即可。当侵染8min时开始用移液器吸掉DM(AS+)培养基菌液,用无菌镊子夹取外植体到无菌滤纸上放置片刻,吸走外植体上多余的菌液,然后将外植体再转到M1固体培养基中,外植体暗光下24℃放置或放在光照培养室避光处。
(4)选择培养及愈伤诱导:
将在M1培养基中培养36?48h的外植体转入到M2培养基中,光下正常培养,培养条件为24℃条件下,采用白天16h、晚上8h的方式交替培养,2?3周诱导愈伤。
(5)再分化:
将步骤(4)中的外植体转到M3培养基中,每2?3星期继代一次,直至出现绿芽。
(6)生根培养
将有完整生长点的绿芽转入M4培养基中长大生根,约需要20天。生根后,可以直接放置培养间进行炼苗,待苗状态稳定后,从培养基中取出,取苗过程中不要破坏植物的根系,然后将苗移到土壤中培养,培养时需要用保鲜膜保湿1?2周,即可获得等待鉴定的转基因油菜,本实施例中得到转化pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS的转基因油菜植株和转化pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS的转基因油菜植株。
实施例3:转基因甘蓝型油菜的鉴定及4个基因共过表达的构建
待实施例2中的转基因油菜植株生长稳定后,采取CTAB法提取转基因油菜叶片中的DNA,具体步骤如下:
A.取少量叶片放入1.5mL离心管中,使用液氮进行研磨,研磨成干粉后,加入600μLCTAB,然后将样品放入65℃水浴锅中孵育60min。
B.等待孵育完成后,在管中加入600μL氯仿/异戊醇(体积比为24:1)溶液,剧烈震荡,充分除去蛋白质,然后放入离心机中12000g离心10min。
C.离心后轻轻取出离心管,此时溶液分为三层,依次是水相、叶片碎片杂质层、有机相,吸取400?500μL上清水相,转移到新的离心管中,然后向上清中加入400?500μL异丙醇,轻轻颠倒混匀,接着将样品放入?20℃冰箱中冷却至少10min,以使异丙醇更加有效沉淀DNA。
D.将离心管放入离心机中,室温下12000g离心10min。
E.离心后弃上清,加入700μL预冷的体积分数为70%乙醇洗涤,弹起沉淀,轻轻颠倒洗涤,12000g瞬旋。
F.离心后弃上清,用移液器吸去乙醇溶液,然后在超净台风干沉淀,去除挥发性有机溶液。
G.向离心管中加入50?100μLddH2O溶解沉淀,放入37℃水浴锅中30min,得到基因组样品。
H.取1μL基因组样品测定浓度,检测合格后,将基因组样品放入?20℃冰箱中备用。
将上述步骤中得到的基因组样品为模板,过表达载体Ⅰ:pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS和过表达载体Ⅱ:pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS质粒为正对照,进行PCR鉴定。PCR扩增反应程序以及条件与表2中的菌液PCR反应相同。
待PCR完成后,将扩增产物在1%的琼脂糖凝胶中进行电泳,使用紫外凝胶成像仪照相,记录结果。图2为经过转化得到的14株阳性株中提取叶片基因组的PCR鉴定胶图;图中,+1:正对照,pCAMBIA1300?NOS?OAC?35S?35S?TKS?NOS质粒;2?8:过表达载体Ⅰ转基因植株;+9:正对照,pCAMBIA1300?NOS?PT4?35S?35S?CBDAS?NOS质粒;10?16:过表达载体Ⅱ转基因植株;M:TakaraDL2000DNAMarker。从图2中可以看出,本实施例中获得了7株过表达载体Ⅰ转基因植株和6株过表达载体Ⅱ转基因植株,都是阳性植株。
图2中可以证实实施例2中所构建的基因过表达载体成功转入到油菜中,确定通过植物组织培养的过程,获得了鉴定成功的阳性株。
为了进一步获得4个基因共过表达的植株。将转基因鉴定正确的两种过表达转基因植株采取人工去雄的方法,进行杂交。取8株杂交F1代的叶片提取DNA并进行PCR检测。PCR扩增反应程序以及条件与表2中的菌液PCR反应相同。图3为杂交F1代植株中提取叶片基因组的PCR鉴定胶图;图中,WT:中双11(ZS11);1?8为杂交后代植株(F1代植株)。由于SEQIDNo:1所示的基因TKS的序列长度是1158bp,而SEQIDNo:3所示的基因PT4的序列长度是1197bp,两者序列长度差异只有39bp,因而在1%的琼脂糖胶是区分不开这两个基因的,所以四个基因聚合的植株能通过1%的琼脂糖胶显示出3个条带。从图3中可见,本实施例得到3株四个基因聚合的植株,分别是记为M2,M5和M7。
实施例4:HPLC?UV测定CBD含量检测
为了测定四个基因聚合的植株中的CBD含量,分别准确称取0.1g磨碎后的叶片样品(M2和M5),平行6份,加入10mL95%甲醇,充分混匀后在4℃放置2小时,超声提取30min,12000r/min离心5min取上清,过0.22μm的微孔滤膜,用95%甲醇稀释200倍用于上样。
HPLC?UV法:色谱柱C18柱(3.9mm×300mm,10μm,柱温35℃);流动相甲醇?0.1%甲酸水溶液(80:20);检测波长210nm;流速1mL/min;进样量20μL。
从图4中可以看出,CBD标样在8.281分钟达到峰值,M2植株提取样在8.262分钟达到峰值,而M5植株提取样在8.223分钟达到峰值,这两株植株叶片中的CBD含量分别达到760.66μg/g和448.93μg/g,同时对野生型中双11的叶片中DNA做了平行实验,发现其峰高不明显,CBD含量甚微。
这个结果表明本发明成功通过在油菜生物合成了CBD,并获得了较高的表达量。
摘自国家发明专利,发明人:朱克明,赵文达,宋悦,谭小力,申请号:202311501633.6,申请日:2023.11.13