摘 要:工业大麻(Cannabis sativa)是一种重要经济作物,其种子萌发阶段易遭受干旱胁迫,最终对生长和产量造成不利影响。NAC基因是植物中特有的一类转录因子,在植物应对非生物胁迫方面起着重要作用。本研究基于前期的转录组数据,利用RT-PCR方法,从工业大麻品种'云麻1号'中分离克隆出了1个NAC类基因,命名为CsNAC62(GenBank No. XM_030652694)。序列分析发现,CsNAC62基因CDS大小为1260bp,编码419个氨基酸,蛋白质分子量48.32kD,等电点为8.24。CsNAC62蛋白的N端含有150~160个氨基酸组成的NAC结构域,该结构域由5个亚结构域组成,是NAM/NAC类基因家族典型的保守结构域。蛋白二级结构预测表明,CsNAC62由25.19%的α-螺旋、17.29%的延伸链和57.52%的不规则卷曲组成。系统进化分析表明,工业大麻CsNAC62与桃树(Prunus persica) NAC3的关系最近。'云麻1号'萌发种子中的CsNAC62基因随着干旱胁迫处理(PEG-6000模拟)时间的延长,其表达量也逐步增加,萌发7 d时表达量达到最大。而在正常萌发的种子(对照)中,CsNAC62的表达量则上升缓慢,表明CsNAC62基因受干旱诱导表达。本研究初步揭示了CsNAC62基因在PEG模拟干旱胁迫下的表达模式,为进一步探究其参与工业大麻干旱胁迫响应的分子机制提供参考。
关键词:工业大麻;NAC转录因子;干旱胁迫;生物信息学分析;表达模式
大麻(Cannabis sativa)隶属于大麻科(Cannaba‐ceae)大麻属(熊和平,2008),工业大麻指的是四氢大麻酚(tetrahydrocannabinol,THC)含量低于0.3%的大麻品种类型(卢延旭等,2007)。工业大麻有着相当高的经济价值,具有镇痛、抗癫痫等药用价值(Boehnke et al.,2021),是纺织、绳索制品等的原材料(赵越等,2021),还可开发无毒涂料、化妆品等(卢延旭等,2007),其种子还可用于食品加工业(Zhao et al.,2022)。工业大麻在生长过程中(尤其是种子萌发阶段)常受到干旱的胁迫,引起形态、生理生化和基因表达等变化,这些变化会对植株的生长和发育造成不利影响(石汝杰,胡廷章,2009)。培育具有抗性的大麻种质是解决干旱胁迫的有效办法,而挖掘工业大麻干旱胁迫的抗性基因可以为抗性品种的选育提供参考。
转录因子在植物响应非生物胁迫过程中发挥重要作用,其作用原理主要是结合顺式调控元件,对靶基因的表达进行激活(或抑制),进一步对不同的信号通路进行调控。植物转录因子家族成员众多,可以根据靶基因启动子中DNA结合结构域的不同分为58个家族(靳进朴等,2015),其中NAC是植物所特有且最大的转录因子家族之一。目前,在拟南芥(Arabidopsis thaliana)、欧洲油菜(Brassica napus)、白菜(Brassica rapa)、本氏烟草(Nicotiana benthamiana)、萝卜(Raphanus sativus)、毛果杨(Populus trichocarpa)、大豆(Glycine max)等植物中均有多个NAC基因被鉴定(马雪祺等,2021)。NAC转录因子在植物应对干旱胁迫中具有重要作用,Li等(2022b)对Dc NAC基因进行共表达网络分析发现,Dc NAC6、Dc NAC18、Dc NAC29、Dc NAC44、Dc NAC51(主要在根中)和Dc NAC16、Dc NAC64 (主要在叶中)是铁皮石斛(Dendrobium officinale)抗旱候选基因。同时研究表明,NAC基因也是植物生长和调节胁迫信号的控制开关,为作物适应复杂的胁迫环境提供帮助(Saidi et al.,2022)。此外,工业大麻Cs NAC1和Cs NAC3的过量表达,还能显著提高烟草(Nicotiana tabacum)植株的耐盐性(胡华冉,2019)。综上,深入研究NACs转录因子,对揭示植物响应非生物胁迫的分子机制具有着重要的理论价值。
本研究以工业大麻品种'云麻1号'为研究对象,在前期干旱胁迫处理的转录组测序基础上,克隆出差异表达基因Cs NAC62,运用相关软件对其进行生物信息学分析,并通过q RT-PCR技术研究其响应干旱胁迫的表达模式,以上研究结果将为后续Cs NAC62基因在工业大麻抗旱中的功能鉴定提供参考。
1 材料与方法
1.1 实验材料
本研究所用工业大麻(Cannabis sativa)'云麻1号'种子由云南省农业科学院经济作物研究所提供。
1.2 处理方法
挑选大小、外形一致的种子,使用70%酒精消毒,蒸馏水冲洗干净并晾干备用。随机挑选30粒种子,均匀摆放于9cm培养皿内,正常萌发处理加入蒸馏水9mL,干旱胁迫处理加入20%聚乙二醇6000(PEG 6000)溶液9mL。置于培养箱中培养,培养条件:暗培养3d后;于光照12h,温度25℃,黑暗12h,温度20℃条件下继续培养4d。在培养1、3、4、7d时取萌发种子或幼苗,每组每个时间段不同处理设置3个生物学重复。取样后放至液氮中速冻,于-80℃超低温冰箱保存备用。
1.3 基因克隆
提取'云麻1号'不同处理以及不同萌发时间(1,3,4和7d)的RNA进行反转录得到cDNA。RNA提取和反转录分别使用Hi Pure Plant RNA Mini Kit(广州美基生物科技有限公司)和Mon Script™RTIII Super Mix with ds DNase (Two-Step)试剂盒(莫纳(云南)生物科技有限公司,昆明)进行。基于本课题组前期转录组测序的结果,使用Primer Pre‐mier 5.0软件设计NAC62基因的引物。以上述cDNA为模板,利用康为世纪(泰州) 2×Es Taq Master‐Mix (Dye)进行目的基因ORF的扩增。其中,引物合成委托昆明擎科生物科技有限公司进行(表1)。
RT-PCR扩增反应体系共25μL:2×Es Taq Mas‐ter Mix (Dye) 12.5μL、10μmol/L的正反向引物各1μL、cDNA 1μL和dd H2O9.5μL。PCR反应程序:预变性94℃ 2min;变性94℃ 30s,退火58℃ 1min,延伸72℃ 30s,共35个循环;延伸72℃ 2min。PCR产物经1.5%琼脂糖凝胶电泳检测后,将其送至昆明擎科生物科技有限公司进行测序分析。测序结果通过Snap Gene软件与前期转录组测序结果进行比对分析。
1.4 生物信息学分析
首先,利用ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)预测开放阅读框,利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对,使用Prot Param (https://web.expasy.org/prot‐param/)进行蛋白质理化性质分析,使用Inter Pro(https://www.ebi.ac.uk/interpro/)进行蛋白质结构域分析,使用SOPMA (https://npsa.lyon.inserm.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL (https://swissmodel.expasy.org/interactive)分别对其蛋白质二、三级结构进行预测和分析。然后,通过DNAMAN 6.0软件对NAC62的同源氨基酸序列进行比对,利用MEGA 11.0构建其系统进化树。
1.5 基因表达分析
q PCR检测利用Applied Biosystems Quant Stu‐dio 7 Flex实时荧光定量PCR仪进行。内参基因为真核起始因子4E (eukaryotic initiation factor 4E,e IF4E),反应体系共20μL:2×Mon AmpTMSYBR Green q PCR Mix 10μL、20μmol/L的正、反向引物各0.4μL、c DNA模板1μL、Nuclease-Free Water8.2μL。q PCR反应程序:预变性95℃30 s;变性95℃10 s,退火60℃30 s,共40个循环。设置3个生物学重复。反应所用引物(表1)由Primer Premier5.0软件设计,由昆明擎科生物科技有限公司合成。
1.6 统计分析
Cs NAC62基因的相对表达量采用2-ΔΔCt法计算。数据的统计分析和作图分别通过Excel 2021和Graph Pad Prim 9软件进行。
2 结果与分析
2.1 目的基因的克隆
提取的工业大麻总RNA经琼脂糖电泳检测出现3条带,结果显示,28S、18S条带较亮,5S条带最弱(图1A)。通过Nano Drop 2000c仪器检测发现,本次RNA样品的OD值(A260/A280吸光度比值)均在1.8至2.1之间。
经PCR扩增和凝胶电泳检测观察,获得的片段符合目的基因的预期大小(图1B)。胶回收后送昆明擎科生物科技有限公司测序。测序结果经Snap‐Gene软件比对后,认为与目的基因的ORF序列一致。经前期分析认为该基因属于植物NAC类转录因子家族成员,根据其在染色体上的位置命名为Cs NAC62 (Gen Bank No.XM_030652694)。
表1 本研究中的引物序列及用途基因
2.2 ORF序列分析
通过BLAST和ORFfinder对Cs NAC62基因序列进行分析,结果表明,该基因序列全长1643bp,具有完整的ORF框,CDS为1260bp,编码419个氨基酸。采用NCBI在线软件对该基因的保守序列进行分析,结果表明Cs NAC62具有NAC蛋白(图2)。
2.3 生物信息学分析
运用Protparam在线软件对Cs NAC62基因编码蛋白的氨基酸序列进行分析,结果表明,Cs NAC62基因编码蛋白的分子式为C2120H3254N602O661S18,理论分子量为48.32 k D;有41个带正电荷残基(Arg+Lys),38个带负电荷残基(Asp+Glu),理论等电点8.24;不稳定指数大于40(Ⅱ=61.08),亲水性平均值等于-0.878。
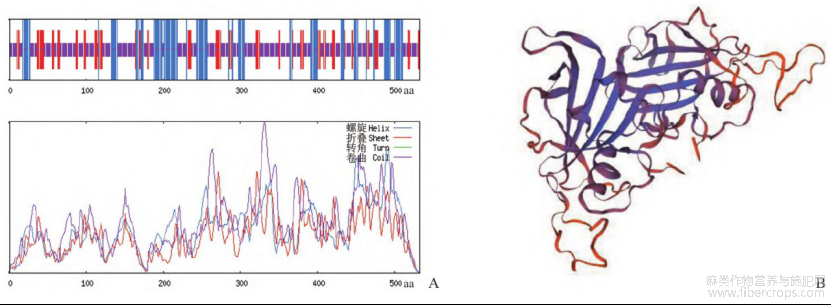
运用SOPMA在线网站对Cs NAC62基因编码蛋白的二级结构进行预测(图3A),该蛋白由α-螺旋、延伸链和不规则卷曲组成,分别占比25.19%、17.29%和57.52%。Cs NAC62编码蛋白的三级结构通过SWISS-MODEL在线网站采用同源建模法进行预测(图3B),结果显示全局模型质量估计(global model quality estimation,GMQE)值为0.26。
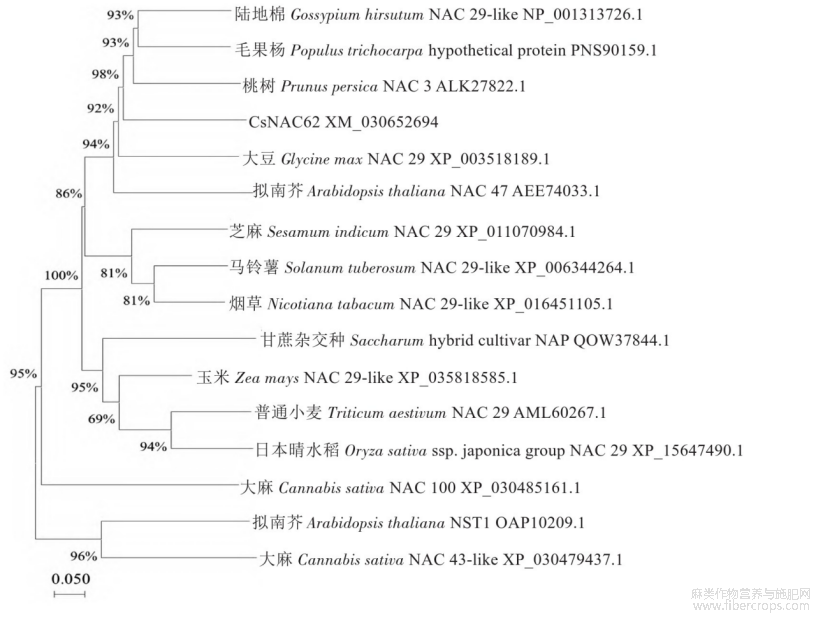
经过Inter Pro网站分析发现,工业大麻Cs‐NAC62蛋白N端含有150~160个氨基酸残基组成的NAC结构域,该结构域是NAM/NAC类基因家族典型的保守区域(图4)。利用DNAMAN 6.0软件对工业大麻Cs NAC62以及其他10种植物的NAC基因编码的蛋白质进行多序列比对分析,该保守结构域含有A、B、C、D和E五个子结构域(图4)。运用MEGA 11.0软件对工业大麻Cs NAC62和桃树(Prunus persica)、普通小麦(Triticum aestivum)、陆地棉(Gossypium hirsutum)、毛果杨(Populus trichocarpa)、大豆(Glycine max)、马铃薯(Solanum tuberosum)、芝麻(Sesamum indicum)、'日本晴'水稻(Oryza sativa ssp.japonica Group)、烟草(Nicotiana tabacum)、玉米(Zea mays)、拟南芥(Arabidopsis thaliana)、大麻(Cannabis sativa)的NAC蛋白序列以及甘蔗杂交种(Saccharum hybrid cultivar)、拟南芥NAC亚类蛋白序列构建了系统发育进化树(图5),发现Cs NAC62蛋白与桃树NAC3蛋白关系最近。
图1 工业大麻总RNA (A)和目的基因PCR扩增(B)的凝胶电泳
A.1~8:RNA样品。B.1:Cs NAC62;M:DL2000 DNA Marker
图2 工业大麻Cs NAC62基因保守序列分析
图3 工业大麻Cs NAC62蛋白二级结构(A)和三级结构(B)预测
2.4 基因表达模式分析
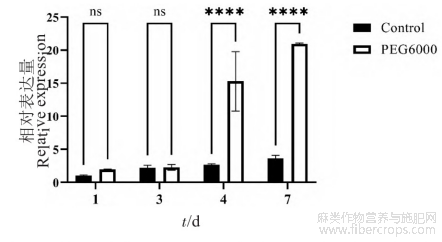
利用q RT-PCR技术分析Cs NAC62基因在正常条件和PEG-6000处理后工业大麻种子萌发中的表达模式。结果(图6)表明,在PEG-6000模拟干旱胁迫处理的种子中,Cs NAC62基因的相对表达量随着PEG处理时间的延长而逐渐增加,4d时其相对表达量迅速升高,7d时达到最高。在对照组(正常萌发)中,Cs NAC62的表达量增加缓慢,且在第4~7天时,处理组基因的相对表达量为对照组数倍。表明Cs NAC62基因在工业大麻种子萌发中受干旱胁迫诱导表达。
![]()
图4 工业大麻Cs NAC62与其他物种同源蛋白氨基酸序列比对
A~E:蛋白质亚结构域
3 讨论
植物NAC类转录因子基因家族是植物特有的基因家族之一,其中N端结构域相对保守,由A、B、C、D、E五个亚结构域组成,与核定位及DNA序列的识别和结合相关,C端结构域序列多变,具有转录激活或转录抑制作用,C端也决定了NAC蛋白功能的多样化。本研究通过软件分析发现,CsNAC62基因所编码的蛋白质在N末端含有植物NAC类转录因子的典型结构特征,进化分析表明Cs NAC62属于NAM亚家族(Aida et al.,1997)。
NAC类转录因子在植物响应非生物胁迫等方面发挥着关键的调控作用(Wang et al.,2009)。豇豆(Vigna unguiculata) NAC1/NAC2转录因子通过
图6 干旱胁迫下Cs NAC62基因在工业大麻萌发种子中的表达量分析
内参基因:e IF4E;n=3;对照组:正常萌发;PEG-6000:干旱胁迫;ns:无显著差异;****:差异极其显著(P<0.0001)
图5 工业大麻Cs NAC62与其他物种的NAC系统进化树
光合和抗氧化机制的共同激活提高转基因豇豆的生长和耐旱耐热性(Srivastava et al.,2022);与野生型植株相比,大豆(Glycine max)的Gm NAC12基因在干旱胁迫下表达量显著上调10倍以上,存活率提高了57%以上(Yang et al.,2022);Zm NACP、Zm‐NAC19、Zm NAC4、Zm JUB1和Zm NAC87是玉米(Zea mays) 5个响应干旱胁迫的NAC家族成员,这5个NAC成员的过表达显著提高了植株的干旱胁迫耐受性(Ding et al.,2023);Rc NAC091降低了月季(Rosa chinensis)的脱水耐性,其对脱水应激反应具有正向调节作用(Geng et al.,2022);珍珠谷子(Pennisetum glaucum)基因组含有151个NAC转录因子基因,可分为11类,在这些基因中有的被干旱胁迫所上调,有的下调,因此Pg NACs的表达有助于珍珠谷子建立耐逆性(Dudhate et al.,2021);ONAC066是水稻(Oryza sativa)干旱应激耐受性的正调控因子,在转基因水稻中过表达ONAC066提高了干旱胁迫耐受性,增加了ABA敏感性,同时降低了干旱胁迫下的失水率,增加了脯氨酸和可溶性糖含量,减少了活性氧(ROS)的积累,上调了胁迫相关基因的表达(Yuan et al.,2019);Nt NAC053基因编码一个新的NAC转录因子,可以通过激发烟草下游的逆境响应基因和抗氧化系统来赋予烟草对干旱胁迫的耐受性(Li et al.,2022a)。本研究结果表明,工业大麻CsNAC62基因在PEG-6000处理中显著上调表达,且随着处理时间的增长,其相对表达量也在逐步增加,在第4~7d时,处理组基因的相对表达量为对照组数倍,推测Cs NAC62基因受干旱胁迫诱导表达。虽然,大麻的基因组测序已经完成(Cai et al,2021),但是,Cs NAC62转录因子是通过何种信号途径从而调控工业大麻响应干旱胁迫的,仍需要深入研究。
4 结论
本研究克隆得到工业大麻Cs NAC62基因,其CDS区的全长为1 260 bp,共编码419个氨基酸;通过同源基因比对发现,Cs NAC62蛋白同桃树NAC3蛋白关系最近。在工业大麻种子萌发过程中,随着干旱处理时间的延长,Cs NAC62表达量也逐步增加,7 d时达到最大;对照组中,其表达量上升缓慢,推测工业大麻Cs NAC62基因与干旱胁迫密切相关。本研究对于研究工业大麻Cs NAC62基因参与干旱胁迫应答提供了数据。
参考文献
[1] 胡华冉.2019.工业大麻耐盐候选基因GDH2和NACs的克隆及功能分析[D].博士学位论文,云南大学,导师:刘飞虎,pp.110-111.(Hu H R,2019.Cloning and functional analysis of potential salt-tolerant genes of GDH2and NACs in industrial hemp(Cannabis sativa L.)[D].Thesis for Ph.D.,Yunnan University,Suppervisor:Liu FH,pp.110-111.)
[2] 靳进朴,郭安源,何坤,等.2015.植物转录因子分类?预测和数据库构建[J].生物技术通报,31(11):68-77.(Jin J P,Guo A Y,He K,et al.2015.Classification,prediction and database construction of plant transcription factors[J].Biotechnology Bulletin,31(11):68-77.)
[3] 卢延旭,董鹏,崔晓光,等.2007.工业大麻与毒品大麻的区别及其可利用价值[J].中国药理学通报,23(8):1112-1114.(Lu Y X,Dong P,Cui X G,et al.2007.An approach for the analysis of pharmacodynamic interactions and the simulation of combined response[J].Chinese Pharmacological Bulletin,23(8):1112-1114.)
[4] 马雪祺,阴艳红,冯婧娴,等.2021.植物NAC转录因子研究进展[J].植物生理学报,57(12):2225-2234.(Ma X Q,Yin Y H,Feng J X,et al.2021.Research progress of NAC transcription factors in plant[J].Plant Physiology Journal,57(12):2225-2234.)
[5] 石汝杰,胡廷章.2009.渗透胁迫对4个玉米品种种子萌发及幼苗生长的影响[J].种子,28(7):85-87.(Shi R J,Hu T Z.2009.Effects of permeating stress on seeds germination and seedlings growth of four maize varieties[J].Seed,28(7):85-87.)
[6] 熊和平.2008.麻类作物育种学[M].中国农业科学技术出版社,北京.pp.208-296.(Xiong H P.2008.Hemp Crop Breeding[M].China Agricultural Science and Technology Press,Beijing.pp.208-296.)
[7] 赵越,王晓楠,孙宇峰,等.2021.工业大麻纤维产量?品质影响因素及纤维发育相关基因研究进展[J].中国麻业科学,43(3):155-160.(Zhao Y,Wang X N,Sun Y F,et al.2021.Factors influencing yield and quality of hemp fiber and genes potentially related to fiber development[J].Plant Fiber Sciences in China,43(3):155-160.)
[8] Aida M,Ishida T,Fukaki H,et al.1997.Genes involved in organ separation in Arabidopsis:An analysis of the cupshaped cotyledon mutant[J].The Plant Cell,9(6):841-857.
[9] Boehnke K F,Gagnier J J,Matallana L,et al.2021.Substituting cannabidiol for opioids and pain medications among individuals with fibromyalgia:A large online survey[J].The Journal of Pain,22(11):1418-1428.
[10] Cai S,Zhang Z,Huang S,et al.2021.CannabisGDB:A comprehensive genomic database for Cannabis sativa L.[J].Plant Biotechnology Journal,19(5):857-859.
[11] Ding N,Zhao Y,Wang W,et al.2023.Transcriptome analysis in contrasting maize inbred lines and functional analysis of five maize NAC genes under drought stress treatment[J].Frontiers in Plant Science,13:1097719.
[12] Dudhate A,Shinde H,Yu P,et al.2021.Comprehensive analysis of NAC transcription factor family uncovers drought and salinity stress response in pearl millet(Pennisetum glaucum)[J].BMC Genomics,22(1):70.
[13] Geng L,Su L,Fu L,et al.2022.Genome-wide analysis of the rose(Rosa chinensis) NAC family and characterization of RcNAC091[J].Plant Molecular Biology,108(6):1-15.
[14] Li X,Wang Q,Guo C,et al.2022a.NtNAC053,a novel NACtranscription factor,confers drought and salt tolerances in tobacco[J].Frontiers in Plant Science,13:817106.
[15] Li Y,Zhang T,Xing W,et al.2022b.Comprehensive genomic characterization of the NAC transcription factors and their response to drought stress in Dendrobium catenatum[J].Agronomy,12(11):2753.
[16] Saidi M N,Mergby D,Souibgui A,et al.2022.Overexpression of durum wheat NAC transcription factor TtNTL3A promotes early flowering and increases multiple stress tolerance in transgenic Arabidopsis[J].Plant Physiology and Biochemistry,192:1-9.
[17] Srivastava R,Kobayashi Y,Koyama H,et al.2022.Cowpea NAC1/NAC2 transcription factors improve growth and tolerance to drought and heat in transgenic cowpea through combined activation of photosynthetic and antioxidant mechanisms[J].Journal of Integrative Plant Biology,60(1):25-44.
[18] Wang X,Basnayake B M,Zhang H,et al.2009.The Arabidopsis ATAF1,a NAC transcription factor,is a negative regulator of defense responses against necrotrophic fungal and bacterial pathogens[J].Molecular Plant-Microbe Interactions,22(10):1227-1238.
[19] Yang C,Huang Y,Lv P,et al.2022.NAC transcription factor GmNAC12 improved drought stress tolerance in soybean[J].International Journal of Molecular Sciences,23(19):12029.
[20] Yuan X,Wang H,Cai J,et al.2019.Rice NAC transcription factor ONAC066 functions as a positive regulator of drought and oxidative stress response[J].BMC Plant Biology,19(1):278.
[21] Zhao X L,Wei X Y,Guo Y,et al.2022.Industrial hemp-an old but versatile bast fiber crop[J].Journal of Natural Fibers,19(13):6269-6282.
文章摘自:杨宇蕾,张涵雪,王珊珊等. 转录因子NAC62在工业大麻中的克隆、生信分析及其干旱胁迫响应分析 [J]. 农业生物技术学报, 2024, 32 (01): 107-114.