摘 要:本文研究一种超声波辅助提取火麻叶中大麻二酚(cannabidiol,CBD)的方法,同时分析火麻不同部位的CBD含量。首先建立CBD的HPLC检测方法,采用单因素实验确定超声提取功率、提取温度、提取时间、料液比4个因素对火麻叶中CBD提取率的影响;利用Design-expert软件进行Box-Benhnken实验设计确定并验证CBD的超声辅助提取的最优工艺条件,并检测火麻不同部位CBD含量。实验表明:采用AgilentHC-C18柱(250mm×4.6mm,5µm),检测波长:220nm,流速:1.0mL/min,柱温:28℃,流动相:甲醇-水=90∶10,等度洗脱,在此条件下的分离效果和峰型较好,并且结果准确可靠,稳定性好。以甲醇为提取溶剂,最佳提取工艺条件为:提取功率320W,提取温度81℃,提取时间26min,料液比1:22g/mL,在此条件下得到CBD含量的平均值为79.53±0.26mg/g。火麻嫩叶中CBD含量最高,其余依次为老叶、种子和茎,根中含量最低。结果表明,超声波提取是一种高效的大麻二酚提取方法,且作为一种天然产物资源,大麻二酚具有重要的开发利用价值。
关键词:大麻二酚;火麻叶;超声辅助提取;高效液相色谱;响应面
火麻(Cannabis sativa L.)又名汉麻、线麻等,是桑科(Moraceae)大麻属(Cannabis)一年生草本植物。火麻中的主要活性成分是大麻素,目前从大麻属植物中分离得到的天然大麻素有110余种,其中四氢大麻酚(tetrahydrocannabinol,THC)、大麻二酚(cannabidiol,CBD)(结构见图1)是大麻中2种主要的大麻素活性成分[1]。研究表明CBD具有抗氧化活性[2]、镇静[3]、抗抑郁[4]、抗癌[5]、治疗肥胖[6]、抗炎特性[7]以及舒张血管等潜在作用[8],并且无致幻及成瘾的作用,已是临床治疗乳腺癌、癫痫的新型药物[9]。目前,在全球很多国家和地区,大麻二酚已经陆续被批准作为药用以及食品中使用[10,11]。
天然的CBD是左旋结构,而化学合成的CBD则通常是左旋和右旋结构两种异构体的1∶1混合物,由于二者的性质非常接近,分离十分困难。化学合成步骤繁琐,不能有效生产特定结构的生物活性化合物,且成本较高[12],所以从天然植物中提取仍是获得大麻二酚的最经济来源。
目前,从火麻中提取大麻二酚主要还是以浸提和热回流为主[13],对于CBD的检测方 法仍存在耗时长,效率低等问题;而且提取效率低,稳定性差,含量低等难题也亟待攻克。本文选用超声辅助提取方法的重复性较好,此方法较索氏提取的方法更加简单,便于操作。随着火麻种植合法化规模的不断扩大,对CBD的研究也不断深入,人们对CBD有效性和安全性的理解大大增加,CBD也将会更好地造福人类。
图1四氢大麻酚和大麻二酚分子结构图
本文以火麻叶为研究对象,建立了简单、快速、准确的HPLC检测方法,此方法大麻二酚出峰时间快,效果好,流动相配比简单;利用超声辅助提取方法获得天然大麻二酚,探讨不同因素对提取含量的影响,运用响应面法优化超声辅助提取CBD的条件,从而提高了大麻二酚的得率,具有很高的应用价值。并研究了大庆火麻各部位中CBD的含量,为火麻提取CBD和大麻的综合利用提供理论依据,促进火麻产业的发展。
1材料和方法
1.1材料
实验用火麻干燥叶子,2020年10月,采自东北林业大学种植基地,经植物分类学郑宝江副教授鉴定为火麻。该火麻THC含量<0.3%,符合国家使用规定。将采集的火麻叶在60℃下烘干、粉碎,过40目筛后存放于东北林业大学森林植物生态学教育部重点实验室。
1.2方法
1.2.1HPLC检测方法建立
1.2.1.1标准溶液母液的配制
精密称取的CBD标品8.0μg,甲醇为溶剂,配制成标准溶液母液浓度80μg/mL。
1.2.1.2高效液相色谱条件
色谱柱:AgilentHC-C18柱(250mm×4.6mm,5μm);检测波长:220nm;流速:1.0mL/min;柱温:28℃;流动相:甲醇-水(90∶10);进样量:10μL;洗脱方式:等度洗脱。
1.2.1.3标准曲线的绘制
取母液配制成浓度为0.8、1.6、4.0、8.0、40.0μg/mL的标准品溶液,经0.45μm微孔滤膜过滤,按“1.3.1.2”条件,进行HPLC检测,以峰面积Y为纵坐标,CBD浓度C为横坐标绘制标准曲线,呈线性关系。标准曲线的回归方程为Y=51.969C+19.396,相关系数R2=0.9996,R2接近于1,表明该标准曲线在CBD浓度在10~80μg/mL浓度范围内的线性关系良好。
1.2.2方法学考察
1.2.2.1精密度试验
分别精密吸取上述标准溶液母液0.2、0.5、1.0mL,依次用甲醇定容成10mL,配制成浓度分别为1.6、4.0和8.0μg/mL三个浓度的大麻二酚标准溶液,分别重复测定其峰面积值5次,记录大麻二酚的峰面积。
1.2.2.2稳定性试验
按照上述“1.3.2.1”中方法制备溶液,分别在0、2、4、8、10、12、24h,进样10μL测定,记录大麻二酚的峰面积,计算得到大麻二酚峰面积的RSD。
1.2.2.3重复试验
取10份火麻叶各1.0g,按照两种不同的提取条件,分别平行操作制备5组样品,第一组在超声提取功率320W,提取温度30℃,料液比1∶15(g/mL)的条件下提取25min得到第一份提取液;第二组在超声提取功率320W,提取温度30℃,料液比1∶20的条件下提取30min得到第二份提取液。分别进样10μL,依次测定峰面积值。
1.2.2.4加样回收率试验
精确量取6份已知浓度(7.086μg/mL)的大麻二酚提取液10mL分成3组,分别加入浓度为4.0μg/mL的标准品溶液1.0、2.0和3.0mL,测定其峰面积值,分别计算出加样回收率。
1.2.3样品制备
取火麻干燥叶子粉末1.0g,按照料液比加入不同量的提取溶剂,设置不同的超声条件提取。将提取液冷却至室温后进行过滤,将过滤后的提取液进行真空旋蒸回收旋蒸提取溶剂,再用甲醇溶剂定容至1.0mL,12000r/min离心20min,吸取上清液,过0.45μm微孔滤膜,所得滤液按上述液相条件进行大麻二酚HPLC含量测定。
1.2.4单因素试验
准确称取火麻叶1.0g,采取控制单一变量法,设置梯度提取时间为10、15、20、25和30min;提取温度为50、60、70、80和90℃;料液比为1∶5、1∶10、1∶15、1∶20和1∶25(g/mL);提取功率280、300、320、340和360W。以提取时间25min,提取温度80℃,料液比为1:20g/mL,提取功率320W为基本条件,CBD含量作为指标,研究单因素条件对CBD提取的影响。
1.2.5响应面优化试验
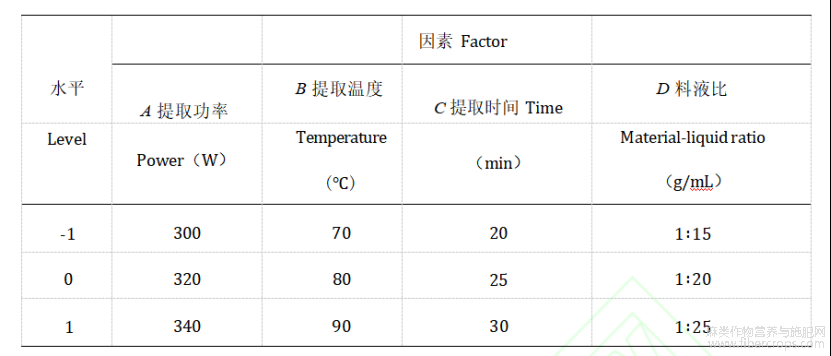
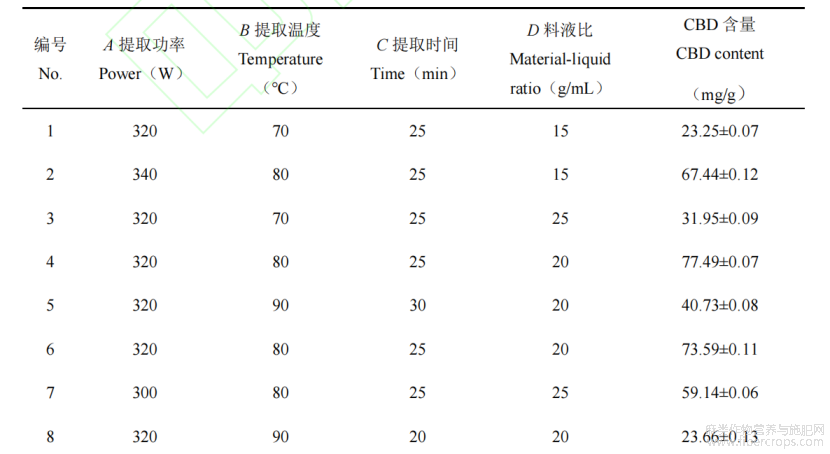
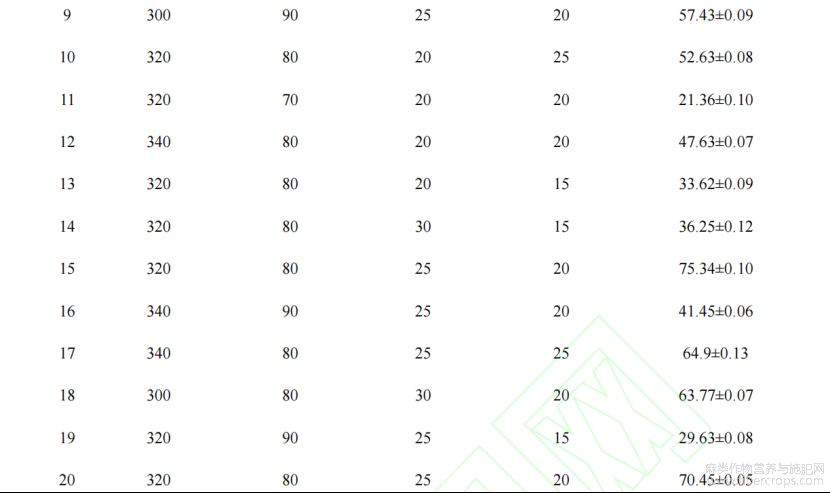
在上述实验的基础上,为进一步研究因素之间的相互作用,选取提取功率(A)、提取温度(B)、提取时间(C)、和提取料液比(D)作为实验因素,以火麻叶中CBD的含量作为响应值(Y)。根据Box-BenhnkenDesign实验设计,生成4因素3水平的响应面实验设计,共有29组实验。实验因素与水平见表1。
表1实验因素与水平
1.2.6数据处理
每组实验重复3次。使用MicrosoftExcel软件整理数据整理,利用SPSS18.0软件分析数据,采用One-wayANOVA方法进行方差分析,用MicrosoftExcel及Origin2021绘图。
2结果与分析
2.1大麻二酚HPLC检测方法
2.1.1大麻二酚色谱图
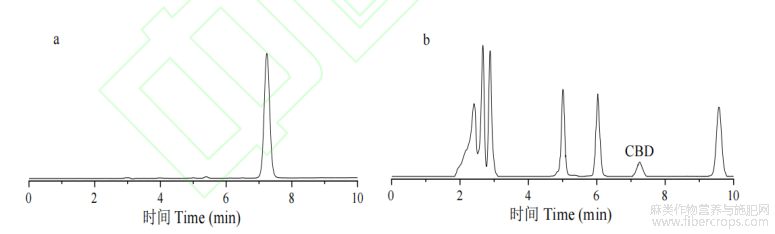
按1.3.1中方法,将CBD标准品和样品进行HPLC检测,得到色谱图见图2。如图,大麻二酚出峰时间较快,7~8min时间内出峰,简单高效,分离效果优,目标峰两边没有其他峰干扰,而且峰型较好,可以方便快捷地检测火麻中大麻二酚含量。
图2大麻二酚标准品(a)和样品(b)色谱图
2.1.2方法学考察
2.1.2.1精密度考察
计算得到大麻二酚峰面积的RSD分别为1.31%、1.02%和0.47%,表明该方法精密度良好。
2.1.2.2稳定性考察
计算得到大麻二酚峰面积的RSD分别为1.64%、0.62%和0.52%,表明标准品溶液在24h内稳定性良好。
2.1.2.3重复性考察
计算得到其RSD分别为2.47%和3.58%(n=5),表明该方法的重复性较好。
2.1.2.4加样回收实验
分别计算出加样回收率,其平均值为97.49%,RSD为0.45%,表明方法准确度可靠。
2.2单因素实验
2.2.1提取时间
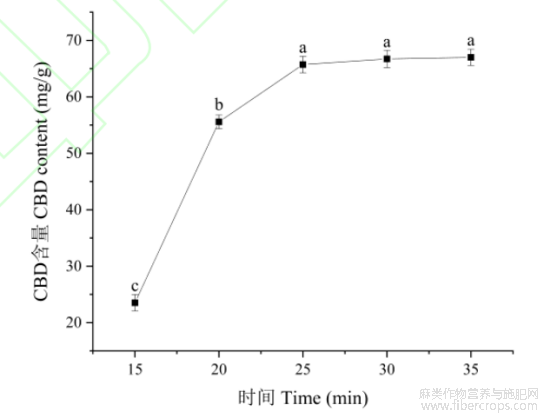
提取时间直接影响到植物中有效成分的提取效率,提取时间过短,植物中的有效成分不能提取完全且造成原料浪费;提取时间过长,会导致提取物有效成分发生降解或结构上的破坏,还会造成时间和能量的浪费。如图3所示,本研究通过对火麻叶中大麻二酚含量随提取时间变化研究,结果表明:提取时间从15~25min,随着提取时间的延长,大麻二酚的提取含量快速升高;当提取25min以后,随提取时间的增加,大麻二酚的含量虽有稍量增加,但增加的量很少,经方差分析,差异不显著(P>0.05)。随超声时间的延长,对细胞壁的破坏就越大,大麻二酚的溶出就越多,一定时间后,溶液体系会达到平衡。超声时间越长,超声的热效应开始发挥作用,但这种热效应有限。因此,选择25min作为最佳超声提取时间。
图3不同时间下大麻二酚的含量
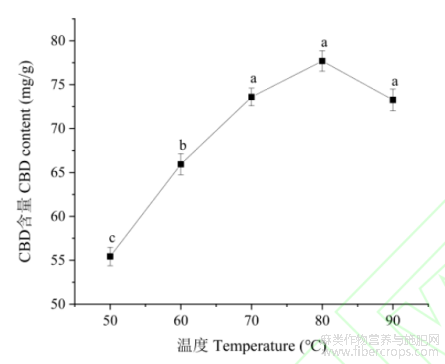
2.2.2提取温度
如图4所示,随着提取温度的升高大麻二酚的含量先上升后下降;当温度为80℃时,大麻二酚含量达到最大值,并且与其它温度下的大麻二酚的含量呈现显著性差异(r<0.05)。这是由于酚类物质具有热敏感性,温度升高能够提升酚类物质的溶解性和扩散速度,但也会导致酚类物质加速分解与氧化,80℃可能是大麻二酚上述关系的一个平衡温度,提取温度在80℃之前,前者占主导作用,而超过80℃,后者占优势。故选择80℃作为最佳单因素提取温度。
图4不同提取温度下大麻二酚的含量
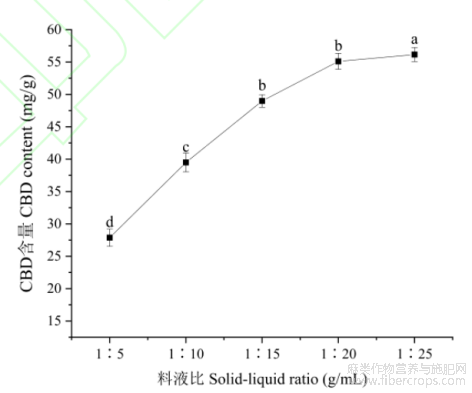
2.2.3料液比
为提高提取率和节省提取溶剂,研究了料液比对大麻二酚提取含量的影响,结果如图5所示,大麻二酚的提取含量随料液比的增加而增大。当料液比在1:20(g/mL)以后时,大麻二酚的提取量虽有少量增加,但方差分析显示差异不显著(P>0.05)。考虑到溶剂损耗、浓缩时间等后续工艺成本等问题,确定料液比为1:20(g/mL)为最佳提取料液比。
图5不同料液比下大麻二酚的含量
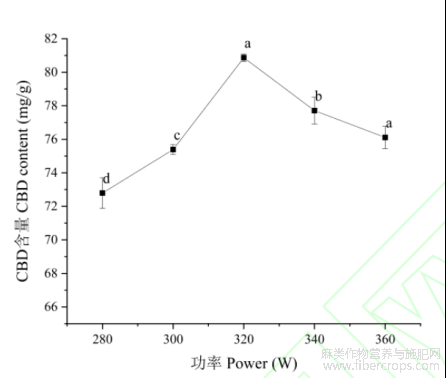
2.2.4提取功率
结果如图6所示,随着提取功率的增大,提取得到的大麻二酚的含量也增大,当功率为320W时,大麻二酚的含量最大。此后,随着提取功率的增加,大麻二酚的含量降低。可能是低超声功率产生的空化效应不足以破坏大麻叶的植物细胞的细胞壁,随着提取功率的增大,大麻叶细胞的细胞壁被破坏得也越大。但功率过大可能会导致大麻二酚的降解,导致含量降低。因此选择320W作为最佳超声功率。
图6不同提取功率下大麻二酚含量
2.3响应面优化试验结果分析
2.3.1模型建立
火麻叶中大麻二酚的提取时间、提取温度、料液比和提取功率4个主要影响因素进行优化,以大麻二酚含量为指标,结果见表2所示。
表2响应面实验结果
利用Design-expertV11软件对表2中的数据进行分析,以火麻叶子中大麻二酚含量(Y)为响应值,对表2中的数据进行多项回归拟合,得到以响应值为目标函数的二次多元回归方程:Y=72.35+2.15A+4.94B+5.62C+7.39D-9.41AB-0.86AC-7.16AD+4.57BC-0.58BD+3.11CD-3.96A2-28.49B2-14.83C2-12.73D2
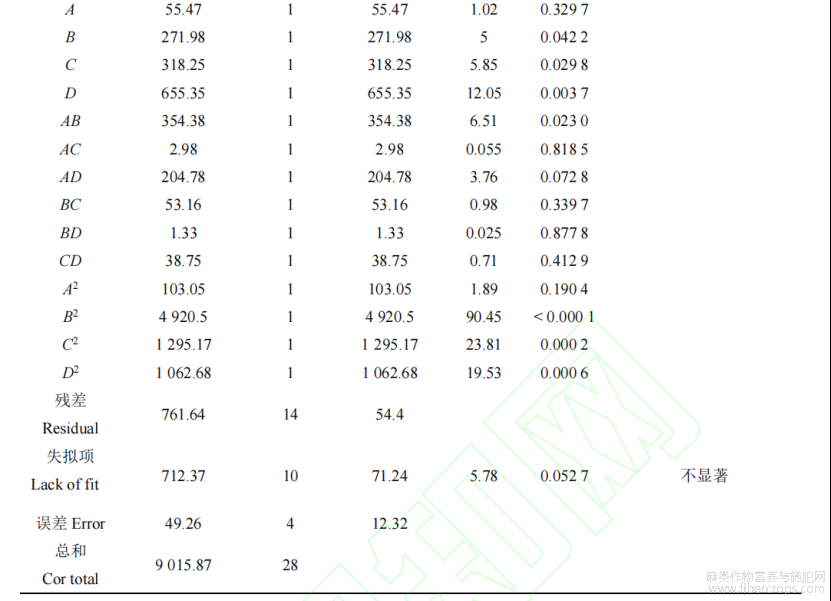
表3回归方程的方差分析
回归模型各项的方差分析见表3。可知,模型F=10.84,P?0.0001,建立的模型显著性良好;失拟项F=5.78,P=0.0527>0.05,失拟项不显著,表明所选用的二次多项模型的拟合程度良好。模型R2=0.9155,表明该回归方程有较好的相关性,R2Adj=0.8310,表明该回归模型可以解释83.10%实验数据的变异性。模型实际值与预测值拟合较好,表明该回归方程对试验的拟合性较好,可用于预测和分析火麻中CBD的含量。该实验的CV值是0.13%,较低,表明它具有很好的可靠性和较高可信度,使用此模型进行分析响应值的变化,能较好地反映真实的试验值。
2.3.2各因素与交互因素作用分析
各因素的F值可以反映出对响应指标的显著程度,F值越大,P值越小,意味着对响应指标的影响越大,系数更显著。从表3的方差分析结果可以看出,几个因素对火麻叶中的大麻二酚提取含量的影响程度顺序:料液比(D)>提取时间(C)>提取温度(B)>提取功率(A);以提取功率与提取温度AB的交互作用对响应值影响显著(P<0.05),其它几组交互作用对结果影响不显著(P>0.05)。
根据上述回归方程,利用响应面法获得了提取因素与CBD含量之间关系的三维曲面图。从图7中可以看出提取功率、提取温度、提取时间和料液比及其相互作用对CBD提取含量的影响。等高线轮廓的形态也可以反映出各因素之间交互作用对响应值影响的强弱情况,等高线的形状为椭圆表示这2个因素之间的交互作用对响应值影响强烈,圆形则代表各因素之间的交互作用不显著。如图7所示,在交互作用对CBD提取含量的影响中,BD对CBD含量影响最小,AC与其相似,其次是CD和BC,提取功率×提取温度AB、AD对CBD的提取含量影响较大,这也与表3中回归方程的方差分析所得到的结果是一致的。二项式B2、C2和D2的P值均<0.01,说明它们对火麻叶中CBD的提取的含量有着显著的影响。A2的P值>0.05,表明影响不显著。
图7各因素交互作用的响应面图
2.3.3最佳工艺验证
利用Design-expertV11软件对实验条件进行优化,通过数据分析得到超声提取火麻叶中大麻二酚的最优的提取条件为:提取功率307.72W,提取温度81.54℃,提取时间26.33min,料液比1∶22.03(g/mL),在此条件下,大麻二酚的提取量为74.63±0.72mg/g。考虑到实验操作的实际性,将提取条件校正为:提取功率320W,温度81℃,时间26min,料液比1∶22(g/mL)。平行实验三次,得到大麻二酚含量的平均值为79.53±0.26mg/g(CV为2.58%),结果与理论值方差分析,差异不显著(P<0.05),表明回归方程可以较好地预测实验结果以及模型的可靠性。
2.4火麻不同部位大麻二酚含量检测
利用所获得的最优提取条件,对来自黑龙江大庆火麻栽培品种的根、茎、嫩叶(植株最顶端往下2~4片叶片)、老叶(植株中部以下叶片)、种子等不同部位中的大麻二酚含量进行检测,结果如表4所示,幼嫩叶片中的大麻二酚含量最高为87.32±0.24mg/g,其余部位大麻二酚含量以老叶,种子,茎和根依次降低。
表4不同部位大麻二酚含量(x±s,n=3)
3讨论与结论
本研究以火麻叶为实验材料,采用AgilentHC-C18柱,建立了一种简单、快速从火麻 叶中大麻二酚的HPLC检测方法,该方法灵敏度高、简便易行,结果准确可靠。与Chen等[14]建立的液相方法大麻二酚在9min后出峰相比,此液相方法的出峰时间更快在7~8min,分离效果优、峰型理想;与Xie等[15]建立液相方法的加样回收率为91.2%~97.6%(RSD为 3%)相比,本研究建立的液相方法平均加样回收率为97.49%(RSD为0.45%),此方法稳定性好、重复性更好,可以高效地检测火麻中大麻二酚含量,适用于大麻二酚的定量分析,同时也为评价火麻的质量提供了可靠保证。
在单因素的基础上,基于Box-BehnkenDesign响应面法得到了从火麻叶中超声辅助提取大麻二酚的最佳工艺条件:以甲醇为提取溶剂,料液比为1∶22(g/mL),提取功率为320W,提取温度为81℃,提取时间为26min,在此条件下,大麻二酚含量为79.53±0.26mg/g。与Yan等[16]的研究相比,对于超声提取的条件,包括提取功率、提取料液比和提取 温度进行进一步的具体研究,对超声辅助提取火麻中的大麻二酚条件进行明确和补充。与Hao等[17]研究用热回流技术提取大麻二酚的提取3次2h/次相比较,在提取得到相同量的 大麻二酚条件下,本研究中的方法,所需的时间更短,对溶剂的耗费量也更少;与Gao等[18]的研究相比,提取的时间更短,在最佳工艺的条件下,大麻二酚的提取量也更多。本试 验所得最佳提取工艺条件在一定程度上缩短提取时间,避免长时间提取对活性成分的影响,提高了大麻二酚的提取量和提取效率。
采用本研究所建立的高效液相方法测定了黑龙江大庆火麻栽培品种各部位的大麻二酚含量为嫩叶中最高,其次依次为整株叶片、老叶、种子和茎,根中的大麻二酚含量最低。研究结果可为火麻中大麻二酚提取和火麻高附加值产品进一步开发利用提供数据。
参考文献
[1] Odieka AE, Obuzor GU, Oyedeji OO, et al. The medicinal natural products of Cannabis sativa Linn: A review[J].Molecules,2022,27:168-169.
[2]Kopustinskiene DM, Masteikova R, Lazauskas R, et al. Cannabis sativa L. bioactive compounds and their protective role in oxidative stress and inflammation[J].Antioxidants,2022,11:66-70.
[3]Thapa D, Cairns EA, Szczesniak AM, et al. The cannabinoids Δ8THC,CBD,and HU-308 act via distinct receptors to reduce corneal pain and inflammation[J].Cannabis Cannabinoid,2018,3:11-20.
[4]Garcia MS, Navarrete F, Gasparyan A, et al. Cannabidiol: a potential new alternative for the treatment of anxiety, depression, and psychotic disorders[J].Biomolecules,2020,10:157- 165.
[5]Heider CG, Itenberg SA, Rao J, et al. Mechanisms of cannabidiol(CBD) in cancer treatment: A review[J].Biology,2022,11:8-17.
[6]Bielawiec P, Harasim SE, Chabowski A. Phytocannabinoids:useful drugs for the treatment of obesity? Special focus on cannabidiol[J].Front in Endocrinol,2020,11:11-14.
[7]Burstein S. Cannabidiol and its analogs:a review of their effects on inflammation[J].Bioorg Med Chem,2015,23:1377-1385.
[8]Davies C, Bhattacharyya S. Cannabidiol as a potential treatment for psychosis[J].Ther Adv Psychopharmacol,2019,9:11-16.
[9]Friedman D, French JA, Maccarrone M. Safety, efficacy, and mechanisms ofaction of cannabinoids in neurological disorders[J].Lancet Neurol,2019,18:504-512.
[10]Boggs DL, Nguyen JD, Morgenson D, et al. Clinical and preclinical evidence for functional interactions of cannabidiol and Δ9-tetrahydrocannabinol[J].Neuropsychopharmacology,2018,43:142-154.
[11]Iftikhar A, Zafar U, Ahmed W, et al. Applications of Cannabis sativa L. in food and its therapeutic potential:from a prohibited drug to a nutritional supplement[J].Molecules,2021,26:76-99.
[12]Yu XJ, Liu CY, Yang LR, et al. Research progress of cannabidiol in industrial hemp[J].Chin Trad Pat Med(中成药),2021,43:1275- 1279.
[13]Yedukondalu N, Suraya J, Gianluigi L, et al. Isolation, synthesis and structure determination of cannabidiol derivatives and their cytotoxic activities[J].Nat Prod Res,2021,35:471-480.
[14]Chen GF, You HM, Wang GJ, et al. Simultaneous determination of four cannabinoids in industrial hemp by HPLC[J].Heilongjiang Agric Sci(黑龙江农业科学),2021,5:60-64.
[15]Xie NY, Bao G, Zhang H. Determination of cannabidiol in cosmetics by HPLC[J].Flavour Frag Cosmet(香料香精化妆品),2022,1:74-77.
[16]an JT, Chang L, Zhang JJ, et al. Optimization of extraction process and analysis of biological activity of cannabidiol in industrial hemp[J].Plant FiberSci China(中国麻业科学),2020,42:61-69.
[17]Hao HJ, Sun WX ,Xing JB, et al. Study on the extraction process of cannabidiol from industrial hemp leaves[J].J Green Sci Technol(绿色科技),2019,1:149-150.
[18]Gao Z, Zhang ZJ, Li XJ, et al. Hot reflux extraction of cannabidiol from hemp leaves[J].China Oil Fat(中国油脂),2019,44:107-111.
文章摘自:张一宁,于志琪,屈施旭,刘同歌,张玉红.火麻叶中大麻二酚提取工艺的响应面法优化及不同部位含量分布[J/OL].天然产物研究与开发. https://link.cnki.net/urlid/51.1335.q.20240118.1723.002