摘 要:斑马纹病是剑麻的主要病害之一,严重影响了剑麻产业的发展,目前关于斑马纹病的致病机制尚不清楚。为了培育出剑麻斑马纹病抗病新品种,本研究分别以剑麻斑马纹病抗病品种粤西114和感病品种H.11648为父母本进行回交,获得回交后代热麻1号剑麻。利用常规方法对热麻1号剑麻叶形、叶色、叶缘刺有无、叶缘刺类型、叶顶刺类型、叶长、叶宽、叶基厚度、顶刺长、顶刺基部宽、株高、花序形状、花轴高、花梗数、花、果实、种子、年展叶数、周期展叶数、生命周期、纤维率等进行分析,采用壁低渗火焰干燥法、流式细胞术结合菌斑接种法对热麻1号剑麻倍性、基因组大小以及对烟草疫霉的抗性等进行鉴定。结果表明:热麻1号剑麻叶片剑形、肉质、刚硬、叶片灰绿,叶面平整有蜡粉,叶顶有1.2-2.0 cm锐刺,叶缘无刺,叶片绕茎呈螺旋状排列上升。叶长约130 cm,叶宽约16 cm,叶基厚度约3.5 cm。株高1.8-2.5 m,圆锥形花序,花轴高3-7 m,花梗数20-32个,完全花、花黄色、花瓣6枚。蒴果、长圆形、成熟时黑褐色,种子半月形,黑色、纸质。周期展叶360~400片;纤维率约3.5%,纤维长约100 cm。生命周期6-9年。热麻1号剑麻为四倍体(2X=4n),染色体数目为104-118,2C DNA含量为11.69 pg,对烟草疫霉高度抗病或免疫,有望成为剑麻斑马纹病发病区的先锋品种。
关键词:热麻1号剑麻;斑马纹病
剑麻是重要的热带经济作物之一,其纤维质地坚韧、富于弹性、拉力强、抗撕裂、耐磨、防腐以及耐低温等,广泛应用于国防、渔业、交通运输以及冶金等领域[1,2],随着材料科学技术的飞速发展,通过添加剑麻纤维改进新型复合材料及其衍生材料的性能[3],扩大复合材料在军事以及多种民用制造业中的应用,对推动我国经济快速发展起到了非常重要的作用。同时剑麻在食品科学[4,5,6]、医学[7]、生物质能源[8]以及作物遗传改良[9]等方面应用广泛,因此,加快剑麻种质创新,对推动我国经济长期稳定发展具有重要的经济价值。
斑马纹病是剑麻的主要病害之一,主要由烟草疫霉(Phytophthora nicotianae Breda)引起,因斑马纹病导致大面积麻园被毁,纤维产量下降,严重影响了国内外剑麻产业的发展[10,11]。国内外学者对该病进行了大量研究,目前已形成了一套完整的病原菌分离、鉴定和防治技术[12]。同时,在剑麻种质资源抗性鉴定、抗斑马纹病生理生化机制、功能基因挖掘以及转基因等方面也开展了研究[13,14,15,16,17],取得了一定进展,但抗病机制和致病机理仍不清楚。由于长期大量使用化学药剂对环境和生物多样性破坏严重,因此,培育出抗斑马纹病新品种,仍然是育种学家们一直以来的的首要目标。20世纪80年代初,育种学家们以主栽品种H.11648为母本,普通剑麻为父本,通过有性杂交培育出来F1代杂交品种粤西114,粤西114的特点是抗斑马纹病,对茎腐病也有一定抗性,但该品种叶基厚、叶缘有刺、生命周期短,在后续试验中发现对斑马纹病抗性不稳定[18]。为了稳定和提高粤西114的优良性状,本研究利用粤西114与H.11648回交,获得杂交F2代,通过对杂交F2代叶缘刺有无、叶长、叶宽、株高、叶基厚度、年产叶数、周期产叶数、纤维率、抗病性、抗寒性等多个性状综合评价,初步筛选出叶缘无刺、长势良好、抗性比亲本粤西114和H.11648强的优良单株、然后在广东、广西等剑麻主产区开展品比试验和区域性试验,进一步筛选出了综合长势良好,叶缘无刺、对斑马纹病高度抗病的剑麻新品种-热麻1号剑麻。该品种2015年获得广东省品种登记权。由于热麻1号剑麻生命周期比主栽品种H.11648短,周期产业数比主栽品种H.11648少,热麻1号剑麻目前常用于剑麻斑马纹病病区补植品种和优良杂交亲本,还未广泛推广应用。
1 材料与方法
1.1 材料
H.11648、粤西114和热麻1号保存在中国热带农业科学院南亚热带作物研究所剑麻种质圃。Zea mays cv. CE777玉米种子由Dole?el友情提供。
1.2 实验方法
1.2.1 亲本选择及杂交
以斑马纹病抗病品种粤西114为母本,以主栽品种H.11648为父本进行人工杂交,待果实成熟后取出种子并播种育苗,待植株生长到30公分左右,根据植株的表型特征如叶缘有/无刺,叶长,叶宽,叶片数、株型,叶基厚度等,结合育种目标初步筛选出候选材料,作为进一步鉴定的优株。
1.2.2 形态学特征观测
随机选取10株成龄麻,每株3片叶片,对热麻1号株型、叶片伸展模式、叶形、叶色、叶缘刺有无、叶缘刺类型、叶顶刺类型、叶片有无蜡粉、叶长、叶宽、叶基厚度、顶刺长、顶刺基部宽、株高、花轴高、花梗数、花、果实、种子等性状进行观测,其中质量性状用肉眼观测,数量性状用卷尺进行测定。其中叶长为叶基部到顶刺的距离(包括顶刺),叶宽为叶片最宽处的宽度。株高为植株基部到叶片顶端的高度,株高、花轴高,花梗数、花色、花序形状等在植株开花后测量,果实以及种子等数据在果实成熟时收集,所有数据用EXCEL软件进行分析统计。
1.2.3 纤维特性测定
待叶片成熟后,收割叶片,称量鲜叶重量,然后加工收获纤维,待纤维晾干后称取干纤维重量,计算纤维率,同时用拉力测量仪测量纤维拉力大小。纤维率=干纤维重/鲜叶重×100%。
1.2.4 斑马纹病抗性鉴定
大田抗病性测定:以热麻1号剑麻为试验对象,以H.11648和粤西114为对照,在雨季来临前种植于斑马纹病重病发病区,雨季过后调查斑马纹病发病情况,具体参考赵艳龙等[12]的方法进行。室内抗病性鉴定:采用盆栽和离体叶片两种方式接种方式,取斑马纹病病菌接种于提前准备好的H.11648、粤西114和热麻1号叶片上,用棉花保湿,分别在接种24、48、72h和7d测定病班大小,具体参考张燕梅等[2]的方法进行。
1.2.5 根尖染色体检测
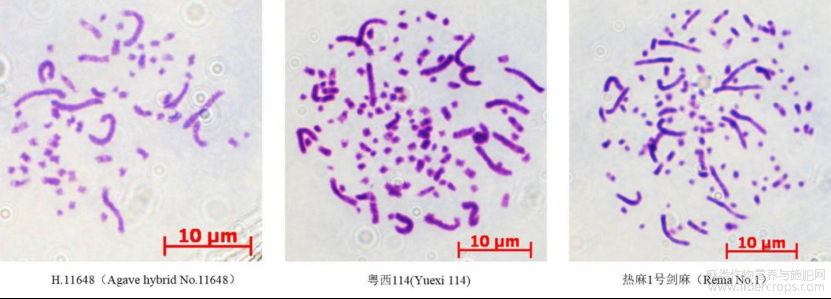
分别取热麻1号、H.11648和粤西114根尖约1cm,先用0.002mol/L浓度的8-羟基喹啉预固定2h,然后用卡诺固定液(无水乙醇:冰乙酸=3:1)固定过夜,用5%纤维素酶和果胶酶(纤维素酶:果胶酶=1:1)37℃孵育1h后快速涂片并火焰干燥,最后用5%Giemsa染色10-15min,在显微镜(ZEISS Axiolmager M2)下观察染色体数目,并拍照保存。
1.2.6 基因组大小测定
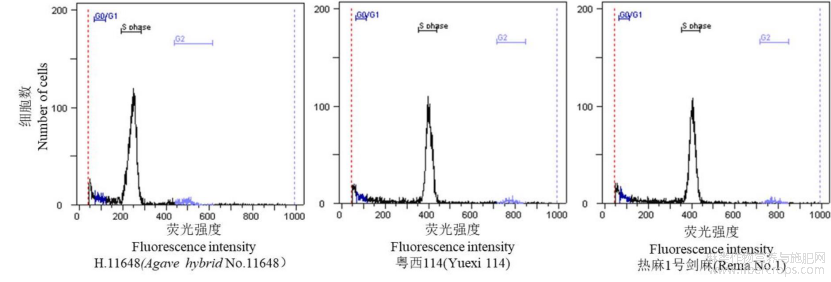
取热麻1号、H.11648和粤西114组培苗叶片,以玉米(Zea mays cv. CE777)为标准样品(standard plant),用流式细胞仪(Partec)测定基因组大小,具体参照Palomino等[14]的流式细胞仪方法测定,待测样品2C DNA含量=待测样品G0/G1值÷(标准样品G0/G1)×标准样品2C DNA含量(pg)。
1.3 数据分析
病斑大小用尺子测量并EXCEL软件分析处理和作图。
2 结果与分析
2.1 表型特征及纤维特性
热麻1号剑麻植株高大,约1.9m,叶片向上螺旋排列,灰绿色,肉质刚直,叶剑形,表面平整,有少量蜡粉,叶缘无刺,叶尖有1.6-2.0cm黑褐色坚硬的锐刺,叶长120-135cm,叶宽15-17cm,叶基厚度约3.5cm,年展叶45-55片,周期展叶数360-400片。圆锥花序,花轴高5.1-5.5m,花梗数20-32个,完全花,花黄色,花被浅淡黄色,下部联合形成萼筒,上部分裂成6片花瓣,雌蕊一枚,柱头3裂,子房下位,自交结实。蒴果,长圆形,果实大小约5cm×6cm,早期为绿色,成熟后为黑褐色。每个果实里约300枚种子,种子半月形,成熟后为黑色,纸质扁平,有光泽。生命周期6-9年,叶片纤维含量3.5%,纤维细而均匀,长度110cm、纤维拉力66.2kg、束纤维强力649牛顿(图1)。
2.2 倍性和基因组大小测定
根尖染色体观测和流式细胞仪分析表明,热麻1号剑麻染色体数目为104-118,长染色体和中等长度的染色体共计20条,其余染色体为棒状或点状,为四倍体,基因组大小2C=11.69±0.02pg。H.11648染色体数目为48-60条,长染色体和中等长度的染色体共10条,为二倍体,基因组大小2C=7.07±0.02pg。粤西114染色体数目为101-112条,其中长染色体和中等长度的染色体共20条,为四倍体,基因组大小2C=11.74±0.21pg(图2)。
图1 热麻1号剑麻
A1: 开花植株;A2:叶片;A3:叶顶刺;A4:花;A5:果;A6:种子
图2 H.11648,粤西114和热麻1号剑麻根尖染色体
图3 H.11648,粤西114和热麻1号剑麻DNA含量检测
2.3 斑马纹病抗性检测
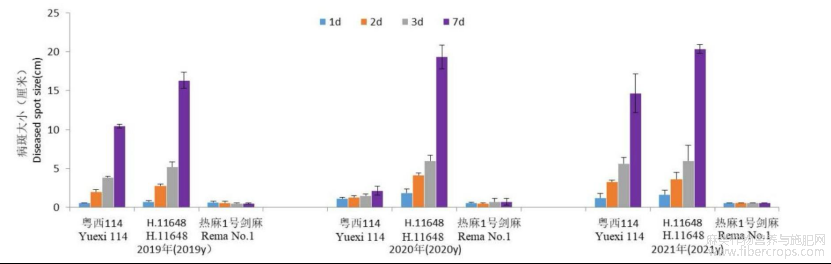
大田抗病试验表明,H.11648、粤西114和热麻1号剑麻抗病指数分别为78.1、63.2和22.4,对斑马纹病菌表现为高度感病,中度感病和高度抗病(赵艳龙等,2014)。盆栽试验和离体叶片接种后发现,H.11648病斑最大,2019-2021年连续三年接种烟草疫霉,每年接种1周后观测发现病斑大小均超过15cm,粤西114次之,2019年约10cm,2021年约15cm,2020年约2cm,抗性极不稳定,热麻1号剑麻除伤口处有与伤口相同大小的约0.6cm褐斑外,随着接种时间延长,病斑没有进一步扩展,检测结果与大田试验一致,且2019、2020和2021接种结果均不变,即热麻1号剑麻对烟草疫霉的抗性远超过亲本H.11648和粤西114,对斑马纹病菌表现为高度抗病(图4)。
图4 H.11648,粤西114和热麻1号剑麻2019、2020、2021年接种烟草疫霉后病斑大小
3 讨论
培育抗病高产剑麻新品种一直是剑麻育种的首要目标,采取的方式方法也多种多样,比如人工杂交、化学诱变、细胞融合、单倍体育种、基因工程以及基因编辑等,其中人工杂交是较为常用方法之一,在此过程中,亲本的选择尤为重要。H.11648是目前剑麻产业中唯一的主栽品种,平均年长叶60-70片,周期长叶560-650片,纤维率5%以上,生长周期10年以上,综合性状优良,常常作为重要的亲本材料广泛应用于剑麻育种,但H.11648易感斑马纹病。粤西114是H.11648与普通剑麻的杂交F1代,通过长期试验观察发现,该品种对斑马纹病菌表现为较强的抗病性,但抗性不稳定,因此,利用粤西114和H.11648为亲本进行杂交,有望获得抗病高产的新品种。热麻1号剑麻是粤西114和H.11648回交子代,对斑马纹病菌高度抗病甚至免疫,并且抗性稳定,此外,热麻1号剑麻耐旱耐寒,速生粗长,本研究室前期在云南元谋干热河谷区的品种试验发现,热麻1号剑麻在云南干热河谷区生长较其它品种要好,因此,可以广泛应用于云南干热河谷区生态恢复。由于热麻1号剑麻生产周期短,纤维含量比H.11648低,目前常作为抗性杂交亲本使用,暂时还未推广应用。随着育种工作的不断推进,目前已从热麻1号剑麻的自交子代和杂交后代中相继筛选出部分优良单株,进一步的品种区域试验正在进行,有望获得产量高抗性强的剑麻优良品种,因此,有一定的应用前景。
根尖分生组织细胞生长旺盛,常用于染色体观察,并且相对于流式细胞仪倍性分析而言,染色体观察能更直观地观察到染色体数目,形态特征等。本研究结果显示粤西114染色体数目为102-114条,根据中长染色体数目,结合流式细胞仪分析结果判定为四倍体,染色体形态正常,未检测到三倍体和丝状小染色体,这与吕玲玲等研究结果有一定差异[19],可能与剑麻复杂的倍性,以及自然条件下容易变异有关[20,21,22,23]。建议扩大观测样本数量,防止实验结果出现偏差。此外,粤西114的母本H.11648为二倍体,父本普通剑麻为五倍体,有望获得三倍体和四倍体的子代粤西114。四倍体的粤西114和二倍体的H.11648回交获得四倍体热麻1号剑麻,一方面说明剑麻遗传的复杂性,同时也证实了剑麻多倍体和非整倍体广泛存在,变异频繁而且比例还很高的观点[20,21],因此,建议在杂交亲本选择时,尽量不选或少选多倍体。
流式细胞术作为一种高效快速的倍性鉴定和DNA含量分析方法,在剑麻种质资源鉴定与评价中应用广泛[22,23]。该方法能快速直观地检测出目标样本的倍性,而且灵敏度高,尤其对于大样本,省时省力。由于流式细胞术无法直观展示染色体的核型特征,染色体是否丢失或结构发生变化等信息,建议在进行分析时,将流式检测技术与常规的染色体制片技术相结合,进一步分析染色体形态结构特征及倍性。
前人研究表明剑麻染色体基数为30,其中5条长染色体,25条相对小染色体,随着倍性增加,染色体条数成比例增加[20]。热麻1号和粤西114染色体数目存在较大出入,一方面可能是实验操作过程中小染色体降解或丢失,也可能是不正常减数分裂如丢失,交换等,或非整倍体存在等多种因素所致,同时这也会导致在加倍过程中基因组变小[25]。Robert等[20]以洋葱(Allium cepa cv. Ailsa Craig)为参考基因组,对H.11648等龙舌兰属剑麻7个品种进行基因组大小分析,结果显示H.11648基因组4C DNA为15.23 pg,本研究以玉米(Zea mays cv. CE777)为参考基因组,显示H.11648基因组2C DNA为7.07 pg,另外,从理论而言,热麻1号和粤西114为四倍体,2C DNA为H.11648的2倍,约14.14 pg,实际分析结果分别为11.69 pg和11.74 pg,出入较大,可能与参考基因组的选择有关。Moreno-Salazar[26]、Palomino[27]和Robert等[20]分别在对Agave angustifolia Haw进行基因组大小分析时,以玉米(Zea mays cv. CE777)为参考基因组分析结果为2C DNA为8.499 pg[26]和8.477 pg[27],以洋葱(Allium cepa cv. Ailsa Craig)为参考基因组大小为7.45pg[20]。Dole?el & Bartos等[24]认为,为了降低试验结果误差,应选取与研究对象基因组大小相近的物种作为参考基因组。
参考文献
[1]周文钊,张燕梅,陆军迎.“十二五”剑麻科技发展趋势与建议[J].热带农业工程,2011,35(03):49-52. ZHOU W Z, ZHANG Y M, LU J Y. Sisal technology development trend and suggestions in 12th plan, Tropical Agricultural Engineering, 2011, 35(03): 49-52.
[2]PÉREZ-ZAVALA M L,HERNÁNDEZ- ARZABA J C, BIDESHI D K,BARBOZA-CORONA J E.Agave: a natural renewable resource with multiple applications[J].Journal of the Science of Food and Agriculture,2020,100:5324-5333.
[3]ROSAS-DÍAZ F, GARCÍA-HERNÁNDEZ D G,MENDOZA-RANGEL J M, TERÁN-TORRES B T,GALINDO-RODRÍGUEZ S A, JUÁREZ–ALVARADO C A.Development of a Portland cement-based material with Agave salmiana leaves bioaggregate[J].Materisals(Basel),2022,30:15(17):6000.
[4]ACOSTA-SALAZAR E, FONSECA-AGUI?AGA R, WARREN-VEGA W M,ZÁRATE -GUZMÁN A I,ZÁRATE -NAVARRO M A, ROMERO-CANO L A, CAMPOS-RODRÍGUEZ A. Effect of age of agave tequilana Weber Blue variety on quality and authenticity parameters for the Tequila 100% agave silver class:evaluation at the industrial scale level[J].Foods,2021,10,3103-3103.
[5]MARTINEZ-MARTINEZ M U, VÁZQUEZ-MALDONADO D, RATERING S, GODÍNEZ-HERNÁNDEZ C, ORTIZ-BASURTO R I, SORIA-GUERRA R E, SCHNEIDER B, JUÁREZ-FLORES B I, PORTALES-PÉREZ D P, SCHNELL S, MARTINEZ-GUTIERREZ F. Fructans from Agave enhance probiotic yoghurt by modulating gut microbiota on children with overweight or obesity[J].Food Bioscience,2022,46:101516.
[6]LÓPEZ -ROMEROA J C, AYALA-ZAVALAA J F, GONZÁLEA -AGUILARA G A, PE?A-RAMOS E A, GONZÁLEZ-RÍOS H. Biological activities of agave by-products and their possible applications in food and pharmaceuticals[J]. Science of Food and Agriculture,2018,98(7):2461-2474.
[7]GABR N M, GHALY N S, MINA S A. Structural characterization of three cytotoxic steroidal saponins from the leaves of Agave desmetiana hort[J].Phytochemistry,2022,195,113057.
[8]CORBIN K R, BYRT C S, BAUER S, DEBOLT S, CHAMBERS D, HOLTUM J A M, KAREM G, HENDERSON M, LAHNSTEIN J, BEAHAN C, BACIC A, FINCHER G B, BETTS N S, BURTON R A.Prospecting for energy-rich renewable raw materials: Agave leaf case study[J]. Plos one,2015,10(8):e0135382.
[9]STEWART J R. Agave as a model CAM crop system for a warming and drying world[J].Frontiers in Plant Science,2015,6:684.
[10]李莲英.五星农场更新剑麻园斑马纹病调查分析[J].广西农业科学,2003,(5):47-48. LI L Y. Investigation of zebra strip diseases in regenerated sisal hemp field, Guangxi Agricultural sciences, 2003, (5):47-48.
[11]ROY S, MANDAL R K, SAHA A R, TOPPO R S Symptomatology, variability and management of zebra disease of sisal in Western Orissa[J], J Mycopathol Res,2011,49(1):53-58.
[12]赵艳龙, 周文钊,陆军迎,张燕梅,杨玉梅,何衍彪,常金梅,李国平.剑麻种质资源斑马纹病抗性鉴定及评价[J],热带作物学报, 201435(4):640-643. ZHAO Y L, ZHOU W Z, LU J Y, ZHANG Y M, YANG Y M, HE Y B, CHANG J M, LI G P. Identification and evaluation of resistance to zebra disease of sisal germplasm, Chinese Journal of Tropical Crops, 2014, 35(4): 640-643.
[13]郑金龙,高建明,张世清,等.剑麻斑马纹病病原鉴定[J],东北农业大学学报,2011,42(12):59-64. ZHENG J L, GAO J M, ZHANG S Q, CHEN H L, LIU Q L, YI K X. Pathogen identification of zebra disease of sisal, Journal of northeast agricultural university, 2011, 42(12): 59-64.
[14]张燕梅,李栋梁,李俊峰,赵艳龙,鹿志伟,杨子平,陆军迎.烟草疫霉侵染后剑麻H.11648叶片细胞超微结构和防御酶活性研究[J],热带作物学报,2018,39(6):1161-1165. ZHANG Y M, LI D L, ZHAO Y L, LI J F, LU Z W, YANG Z P, LU J Y, ZHOU W Z. Changes in ultrastructure and activities of defense-related enzymes in leaves of sisal H.11648 after Phytophthora nicotianae Breda infection, Chinese Journal of Tropical Crops, 2018, 39(6): 1161-1165.
[15]汪平,高建明,杨峰,郑金龙,刘巧莲,陈河龙,易克贤.烟草疫霉侵染前后剑麻叶片转录组学研究[J], 热带作物学报, 2014, 35(3): 576-582. WANG P, GAO J M, YANG F, ZHANG J L, LIU Q L, CHEN H L, YI K X. Transcriptome of sisal leaf pretreated with phytophthora nicotianae Breda, Chinese Journal of Tropical Crops, 2014, 35(3): 576-582.
[16]张燕梅,赵艳龙,李俊峰鹿志伟,杨子平,陆军迎,周文钊.剑麻与烟草疫霉互作过程中的转录组研究[J],热带作物学报,2018,39(3):540-546.ZHANG Y M, ZHAO Y L, LI J F, LU Z W, YANG Z P, LU J Y, ZHOU W Z. Transcriptome analysis of Rema No1 after inoculation phytophthora nicotianae Breda. Chinese Journal of Tropical Crops,2018,39(3):540-546.
[17]Gao J M,Yang F,Zhang S Q,LI J Z,CHEN H L,LIU Q L,ZHENG J L,XI J G,YI K X.Expression of a hevein-like gene in transgenic Agave hybrid No.11648 enhances tolerance against zebra stripe disease[J], Plant Cell, Tissue and Organ Culture,2014,119,579-585.
[18]谢恩高, 王东桃. 剑麻新品种粤西114号[J],中国麻作,1991,(4):21.XIE E G,.WANG D T. The new variety Yuexi 114, Plant Fiber Sciences in China, 1991,(4):21.
[19]LV L L, SUN G M, XIE J H ZANG X P, HU Y L, DUAN J.Determination of chromosomal ploidy in Agave ssp.[J].African Journal of Biotechnology,2009,8(20):5248-5252.
[20]ROBERT M L,YOONG LIM K,HANSON L,HANSON L,SANCHEZ-TEYER F,BENNETT M D, LEITCH A R, LEITCH I J. Wild and agronomically important Agave species (Asparagaceae) show proportional increases in chromosome number, genome size, and genetic markers with increasing ploidy[J]. Botanical journal of the Linnean Society,2008,58,215-222.
[21]BANERJEE S, SHARMA A K. Structural differences of chromosomes in diploid Agave[J].Cytologia,1988,53:415-420.
[22]PALOMINO G, DOLE?EL J, MÉNDEZ I,RUBLUO A. Nuclear genome size analysis of Agave tequilana Weber[J].Caryologia,2003,56(1):37-46.
[23]张燕梅,石胜友,李俊峰,鹿志伟,陆军迎,周文钊.剑麻种质资源表型多样性分析与倍性鉴定[J], 热带作物学报,2017,38(5):783-791. ZHANG Y M, SHI S Y, LI J F, LU Z W, LU J Y, ZHOU W Z. Morphological diversity and ploidy identification in Agave germplasms. Chinese Journal of Tropical Crops, 2017, 38(5): 783-791.
[24]DOLE?EL J, BARTOS J. Plant DNA flow cytometry and estimation of nuclear genome size[J]. Annals of Botany,2005,95:99-110.
[25]BENNETT M D, SMITH J B. The 4C nuclear DNA content of several Hordeum genotypes[J]. Canadian Journal of Genetics and Cytology.1971,13:607-611.
[26]MORENO-SALAZAR S F, ESQUEDA M, MARTÍNEZ J. Nuclear genome size and karyotype of Agave angustifolia and A.rhodacantha from Sonora, Mexico[J]. Revista Fitotecnia Mexicana 2007,30(1):13-23.
[27]PALOMINO G, MARTINEZ J, MENDEZ I. Cell types of Agave angustifolia Haw. And karyotype analysis determined by flow cytometry[J]. Revista Internacional de Contaminacion Ambiental. 2005, 21(Supl. 1):49-54.
文章摘自:张燕梅,李俊峰,陆军迎等.剑麻斑马纹病抗病新品种-热麻1号剑麻[J/OL].热带作物学报,1-7[2023-12-27]http://kns.cnki.net/kcms/detail/46.1019.S.20231206.1528.002.html.