摘 要:以谷氨酰胺转氨酶(TG酶)酶活、处理时间和酪蛋白/汉麻子蛋白质量比为自变量,采用响应面法(RSM)优化了酪蛋白-汉麻籽蛋白复合物制备工艺,测定最优工艺下制备复合物的体外消化率、致敏性、微观结构。结果表明,复合物制备最优工艺条件为:TG酶酶活31.90U/g,交联时间2.06h,酪蛋白/汉麻子蛋白质量比10.51:1.49。在最优工艺下制备的酪蛋白-汉麻籽蛋白复合物抗消化酶酶解能力增强,致敏性在消化前或轻度水解时比未交联蛋白低。此外,TG酶交联改变了蛋白的微观形貌,证实两种蛋白间存在相互作用。
关键词:酪蛋白;汉麻籽蛋白;消化性;致敏性
酪蛋白(Casein)占牛奶蛋白的80%左右,是牛奶中最主要的蛋白质,由αs1-、αs2-、β-和κ-casein组成,分子量在19-24kDa之间,具有独特的结构和功能特性。Casein是牛奶的主要过敏原,其中αs1-casein致敏性最强,牛奶过敏人群中约有65%对αs1-casein过敏[1]。对αs1-casein的致敏性及降低其致敏性研究至今仍是热点[2-5]。
汉麻籽蛋白(Hemp protein isolate,HPI)由70%左右的麻仁球蛋白和30%左右的白蛋白组成,是一种新兴的植物蛋白源。研究显示,白蛋白显示出比麻仁球蛋白更有序的二级结构[6]。HPI包含所有必需氨基酸(EAA)[7],必须氨基酸指数(>80)显著高于其他植物蛋白,如板栗蛋白(76-79)、藜麦种子蛋白(79)[8]。此外,HPI几乎没有致敏性且抗营养因子含量极低,有助于其在食品工业中的广泛应用[9]。
食品配方中植物蛋白替代动物蛋白已成为重要趋势[10]。HPI因其独特的营养特性和低致敏性而被认为是casein优良的替代品[11]。然而HPI较差的溶解性和相对较差加工特性使其对casein简单的替换会对食品品质造成不利影响,如何降低HPI对其替代而得的动植物蛋白复合体系影响的研究鲜有报道。谷氨酰胺转氨酶(TG酶)能诱导蛋白质分子间或分子内的共价交联进而修饰蛋白特性[12]。通过TG酶强化casein与HPI间的相互作用以实现HPI对casein的部分替代,具有降低HPI对食品体系的不利影响的潜力。我们的前期研究已证实casein-HPI复合物具有更强的乳化性、凝胶性,但交联降低了复合物抗氧化性。因此本文采用响应面法优化casein-HPI复合物最佳制备工艺,目的是制备具有最优乳化活性、凝胶持水力和抗氧化性保留率的复合蛋白。并考察了最优工艺下制备复合物的体外消化率、致敏性、微观结构,旨在为实现HPI替代或部分替代casein提供理论依据。
1 材料与方法
1.1 主要材料与试剂
汉麻籽购于巴马十琅生态农业有限公司。
酪蛋白(C3400-500g)购于上海Sigma公司。
胃蛋白酶、胰蛋白酶,国药集团化学试剂有限公司;谷氨酰胺转氨酶,江苏一鸣生物股份有限公司。
1.2主要仪器与设备
D-1903扫描电子显微镜,德国WITec公司;UV-1800紫外分光光度计,岛津国际贸易(上海)有限公司;PT 10-35GT均质机,瑞士Kinematica公司;Z326K低温离心机,德国哈默股份公司;Triad冷冻干燥机,美国Labconoco公司。
1.3 试验方法
1.3.1 HPI 提取
参照Alavi等人[13]的方法,粉碎后的汉麻籽粉中添加正己烷(1:3,w/v)搅拌2小时脱脂,该过程重复三次。将脱脂后的汉麻籽粉置于通风橱中室温下风干24小时,后将汉麻籽粉分散在去离子水中(1:10,w/v),用6mol/LNaOH调节pH至11,并在25℃下连续搅拌2h。将混合物在6000×g下离心10min,取上清液,用6mol/LHCl调节pH至4.5,并在4℃下过夜以沉淀蛋白质。沉淀通过6000×g离心10min分离,然后分散于蒸馏水中并调节pH至7.0,最后将混合物冻干并在4℃下储存备用。
1.3.2 Casein-HPI
复合物制备Casein-HPI的制备参考Yang等人[14]的方法。将casein溶液(6%)和HPI溶液(6%)以一定比例混合,加入TG酶并充分搅拌后,在40℃条件下水浴交联一段时间。交联结束后在80℃下水浴10min使TG酶失活以终止反应。蛋白溶液经真空冷冻干燥并于4℃保存备用。
1.3.3 Casein-HPI 复合物制备条件响应面设计
(1)实验因素水平
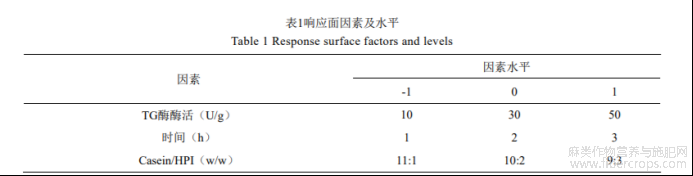
通过单因素试验,根据Box-Behnken设计原理,采用三因素三水平的响应面分析法,研究其对casein-HPI复合物乳化活性、抗氧化性保留率和凝胶持水力的影响。因素及水平见1。
(2)响应面实验方案
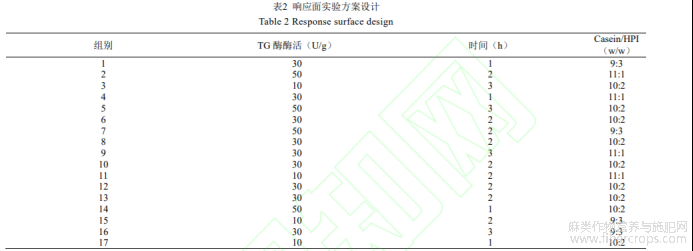
试验方案由Design-Expert 8.0软件随机生成,如表2所示。
(3)最优工艺选择
在Design-Expert软件中选择乳化活性、抗氧化性保留率和凝胶持水力均最高的值(各指标的权重为1:1:1),由软件进行最优工艺选择,使用RSM法预测最优工艺和处理效果,从而得到casein-HPI复合物最优的制备工艺。
(4)最优工艺验证
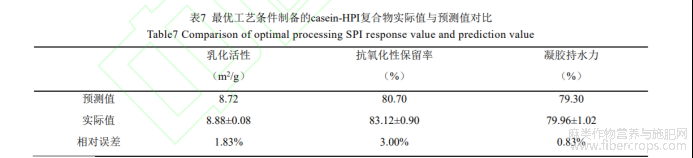
按照最优工艺制备casein-HPI复合物,测其乳化活性、抗氧化性保留率和凝胶持水力,并与软件计算出的理论值对比,验证试验结果与实际检测结果的一致性与可靠性。
1.3.4 乳化活性
蛋白质的乳化活性指数(EAI)测定参照Jiang等人[15]的方法并做了修改。将6mL浓度为2.5mg/mL蛋白质样品与3mL大豆油混合以制备水包油乳液,并使用均质器以10000r/min的速度均质1min。然后吸取30μL乳液加入至3mLSDS(0.1%,w/v)中,于500nm处测量吸光度。根据以下方程式计算EAI:

其中,T为2.303,A0稀释的乳液吸光度,D为稀释倍数(100),C蛋白溶液浓度(2.5mg/mL),?为油相体积分数(1/3)。
1.3.5 凝胶持水率
凝胶通过将葡萄糖酸内酯(GDL)粉末以0.2g/g蛋白质的比例添加到casein-HPI溶液(60mg/mL)中并于40℃孵育3h,将凝胶样品转移到4°C下稳定24h,直至实验。凝胶持水力测定参照Tang等人[16]的方法并进行了修改。凝胶样品以2000×g离心15min。根据以下方程式,通过凝胶中的水损失计算WHC:

其中,W1为凝胶离心前的质量,W2为凝胶离心后去除水分后的质量。
1.3.6 抗氧化保留率测定
复合物抗氧化性通过ABTS法测定,具体方法参照Jiang等人[17],其保留率为交联后与交联前复合物抗氧化能力比值。将7.4mmol/LABTS溶液加到2.6mmol/L过硫酸钾中,使用前室温下暗处静置至少12小时。然后将ABTS溶液用5mmol/LpH7.0的磷酸钠缓冲盐水溶液稀释,直至734nm下的吸光度达到0.7(±0.02)。测定时,将1mL蛋白样品加到2mL稀释的ABTS溶液中。室温下反应6min后,用酶标仪在734nm处测定样品的吸光值AS。以蒸馏水为空白对照测定吸光值AC。抗氧化性保留率计算公式如下:

其中,AS0表示未经TG酶交联的蛋白样品吸光值;AS表示经TG酶交联的蛋白样品吸光值;AC表示空白对照的吸光值。
1.3.7 体外消化率测定
参照He[18]的方法,通过体外消化过程中的氮释放分析,评估蛋白样品的体外消化率。为模仿人体内消化环境,整个过程在37℃水浴中进行。首先配置浓度为1%的蛋白悬浮液,并用2mol/L盐酸调节pH至2.0。随后向悬浮液加入胃蛋白酶(20mg/g蛋白),振荡孵育1h。用1mol/LNaOH调节悬浮液pH至7.5以终止胃消化阶段,后加入胰蛋白酶(20mg/g蛋白),振荡孵育2h。在体外消化1h、2h、3h时分别收集样品溶液,并用同体积15%三氯乙酸洗涤,随后在8000×g下离心15min收集上清液。通过凯氏定氮测定上清液的氮含量,根据以下公式计算样品体外消化率:
![]()
式中,N0为上清液N含量,N总为样品总氮含量
1.3.8 致敏性测定
参照Hu[19]的方法,用ELISA测定蛋白样品消化前后的致敏性。将样品稀释适当倍数,100μL稀释液加入到包被有特异性抗体的微孔板中,室温下(20-25℃)孵育10min,倒出孔中的液体,倒置微孔板并在吸水纸上拍打3次,加入250μL洗涤缓冲液洗涤,重复洗涤3次。加入酶标记的抗体,小心混匀,室温下孵育10min,倒出孔中的液体,并重复上述洗涤动作,后加入100μL底物,室温下暗处孵育10min,使底物与酶连接物结合。最后加入100μL反应终止液并充分混合,于450nm处测量吸光值。根据标准曲线,计算样品的抗原性。
1.3.9 微观结构检测
将蛋白样品喷金处理,随后用扫描电子显微镜在5kV电压条件下观察其微观结构。
1.4 数据处理
采用SPSS26.0完成均值和标准差的统计分析,使用Duncan多范围检验(P<0.05)进行单向方差分析。结果以平均值±标准差(`x±SD)表示,使用OriginPro 2018进行绘图。
2 结果与讨论
根据单因素实验结果,选择酶活(10,30,50U/g)、交联时间(1,2,3h)、casein/HPI比例(11:1,10:2,9:3)进行响应面试验。
2.1 响应面优化 casein-HPI 复合物制备
(1)Box-Behnken实验结果
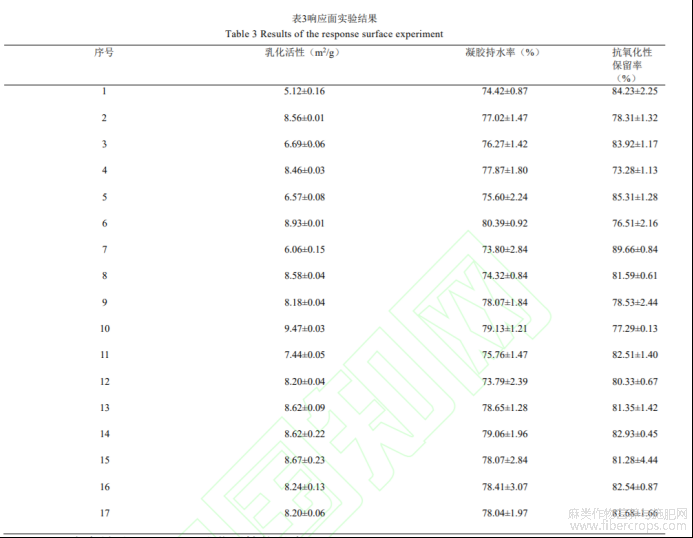
根据上述实验方案,在不同酶活、交联时间及casein/HPI质量比条件下制备casein-HPI复合物,并测定其乳化活性、凝胶持水率及抗氧化性保留率。实验结果如表3所示。
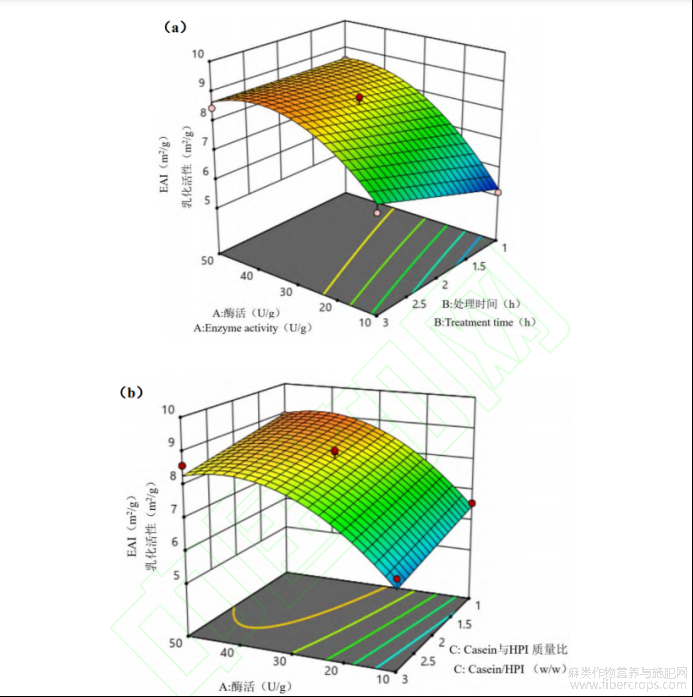
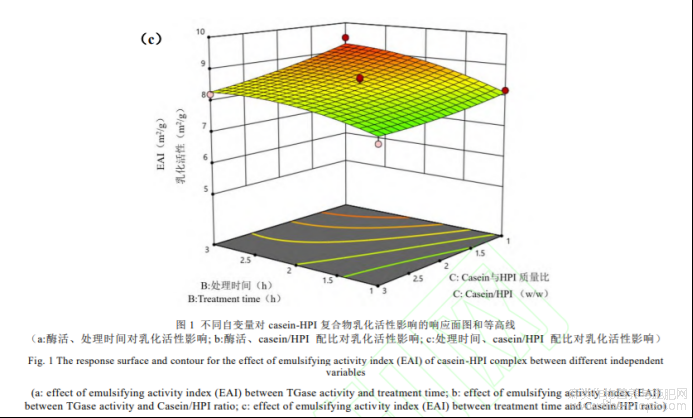
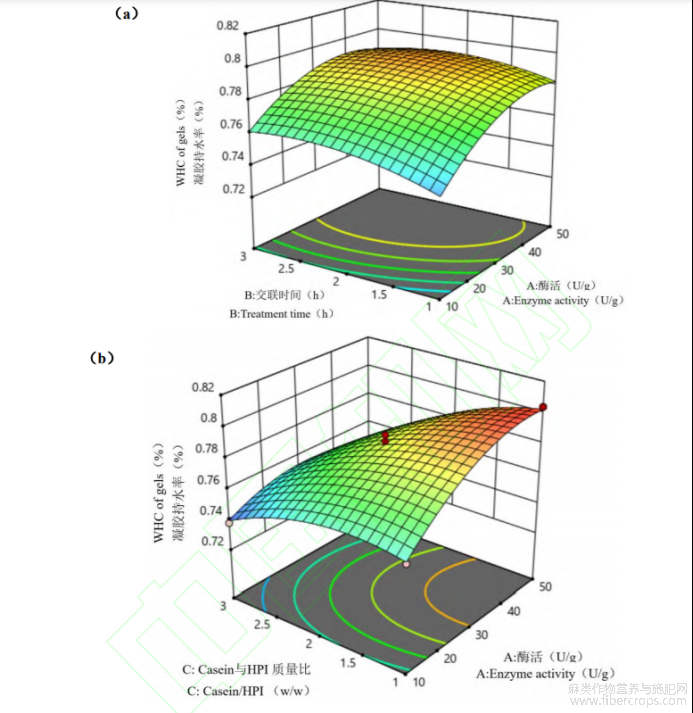
(2)自变量对casein-HPI乳化活性的影响
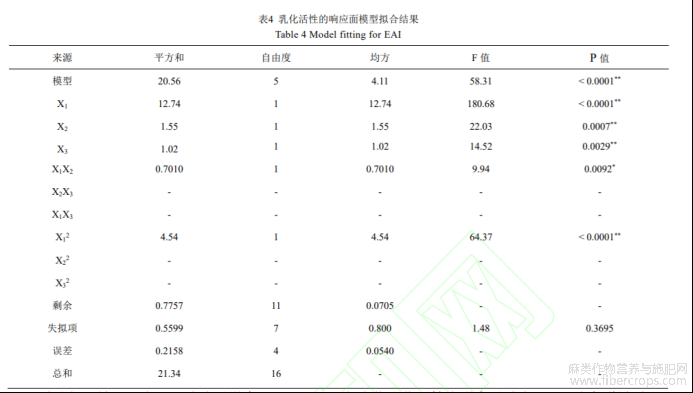
用Design-Expert软件对回归模型进行方差分析(ANOVA),表明了各个变量的重要性以及变量之间的相互作用,结果如表4所示。模型的F=58.31,P=0.0001<0.05,差异性显著,表明方程可能由于噪音干扰导致0.01%的概率与实际结果有差异。函数模型R2=0.964,说明模型预测值和试验值拟合度高,预测casein-HPI乳化活性最大值是可信的。回归方程的方差分析结果显示,一次项X1、X2、X3,交互项X1X2和二次项X12对乳化活性的影响显著。回归分析得到的回归方程为:
![]()
如图1所示,随TG酶酶活增大,casein-HPI复合物乳化活性先增大后减小,TG酶交联暴露出casein-HPI的疏水性基团,并在低酶活条件下达到亲水性和疏水性平衡。蛋白乳化活性在酶活较低条件下呈增大趋势,但酶活继续增大,过度交联导致其亲水和疏水相互作用被打破而使其乳化活性降低[20]。但此趋势在交联时间减小时发生改变,尤其1h时,随TG酶酶活增大乳化活性呈持续增大趋势,说明短时间交联条件下达到亲水性和疏水性平衡需要更大的TG酶酶活。另外,随交联时间增大,casein-HPI复合物乳化活性呈增大趋势,但该趋势随着酶活增大变得不显著。尤其当TG酶酶活为50U/g时,casein-HPI复合物的乳化活性随时间增大基本无显著变化。可能是因为在高酶活条件下交联反应达到饱和所需的时间更短。此外,由图1可知增大HPI在复合物中的配比会降低casein-HPI的乳化活性。
(3)自变量对casein-HPI复合物抗氧化性保留率的影响
如表5所示,模型的F=76.13,P=0.0001<0.05,差异性显著,这表明方程可能由于噪音干扰导致0.01%的概率与实际的结果有差异。函数模型R2=0.9786,说明模型预测值和试验值拟合度高,预测casein-HPI复合物抗氧化性保留率最大值可信。由回归方程的方差分析结果可以看出,一次项X1、X2、X3,交互项X1X2和二次项X12、X22对抗氧化性保留率的影响显著。回归分析得到的回归方程为:

如图2所示,随酶活增大,casein-HPI复合物的抗氧化性保留率呈下降趋势,表明交联处理对casein-HPI复合物的抗氧化性有抑制作用。根据预实验结果,酶活增大使得casein-HPI交联度增大,蛋白质的共价交联导致更多自由基清除活性位点被掩埋。但是,增大HPI在复合蛋白中的配比能有效提高casein-HPI的抗氧化性保留率,如图2b所示。结合预实验结果,添加HPI导致复合蛋白交联度降低,复合物聚集程度降低,有效抑制了抗氧化基团的掩埋,从而使得蛋白质抗氧化性保留率提高。
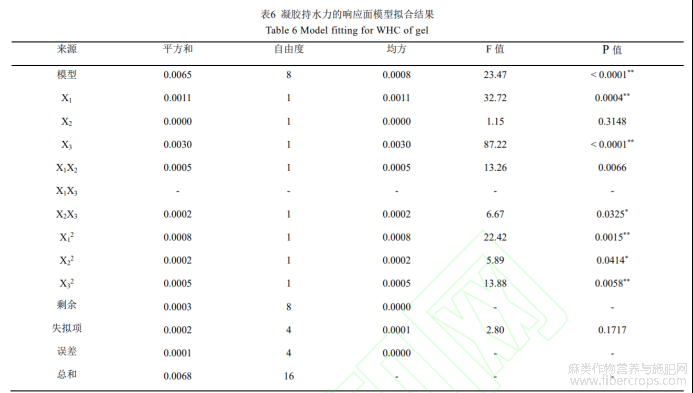
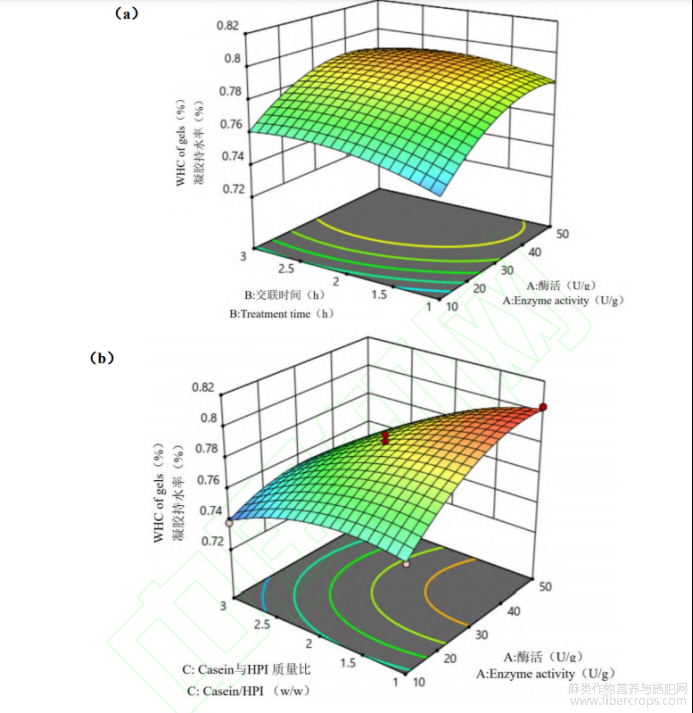
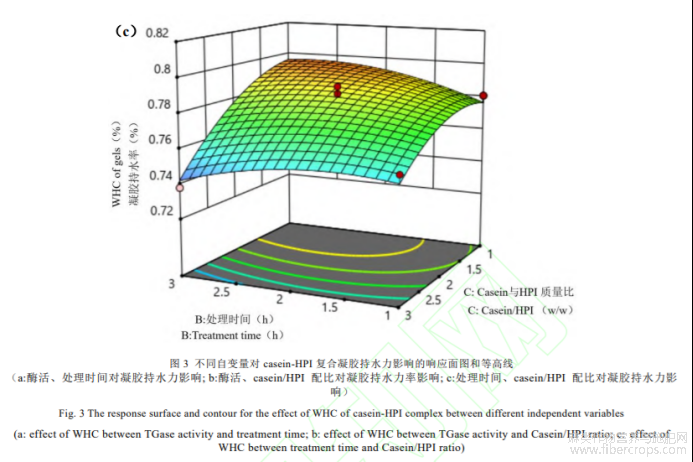
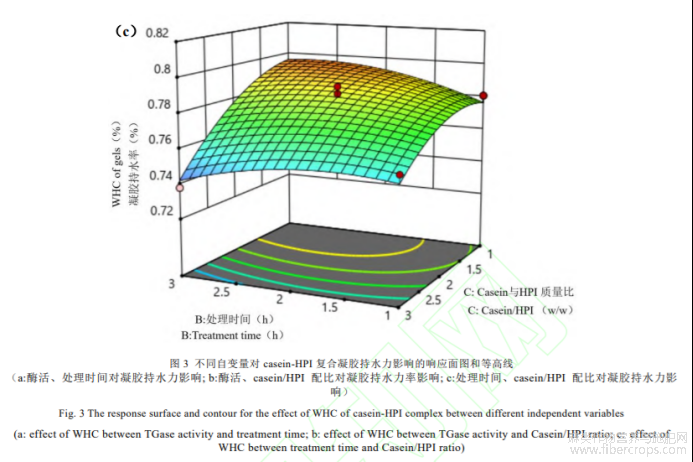
(4)自变量对casein-HPI凝胶持水力的影响
如表6所示,回归模型方差分析(ANOVA)F=23.47,P=0.0001<0.05,差异性显著,表明方程可能由于噪音干扰导致0.01%的概率与实际结果有差异。函数模型R2=0.9591,说明模型预测值和试验值拟合度高,预测casein-HPI凝胶持水力最大值可信。由回归方程的方差分析结果可以看出,一次项X1、X3,交互项X1X2、X2X3和二次项X12、X22、X32对凝胶持水力的影响显著。回归分析得到的回归方程为:
![]()
如图3所示,Casein-HPI凝胶持水力随TG酶酶活和交联时间增大先上升后下降。TG酶交联能诱导蛋白凝胶形成致密的蛋白网络结构,有利于凝胶中保留更多水分。这使得在酶活和交联时间增大的初始阶段casein-HPI复合物凝胶的持水力提升。而继续增大酶活或延长交联时间,过度交联导致casein-HPI与水分子的结合位点减少凝胶持水力下降[21]。如图3c所示,随着复合物中HPI配比增大,casein-HPI复合物凝胶的持水力显著降低,是因为HPI导致复合蛋白的交联度降低,形成更为疏松的网络结构进而使得持水能力降低。HPI含量增大导致凝胶持水力下降的趋势在高酶活条件下尤为明显,证实HPI在高酶活条件下对复合物的交联存在更强的抑制能力。
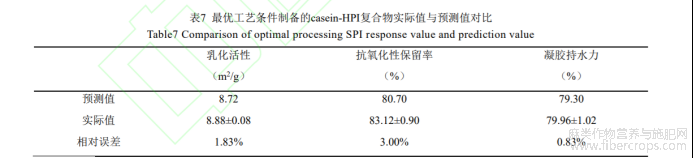
(5)最优交联工艺验证
将乳化活性、抗氧化性保留率、凝胶持水力的权重设为1:1:1,经RSM预测,casein-HPI最优交联条件为TG酶酶活为31.90,交联时间为2.06h,casein/HPI质量比为10.51:1.49。按最优工艺制备casein-HPI复合物,对比实际值与预测值,结果如表7所示,各预测值的相对偏差均小于5%,可见响应面法优化得到的最优工艺可靠。
2.2 体外消化率
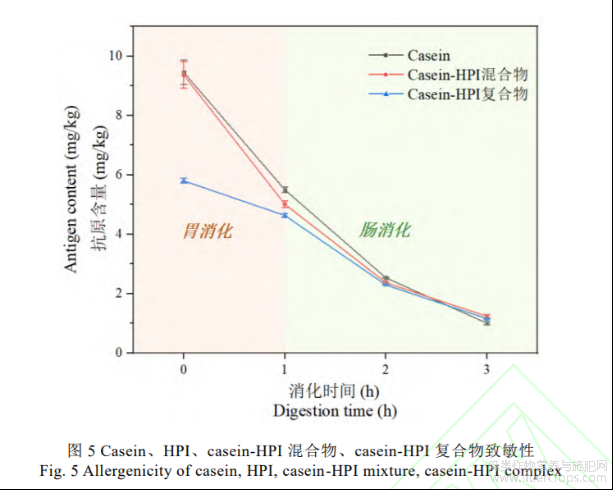
蛋白质体外消化率揭示了蛋白质被消化酶水解的能力,直接影响消化后氨基酸和肽的吸收,因此可预示待测物品营养价值及在食品领域是否具有广泛应用潜力[22]。图4显示了casein、HPI、casein-HPI混合物以及最优工艺下制备的casein-HPI复合物体外消化过程中的氮释放曲线。四种蛋白样品显示出相似的氮释放特性,其消化过程主要集中于胃消化阶段(0-1h)和肠道消化前半阶段(1-2h)。而在消化的2-3h阶段内,所有蛋白样品的氮释放曲线逐渐趋于平稳。He[18]也报道了相似的结论,他发现大米谷蛋白的体外消化过程中肠道消化的后半阶段氮释放变得缓慢。在胃消化阶段中,casein、HPI及casein-HPI混合物显示出较相似的消化特性。胃消化阶段结束后,上述三种蛋白的消化率呈casein>casein-HPI混合物>HPI的规律。但交联后的casein-HPI复合物在胃消化1h后消化率显著降低。赖氨酸作为胃蛋白酶酶切位点之一,在TG酶诱导下与谷氨酰胺残基共价交联形成异肽键,从而抑制胃蛋白酶的水解作用[23]。Romano[24]研究了TG酶对豆粉蛋白体外消化率的影响,发现TG酶诱导豆粉蛋白形成致密的网络结构而降低了其在胃消化阶段的消化率。
进入肠道消化阶段后,四种蛋白氮释放量持续增加证实胰蛋白酶的水解作用。在肠道消化阶段,casein、casein-HPI混合物以及casein-HPI复合物的氮释放增加了3至4倍,而HPI显示出最平缓的释放曲线,其氮释放量仅增大一倍左右,最终消化率仅有50%左右,表明HPI含有较少的胰蛋白酶酶切位点。据报道[22,25],HPI的体外消化率可达70%-80%,显著高于本文的HPI消化率。一方面是因为体外消化阶段的时长不同,另一方面可能是因为文中的HPI是由未脱壳的汉麻籽制备,壳中的酚类物质与蛋白形成多酚-蛋白质复合体从而导致消化率降低[25]。体外消化中,casein消化率最高,casein-HPI混合物介于casein和HPI之间。与上述胃消化阶段相似,TG酶交联显著降低了casein-HPI复合物的体外消化率,归因于TG酶诱导更大分子量的抗消化共聚物的形成。但是,casein-HPI复合物消化率的降低有利于增强饱腹感,并且在胃肠道特异性药物递送方面具有应用潜力[18]。
2.3 致敏性测试
检测了蛋白质消化前后的抗原含量以表征蛋白质的致敏性。如图5所示,casein、casein-HPI混合物在体外消化前致敏性没有明显差异。TG酶交联显著降低了混合物体外消化前的致敏性。这是因为TG酶能催化赖氨酸残基和谷氨酰胺残基生成异肽共价键,最终形成呈多分支结构的共聚物。当有足够多的交联位点参与交联时,TG酶诱导的多分支结构可能会掩盖潜在的IgE结合位点,进而降低蛋白质致敏性[26]。Li[26]也曾证明TG酶交联降低蛋白致敏性的潜力,他发现casein、乳清蛋白、大豆蛋白通过TG酶交联能有效降低其致敏性。
消化作用显著降低了蛋白的致敏性,归因于消化酶的水解作用破坏了IgE结合位点[27]。消化结束后,casein、casein-HPI混合物,casein-HPI复合物显示出相似的致敏性。表明仍有未被消化酶水解的过敏原表位,这也证实了TG酶交联只能降低消化前或轻度水解时的致敏性,其交联作用并未破坏蛋白的IgE结合位点,而是通过聚合作用掩埋其过敏原表位。因此随着消化的进行尤其是后期阶段,casein-HPI致敏性的降低主要是由于蛋白酶对过敏原表位的破坏作用而与TG酶无关。
2.4 微观结构
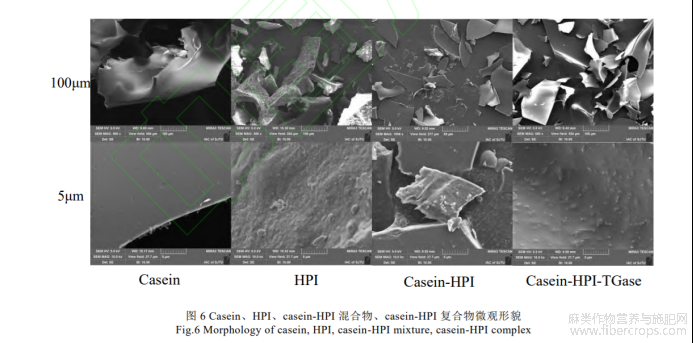
通过扫描电子显微镜观察进一步表征蛋白质交联前后的微观结构。如图6所示,casein呈现表面光滑的片状微观结构。而HPI的表面相对粗糙,可能是碱溶酸沉法提取HPI过程中蛋白质有轻微变性。交联后的casein-HPI显示出不同于其他三种蛋白的微观结构,表面出现明显的颗粒状突起。证明TG酶交联显著改变了复合蛋白的微观形貌,主要是因为TG酶对复合蛋白的结构修饰。Yang等人[28]也发现卵黄高磷蛋白与面筋蛋白通过TG酶交联后其微观结构从蜂窝状空腔结构逐渐向致密、光滑的结构转化。
3 结论
1)以乳化活性、凝胶持水力和抗氧化性保留率作为响应指标,TG酶酶活、处理时间和casein/HPI质量比为自变量,采用响应面法优化了casein-HPI制备条件。三个响应值模型拟合方程的R2的值均超过0.9,p值也适合该实验,失拟项均不显著,证实了模型的有效性。通过响应面法拟合后得出的最优工艺条件为:TG酶酶活31.90U/g,交联时间2.06h,casein/HPI质量比10.51:1.49。
2)在最优工艺下制备的casein-HPI复合物与未交联蛋白相比具有更强的抗酶解能力。casein通过TG酶与HPI交联在消化前或轻度水解阶段致敏性显著降低了,但在消化末期复合物致敏性和未交联蛋白没有显著区别。同时,交联改变了混合蛋白的微观形貌,源于TG酶对蛋白质结构的修饰。
3)本文通过TG酶强化casein和HPI的相互作用以实现HPI部分替代casein的同时,能有效缓解HPI对复合蛋白的不利影响,进而促进HPI在食品工业中的广泛应用。
参考文献
[1] 汝成业. 酶法降低牛乳 αs1-酪蛋白致敏性[D]. 江南大学, 2015.
Ru C Y. Enzymatic Hydrolysis of Milk αs1- Casein for Allergenicity Reduction [D]. Jiangnan University, 2015.
[2] 丛艳君, 刘家琦, 于晓凤. 基于 BALB/C 小鼠模型评价牛乳αs1-酪蛋白的致敏特性[J]. 中国食品学报, 2020, 20(3):21- 30.
Cong Y J, Liu J Q, Yu X F, et al. Allergic Mechanism of αs1-casein in Cow Milk Based on BALB/C Mice Model [J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(3):21-30.
[3] 丛艳君, 吕晓哲, 李晔. 牛乳 αS 1 -酪蛋白与大豆蛋白交叉过敏原的识别鉴定[J].食品科学, 2019, 40(18):70-75.
Cong Y J, LÜ X Z, Li Y, et al. Identification and Characterization of Cross-Reactive Allergens between CowMilk αS 1 -Casein and Soybean Proteins [J]. Food Science, 2019, 40(18): 70-75.
[4] 任大喜, 王德国, 郭鸰. 胰蛋白酶水解降低乳蛋白过敏的研究 [J]. 中国食品学报, 2009, 9(5):49-54.
Ren D X, Wang D G, Guo L, et al. The Study of Trypsin Hydrolysis to Reduce Milk Protein Allergy[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(5):49-54.
[5] 付莉, 岳喜庆, 宋建新. 复合酶降低牛乳蛋白致敏性的研究[J]. 中国乳品工业, 2013, 41(5):22-25.
Fu L, Yue X Q, Song J X. Research on reducing milk protein allergenicity by mixed enzyme [J]. China Dairy Industry, 2013, 41(5):22- 25.
[6] Aluko R. Hemp seed (Cannabis sativa L.) proteins: composition, structure, enzymatic modification, and functional or bioactive properties [M]. Sustainable protein sources. Elsevier. 2017: 121-132.
[7] Hadna?ev M, Dap?evi?-Hadna?ev T, Lazaridou A, et al. Hempseed meal protein isolates prepared by different isolation techniques. Part I. physicochemical properties [J]. Food Hydrocolloids, 2018, 79: 526-533.
[8] Shen P, Gao Z, Xu M, et al. Physicochemical and structural properties of proteins extracted from dehulled industrial hempseeds: Role of defatting process and precipitation pH [J]. Food Hydrocolloids, 2020, 108: 106065.
[9] Decuyper I, Van Gasse A, Cop N, et al. Cannabis sativa allergy: looking through the fog [J]. Allergy, 2017, 72(2): 201 -6.
[10] Alves A C, Tavares G M. Mixing animal and plant proteins: Is this a way to improve protein techno-functionalities? [J]. Food Hydrocolloids, 2019, 97: 105171.
[11] Wang Q, Jiang J, Xiong Y L. High pressure homogenization combined with pH shift treatment: A process to produce physically an d oxidatively stable hemp milk [J]. Food Research International, 2018, 106: 487 -494.
[12] Gaspar A L C, de Góes-Favoni S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins: A review [J]. Food Chemistry, 2015, 171: 315-322.
[13] Alavi F, Emam-Djomeh Z, Chen L. Acid-induced gelation of thermal co-aggregates from egg white and hempseed protein: impact of microbial transglutaminase on mechanical and microstructural properties of gels [J]. Food Hydrocolloids, 2020, 107: 105960.
[14] Yang L, Jia J, Zhou X, et al. Phosvitin-wheat gluten complex catalyzed by transglutaminase in the presence of Na2SO3: Formation, crosslink behavior and emulsifying properties [J]. Food Chemistry, 2021, 346: 128903.
[15] Jiang Y, Zhou X, Zheng Y, et al. Impact of ultrasonication/shear emulsifying/microwave-assisted enzymatic extraction on rheological, structural, and functional properties of Akebia trifoliata (Thunb.) Koidz. seed protein isolates [J]. Food Hydrocolloids, 202 1, 112: 106355.
[16] Tang C-h, Yang M, Liu F, et al. Stirring greatly improves transglutaminase-induced gelation of soy protein-stabilized emulsions [J]. LwtFood Science and Technology, 2013, 51(1): 120-128.
[17] Jiang Y, Yin H, Zhou X, et al. Antimicrobial, antioxidant and physical properties of chitosan film containing Akebia trifoliata (Thunb.) Koidz. peel extract/montmorillonite and its application [J]. Food Chemistry, 2021, 361: 130111.
[18] He C, Hu Y, Woo M W, et al. Effect of microbial transglutaminase on the structural and rheological characteristics and in vitro digestion of rice glutelin–casein blends [J]. Food Research International, 2021, 139: 109832.
[19] Hu G, Zheng Y, Liu Z, et al. Effects of high hydrostatic pressure, ultraviolet light-C, and far-infrared treatments on the digestibility, antioxidant and antihypertensive activity of α-casein [J]. Food Chemistry, 2017, 221: 1860-1866.
[20] Liu C, Damodaran S, Heinonen M. Effects of microbial transglutaminase treatment on physiochemical properties and emulsifying functionality of faba bean protein isolate [J]. LWT, 2019, 99: 396-403.
[21] Zhang M, Yang Y, Acevedo N C. Effects of pre-heating soybean protein isolate and transglutaminase treatments on the properties of egg - soybean protein isolate composite gels [J]. Food Chemistry, 2020, 318: 126421.
[22] Lin Y, Pangloli P, Dia V P. Physicochemical, functional and bioactive properties of hempseed (Cannabis sativa L.) meal, a co -product of hempseed oil and protein production, as affected by drying process [J]. Food Chemistry, 2021, 350: 129188.
[23] Glusac J, Isaschar-Ovdat S, Fishman A. Transglutaminase modifies the physical stability and digestibility of chickpea protein -stabilized oilin-water emulsions [J]. Food Chemistry, 2020, 315: 126301.
[24] Romano A, Giosafatto C V L, Di Pierro P, et al. Impact of transglutaminase treatment on properties and in vitro digestibility of white bean (Phaseolus vulgaris L.) flour [J]. Food Research International, 2016, 88: 239 -246.
[25] 伍圣文, 贾成刚, 崔春. 脱壳处理对火麻蛋白提取, 功能特性和消化性的影响 [J]. 食品科学技术学报, 2021, 39(4): 87-94. Wu S W, Jia C G, Cui C. Effects of Hulling Treatment on Extraction, Functional Properties and Digestibility of Hemp Protein [J]. Journal of Food Science and Technology, 2021, 39(4): 87-94.
[26] Li Y, Damodaran S. In vitro digestibility and IgE reactivity of enzymatically cross-linked heterologous protein polymers [J]. Food Chemistry, 2017, 221: 1151-1157.
[27] 张微, 张索坤, 王希彪. 蛋白酶水解降低牛乳酪蛋白抗原性的研究 [J]. 黑龙江畜牧兽医, 2014, (8): 112-115. Zhang W, Zhang S K, Wang X B. Research on reducing antigenicity of casein by Protease hydrolysis [J]. Heilongjiang Animal Science and Veterinary Medicine, 2014, (8): 112-115.
[28] Yang L, Jia J, Zhou X, et al. Phosvitin-wheat gluten complex catalyzed by transglutaminase in the presence of Na 2 SO3 : Formation, crosslink behavior and emulsifying properties [J]. Food Chemistry, 2021, 346: 128903.
文章摘自:王丹凤,薛舒苑,周学府等.酪蛋白-汉麻籽蛋白复合物制备工艺及其消化性和致敏性研究[J/OL].中国食品学报:1-18[2023-07-31].http://kns.cnki.net/kcms/detail/11.4528.TS.20230529.1844.011.html