摘 要:本研究以汉麻分离蛋白(Hemp Protein Isolate,HPI)为原料,通过超高压辅助酶解反应对HPI进行改性,以溶解度和水解度为判定指标筛选酶解改性反应最佳条件,并探究超高压辅助酶解反应对酶解产物溶解性、起泡性、乳化性、持水性、持油性的影响。结果表明,HPI酶解反应最适条件为:加酶量(复合蛋白酶)5000U/g、酶解改性pH8.0、酶解改性温度55℃、酶解改性时间50min。以HPI为对照,当压力为200MPa时,酶解产物的溶解度、起泡性、乳化性、持油性最高,压力为100MPa时,泡沫稳定性最好,酶解后的乳化稳定性存在不同程度的下降,压力为0.1MPa时其持水性达到最大值。综上所述,超高压技术能够有效促进HPI的酶解改性反应,且压力为200MPa时,酶解产物的理化性质最好。
关键词:汉麻分离蛋白(HPI),超高压(UHP),酶解,理化性质
汉麻(Cannabis sativa L.),又名火麻、大麻等,在我国是一种传统的药食同源桑科植物,由汉麻叶、籽、茎秆等部分组成[1],汉麻籽中富含的汉麻分离蛋白(hemp protein isolate,HPI)氨基酸种类及含量丰富,消化率高且致敏性低,具有增强免疫力、抗疲劳、降血糖、维持肠道菌群平衡等作用,是一种极具价值的多功效植物蛋白资源[2,3]。但汉麻蛋白质溶解度较低,功能性质较差[9],导致其难以作为原辅料应用于食品及营养保健品生产中,因此,有必要通过某些技术手段改善其功能特性以更好的开发利用汉麻蛋白,提升其市场竞争力。
目前,常用的蛋白质改性技术有物理改性技术、化学改性技术、酶解改性技术等,其中物理改性技术如热处理易产生热聚集使蛋白质的利用率降低,化学改性技术会使得酸碱试剂有残留,降低蛋白营养价值,不利于消化吸收。酶解改性技术主要是指利用蛋白酶在适宜条件下水解蛋白质使肽键断裂,导致可电离基团数量增加、被掩盖的疏水片段暴露,从而改善蛋白质的功能性质[4]。酶解反应过程十分温和、副产物较少且无毒、蛋白质营养价值破坏程度小,改性后蛋白质与原始蛋白质相比,具有更低的分子量和更好的功能特性。此外,酶解之后产生的多肽还具有一定的生物活性,如降血压、降血糖、抗氧化活性等,因此酶解改性是改善蛋白质功能特性的首选方法[5,6]。但酶解改性同时也存在酶解过程随机、酶利用率低和酶解效率低等问题[10]。故有必要寻找能够解决酶解反应上述问题的技术方法,从而扩大酶解改性技术的应用范围。
超高压技术(Ultra-High Pressure processing,UHP)是指将待处理物品置于高压腔体中,在一定温度和时间范围内,以水为介质传递压力进行高压(100-1000MPa)处理,使食品中蛋白质、多糖等大分子物质变性或微生物灭活,以达到改变理化和功能特性、灭菌保藏、延长产品保存期等目的[7,8]。故超高压技术可促进蛋白质结构的改变和酶解作用的发生,从而达到改善蛋白质功能性质、提高酶解效率的目的[11]。关海宁[12]等人利用超高压协同酶法制备不同分子量大豆分离蛋白水解肽,其乳化性及抗氧化性均得到显著提高。
本研究以汉麻分离蛋白酶解改性为支撑点,辅助以超高压技术,着重研究汉麻分离蛋白高效的改性措施,旨在获得更加优质的汉麻蛋白质产品,为汉麻蛋白产品的深度研发与应用提供相关的理论指导和技术支持,对植物蛋白质资源的高值化利用具有深远意义。
1 材料与方法
1.1 材料与仪器
汉麻分离蛋白(96%)食品级黑龙江省大庆市星火牧场;复合蛋白酶(100000U/g杆菌蛋白酶复合体,主酶是碱性蛋白酶)试剂级北京Solarbio科技有限公司;碱性蛋白酶(200000U/g)试剂级北京Solarbio科技有限公司;木瓜蛋白酶(100000U/g)试剂级北京Solarbio科技有限公司;中性蛋白酶(200000U/g)试剂级北京Solarbio科技有限公司;胰蛋白酶(250NFU/mg)试剂级北京Solarbio科技有限公司;氢氧化钠分析纯天津凯通化学试剂有限公司;盐酸分析纯天津凯通化学试剂有限公司;甲醛溶液分析纯宝鸡正源化工科技股份有限公司;大豆油食品级九三粮油工业集团有限公司。
HHP-400超高压设备沈阳人和机电工程设备有限公司;HH-4型数显恒温水浴锅金坛市双捷实验仪器厂;Sartorius BSA223S型电子天平赛多利斯科学仪器(北京)有限公司;PHS-3C型pH计梅特勒-托利多仪器有限公司;DF-1集热式磁力搅拌器金坛市双捷实验仪器厂;T50高速剪切机德国IKA公司;721型分光光度计上海元析仪器有限公司;UVS-4型漩涡振荡仪济南千司生物技术有限公司;FD5-3型冷冻干燥机美国SIM公司。
1.2 实验方法
1.2.1 汉麻分离蛋白酶解改性工艺
配制50g/L的汉麻蛋白溶液,用1mol/L NaOH溶液调节溶液pH至最适值。随后加入蛋白酶与上述溶液混匀,将此蛋白溶液密封在聚氯乙烯袋中,放入HHP-400超高压设备中于不同压力(0.1~300MPa)下,在设定温度中进行酶解改性反应单因素试验,以溶解度及水解度为判定指标,筛选出最适酶解反应条件。水解物经FD5-3型冷冻干燥机进行冻干得到蛋白样品。
1.2.2 酶解反应条件筛选单因素试验
1.2.2.1 蛋白酶选择
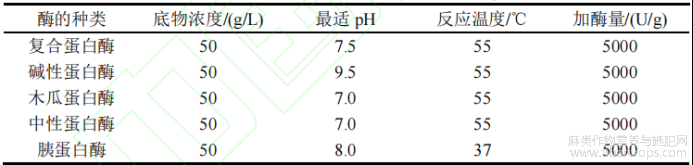
选用以下五种蛋白酶分别在各自最适条件下对汉麻分离蛋白进行酶解改性40min,反应完成后灭酶处理(85℃水浴30min),测定其水解度及溶解度以筛选酶解改性反应最佳酶制剂。
表1 不同蛋白酶的酶解条件
1.2.2.2加酶量确定
固定改性pH7.5,改性温度55℃,改性时间40min,在不同压力(0.1~300MPa)下酶解,探究不同加酶量(2000、3000、4000、5000、6000U/g)对溶解度及水解度的影响。
1.2.2.3酶解改性pH确定
固定改性温度55℃,改性时间40min,加酶量5000U/g,在不同压力(0.1~300MPa)下酶解,探究不同改性pH(6.5、7.0、7.5、8.0、8.5)对溶解度及水解度的影响。
1.2.2.4酶解改性温度确定
固定改性pH8.0,改性时间40min,加酶量5000U/g,在不同压力(0.1~300MPa)下酶解,探究不同改性温度(45、50、55、60、65℃)对溶解度及水解度的影响。
1.2.2.5酶解改性时间确定
固定改性pH8.0,改性温度55℃,加酶量5000U/g,在不同压力(0.1~300MPa)下酶解,探究不同改性时间(20、30、40、50、60min)对溶解度及水解度的影响。
1.2.3水解度测定
参考文献[13]方法,略有改动。取5mL汉麻分离蛋白水解液与60mL蒸馏水于烧杯中混合均匀,用0.05mol/L NaOH标液滴定至pH为8.2;加入10mL中性甲醛溶液与上述溶液混匀,再用0.05mol/L NaOH标液滴至pH9.2,记录消耗NaOH的量。将蛋白质水解液换成等量蒸馏水作为空白试验,总氮含量测定参考文献[13]。氨基氮含量及水解度含量计算公式如下:
![]()
式中:X表示氨基氮含量,g/mL;V1表示酶解液加甲醛溶液后滴至pH9.2时NaOH消耗量,mL;Vo表示空白加甲醛溶液后滴至pH9.2时NaOH消耗量,mL;V表示取样体积,mL;C表示NaOH标液摩尔浓度,mol/L;0.014表示与1mL NaOH标定溶液[CNaOH=1mol/L]相当的氮的质量,g;X1表示总氮含量,g/mL。
1.2.4溶解度测定
参考文献[14]方法,略有改动。称取0.5g经冷冻干燥的蛋白质样品于烧杯中,加入50mL蒸馏水,利用0.5mol/L NaOH溶液和0.5mol/LHCI溶液调节溶液pH为2.0-10.0,25℃恒温搅拌30min,移入离心管中,4000r/min离心10min后收集上清液,利用考马斯亮蓝法测定上清液中蛋白质含量,总蛋白含量通过凯氏定氮法测定。通过以下公式计算溶解度:
![]()
式中:X表示上清液蛋白质量,g/mL;X1表示样品中总蛋白质量,g/mL。
1.2.5 起泡性及泡沫稳定性测定
蛋白起泡性(FAI)及泡沫稳定性(FSI)测定参考Agyare[15]的方法,并根据实际情况进行适当调整。称取1g冻干蛋白质样品置于离心管中,加入50mL蒸馏水,记总体积为V0,然后使用高速剪切机10000r/min均质2min,迅速倒入带有刻度的量筒中,量取总体积记为V1,均质停止30min后再次量取总体积,记为V2。利用下列公式计算起泡性及泡沫稳定性:
![]()
式中:V0表示起始溶液在量筒中的高度,mL;V1表示经高速均质后液体总高度,mL;V2表示高速均质停止30min后液体总高度,mL。
1.2.6乳化性及乳化稳定性测定
蛋白乳化性(EAI)及乳化稳定性(ESI)测定参考Pearce等人[16]的方法,并根据实际情况进行适当调整。配制1%的蛋白质样品溶液与食用大豆油以3:1的比例混匀,使用高速剪切机10000r/min均质2min形成均匀乳状液,立即吸取100μL,加入5mL 0.1%SDS溶液,500nm处测定吸光值记为A0,静置10min后同样测定吸光值记为A10。利用下列公式计算乳化性及乳化稳定性:
![]()
式中:T表示浑浊度,2.303;C表示蛋白质溶液原始浓度,g/mL;Ø表示溶液中油的体积分数(0.25);N表示稀释倍数;A0表示0min时的吸光值。
![]()
式中:A0表示0min时的吸光值;A10表示10min时的吸光值。
1.2.7 持水性测定
蛋白质持水性测定参考Wang等人[17]的方法,并根据实际情况进行适当调整。称1g冻干蛋白质样品于离心管中,加入30mL蒸馏水于漩涡振荡仪上振匀,静置20min后,25℃下离心(6000r/min)10min,对沉淀样品称重,利用下列公式计算持水性:
![]()
式中:W1表示离心后残留物质量,g;W0表示样品质量,g。
1.2.8 持油性测定
蛋白持油性测定参考Chen等人[18]的方法,并根据实际情况进行适当调整。称1g冻干蛋白质样品于离心管中,加入10mL大豆油,于漩涡振荡仪上振匀,25℃下离心(6000r/min)10min,对沉淀样品称重,利用下列公式计算持油性:
![]()
式中:M1表示离心后残留物质量,g;M0表示样品质量,g。
1.3数据处理
采用IBM SPSSS tatistics26进行显著性分析(P<0.05);利用Statistic8、Origin 2019 Pro软件对数据进行分析及绘图,所有实验组均进行三次平行实验。
2 结果与分析
2.1 汉麻分离蛋白超高压辅助酶解反应最适条件研究
2.1.1 蛋白酶选择
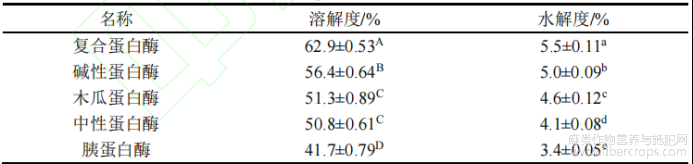
本实验选择复合蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶及胰蛋白酶对汉麻分离蛋白在各自最适酶解pH和温度下进行酶解反应,以溶解度及水解度为判定标准,筛选最佳酶制剂,其结果如下表2所示。
表2 不同蛋白酶对HPI改性效果影响
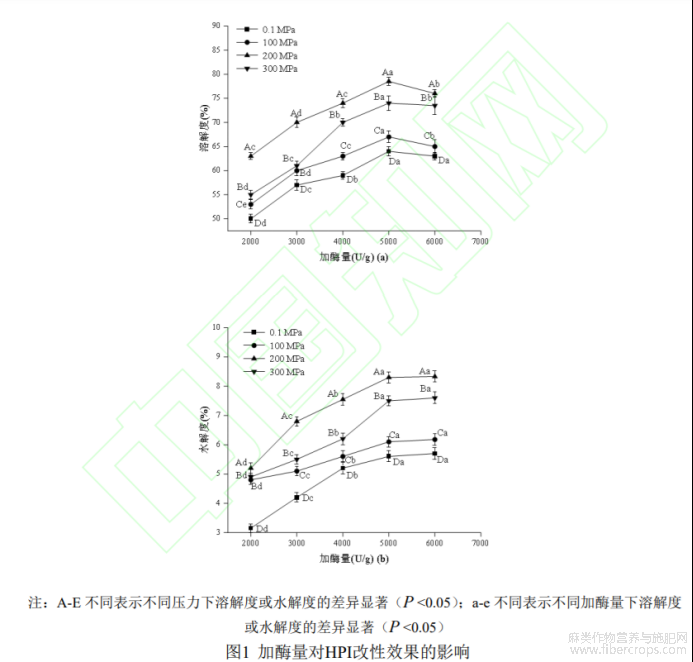
2.1.2加酶量确定
不同加酶量在不同压力下对HPI溶解度的影响如图1(a)所示,由图可知,随着复合蛋白酶用量增加,HPI水解产物溶解度逐渐增大,当加酶量超过5000U/g时,溶解度稍有下降,可能是随着酶量增加,酶与底物结合更加充分,水解反应逐渐增强,表现为溶解度的上升,而继续增加酶量时,酶与蛋白质作用会产生一部分疏水性多肽,而溶解度的下降可能是疏水性多肽的形成引起的[20]。当压力达到100、200或300MPa时,酶解产物溶解度在不同加酶量下均高于0.1MPa,在200MPa时具有最大值,可推测出HPI酶解反应在压力超过200MPa时受到抑制,是因为适当的超高压处理使蛋白质构象发生变化,结构变得伸展、暴露更多酶切位点,促进酶解反应进行,使可溶性蛋白含量增多,而当压力到达300MPa时,过高的压力使蛋白质分子间发生了聚集或者酶活性降低,抑制了酶解反应[21],导致溶解度下降。
不同加酶量在不同压力下对HPI水解度的影响如图1(b)所示,由图可知,HPI水解产物水解度随酶量增加先明显上升后缓慢上升,说明酶用量增加可以增大酶解程度[22],但在这个过程中,蛋白酶逐渐趋向饱和,因此水解度随后上升缓慢。与溶解度变化趋势一致,水解度在200MPa时达到最大值。综上,选择5000U/g为HPI酶解改性反应最适加酶量。
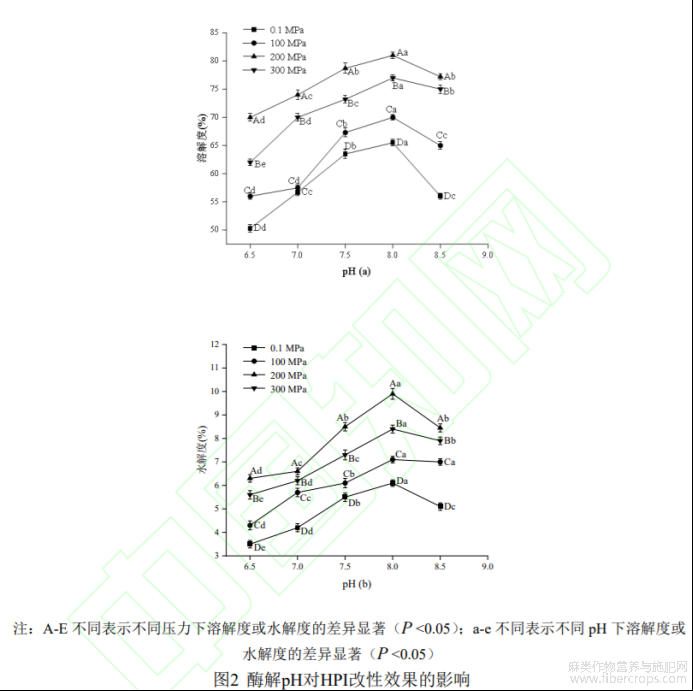
2.1.3 酶解反应 pH 确定
不同酶解反应pH在不同压力下对HPI溶解度的影响如图2(a)所示,随着pH的增加,不同压力下HPI水解物溶解度均呈现先上升后下降的趋势,在pH为8.0时溶解度达到最大,原因可能与复合蛋白酶酶解最佳酸碱环境有关,当pH过大或过小时,会引起酶构象的改变且影响酶分子活性部分上有关基团的解离,导致蛋白酶活性减弱,不利于酶作用于底物使可溶性蛋白质产生[23]。压力影响方面,不同pH下溶解度均在200MPa时达到最大值。
不同酶解反应pH在不同压力下对HPI水解度的影响如图2(b)所示,当压力为200MPa时蛋白质水解度达到最大,显著高于其他压力条件下的水解度(P<0.05),主要是由于超高压处理可促进酶解反应进行,有效提高水解效率,而压力过大则会减弱酶活性以及对酶解反应起到抑制作用[24],从而使水解度有所降低。当pH为8.0时,在不同压力作用下水解度均达到最大值。综上,选择pH8.0为HPI酶解改性反应最佳pH值。
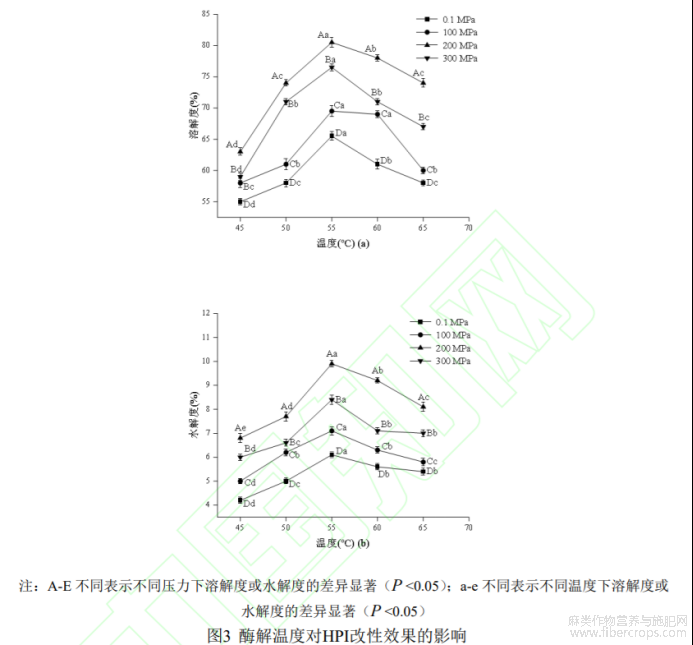
2.1.4 酶解反应温度的确定
不同酶解反应温度在不同压力下对HPI溶解度的影响如图3(a)所示,由图可知,不同温度下,HPI溶解度均在200MPa时达到最大值,较高的压力反而对酶解反应有抑制作用。随着温度的增加酶解产物溶解度逐渐增大,在55℃时达到最大值,当继续升温时,溶解度则有所下降。原因是在温度较低情况下,复合蛋白酶活性较弱,未能与底物充分作用,不利于可溶性蛋白产生,当体系温度逐渐升高至接近蛋白酶最适温度时,酶活性增强,有利于酶解反应进行[25],因此HPI溶解度增加,而温度过高,则会影响酶分子构象,使得酶活性降低,不利于酶促反应发生,导致溶解度下降。
不同酶解反应温度在不同压力下对HPI水解度的影响如图3(b)所示,水解度随温度的升高先升后降,55℃时达到最大。不同温度下HPI水解度均在200MPa时具有最大值,这与关海宁[12]的研究结果相似,压力的存在可显著促进蛋白酶对蛋白质的水解作用,而当压力超过一定的范围,则会抑制酶解反应进行。综上,选择55℃为HPI酶解改性反应最适温度。
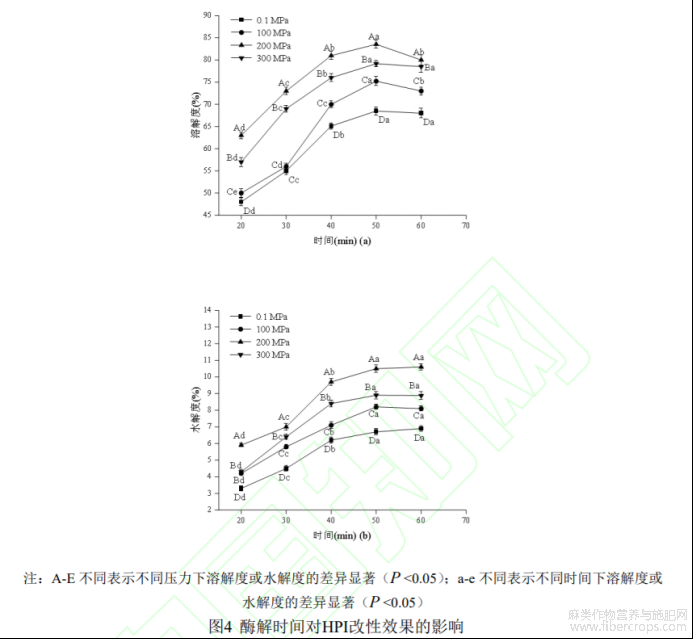
2.1.5酶解反应时间的确定
不同酶解反应时间在不同压力下对HPI溶解度的影响如图4(a)所示,由图可知,HPI在超高压处理下(100-300MPa)的溶解度均高于0.1MPa处理,200MPa压力处理下HPI溶解度最大。在20-50min时间范围内,酶解产物溶解度逐渐增大,50min之后有所下降,但下降幅度较小,这说复合蛋白酶水解HPI在一定时间段内可起到增溶效果,时间继续延长时,酶限制性水解蛋白达到了一定的平衡度,再继续水解时产生了不溶性肽,导致产物溶解度降低[26]。
不同酶解反应时间在不同压力下对HPI水解度的影响如图4(b)所示,随着时间延长,HPI水解度先明显上升而后逐渐平稳,可能的原因是随着时间的增加,底物与蛋白酶结合达到饱和,也可能是酶解产物的产生抑制了酶解反应进行[27],因此50min后水解度变化不明显。不同改性时间下的水解度均在200MPa时达到最大值。综上,选择50min为HPI酶解改性反应最佳时间。
2.2 超高压辅助酶解反应对 HPI 理化性质的影响
2.2.1 溶解度
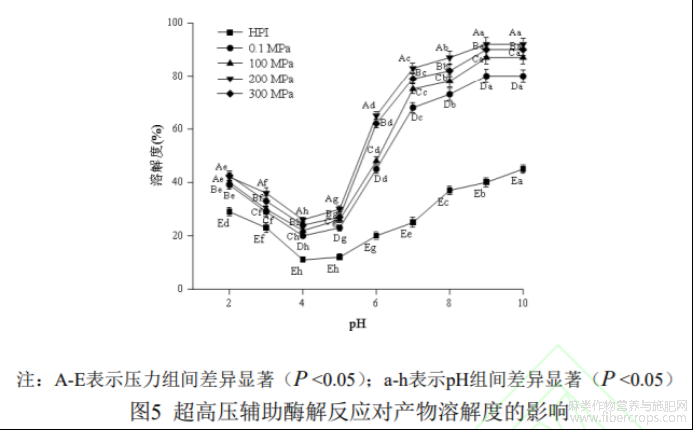
溶解度作为蛋白质十分重要的一种功能特性,很大程度上决定了蛋白质的乳化性、起泡性等性质,因此提高溶解度是蛋白质改性中一个重要方面[28]。如图5所示为在最佳酶解条件下超高压辅助酶解反应产物在不同pH下的溶解度。由图可知,在pH2.0~10.0范围内,HPI及其水解产物的溶解度随pH增大呈先下降后上升趋势,均在pH4.0时达到最小值,可知等电点在4.0附近。
在pH2.0-10.0范围内,HPI水解产物在200MPa时的溶解度最高,其次是300MPa、100MPa和0.1MPa,均远高于改性前HPI的溶解度。溶解度的提升主要有两方面的原因,一方面,酶解反应使HPI致密的空间被破坏,分子发生重排,亲水性区域暴露,改变了亲水与疏水性基团的排列与分布;另一方面,大分子蛋白变成小分子量肽段,使蛋白质表面亲水基团与水的接触面积增大,从而增大了酶解产物的溶解度[9]。由此可以看出,酶解反应可以有效改善HPI溶解度且在酶解反应中介入适当的压力可增强这种效应,但是,过高的压力(300MPa)会使蛋白质重新聚集而酶解效率降低,导致溶解度相对减小。
2.2.2 起泡性
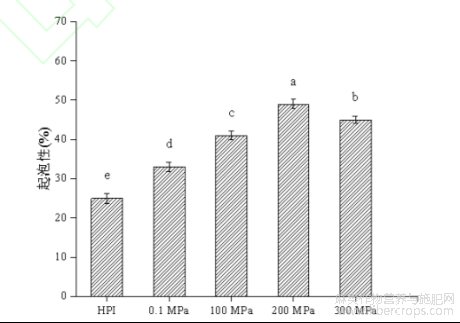
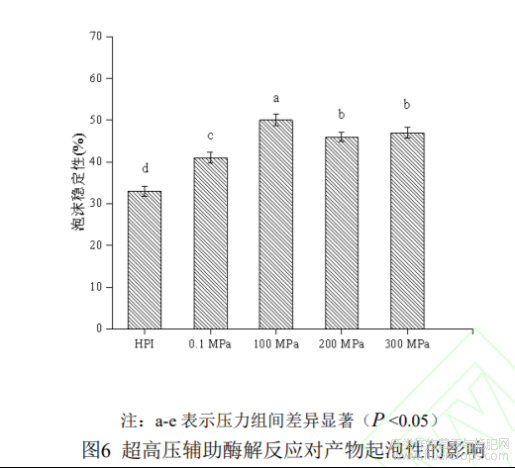
蛋白质溶液经过高速剪切搅打后,分子会吸附到气-液界面通过分子间相互作用形成粘弹性薄膜,进而形成泡沫,其本质是蛋白质、水和空气在一定条件下形成的特殊混合物[29]。如图6所示为在最佳酶解条件下超高压辅助酶解反应对HPI起泡性及泡沫稳定性的影响,由图可知,HPI酶解产物的起泡性和泡沫稳定性均呈先上升后下降的趋势,在压力为200MPa处理时起泡性最大(49.0%±1.23%),当压力增加到300MPa时,起泡性反而下降。起泡性的增加主要是由于HPI经超高压辅助酶解改性后,蛋白质结构展开程度变大,表面电荷增加,可溶性蛋白含量增多,从而使更多蛋白质吸附到界面处,有助于液膜的形成[30,31]。然而,当体系压力增加到300MPa时,可能是压力过大导致蛋白质重新聚集,使溶解度减小,分子间作用力减弱,因此起泡性相对变差。泡沫稳定性在100MPa处理下达到最大,其增加也与溶解度有关,当体系中可溶性蛋白含量增加时,有利于泡沫周围黏性蛋白膜的形成,因此,泡沫稳定性得以提高,200MPa及300MPa下泡沫稳定性相对下降是由于随着酶解进程的增加,多肽链逐渐缩短且分子量减小导致的,这与Sara[32]等人的研究结果一致。
2.2.3 乳化性及乳化稳定性
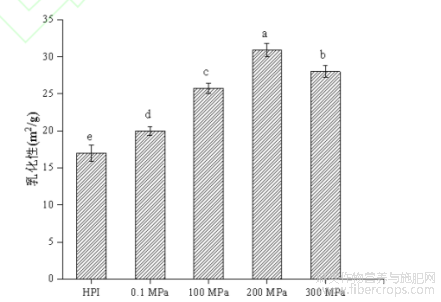
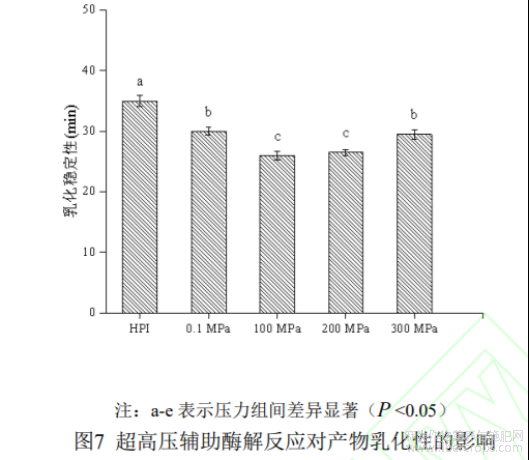
蛋白质通常作为表面活性剂应用于香肠、汤料等食品中,维持体系乳化结构稳定,以延长制品保存期。乳状液和泡沫形成的原理非常相似,蛋白质的溶解性在其中起着重要作用。如图7所示为在最佳酶解条件下超高压辅助酶解反应对产物乳化性及乳化稳定性的影响,由图可知,与HPI相比,在0.1-300MPa处理下,HPI酶解产物乳化性显著升高(P<0.05),200MPa下乳化性具有最大值为31.56±0.95m2/g。可能是超高压辅助酶解反应使蛋白质结构改变,疏水基团暴露,从而提高了分子柔性和表面疏水性,使蛋白质分子更易吸附到油水界面[37];此外,酶解改性后HPI酶解产物溶解度明显提升且肽段的产生也会使蛋白质分子间电荷作用增强,从而提升其乳化性。而300MPa时乳化性下降主要是因为压力增大时,蛋白质分子在氢键、疏水及静电相互作用下重新形成聚集体,表面疏水性降低,因此乳化能力降低[11]。乳化稳定性方面,不同压力处理下HPI酶解产物乳化稳定性均有所降低,可能与小分子多肽的产生,使降低界面张力的能力减弱,不能有效防止油滴聚集有关,这与崔宪[33]等人的研究结果一致。综合来看,蛋白质的乳化能力与乳化稳定性的好坏并不存在正相关。
2.2.4 持水性
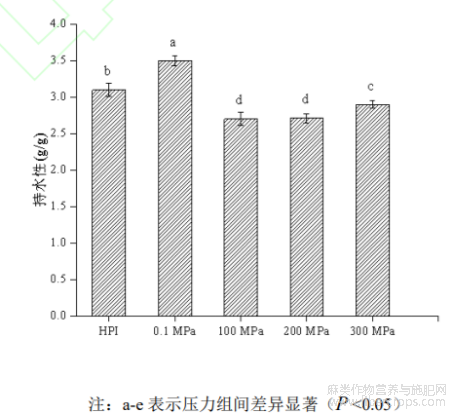
蛋白质的持水性是指蛋白质在食品加工中与水的结合能力,蛋白质分子表面亲水性及疏水性强弱、分子的物理截留作用以及结构都会影响持水性,持水性好坏可直接影响食品的嫩度和口感。如图8所示为在最佳酶解条件下超高压辅助酶解反应对产物持水性的影响,由图可知,HPI持水性为3.1±0.17g/g,压力在0.1MPa、100MPa、200MPa、300MPa时酶解产物持水性分别为3.5±0.09g/g、2.7±0.08g/g、2.73±0.06g/g、2.9±0.08g/g,可见,0.1MPa处理下酶解产物持水性最大,高于改性前HPI,而100-300MPa处理时显著下降(P<0.05),低于改性前HPI。可能的原因是HPI在蛋白酶的作用下肽链断裂,极性基团暴露,使部分氨基与羧基处于游离状态,蛋白质分子通过极性基团吸水,因而持水性增加。持水性下降的原因可能与蛋白质结构有关,蛋白质经高压酶解后,分子量和粘度逐渐降低,蛋白质分子无序性程度增加,从而导致持水性下降[34],当压力再继续增加时,加强了蛋白的水合作用,又进一步促进水分吸收[35]。
图8 超高压辅助酶解反应对产物持水性的影响
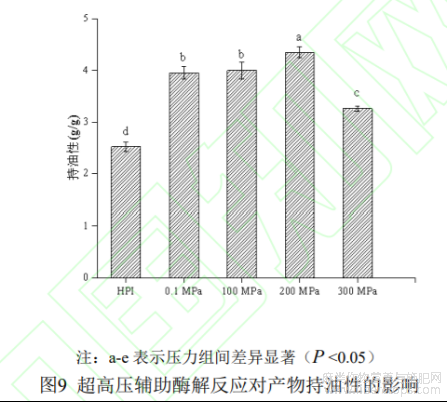
2.2.5 持油性
蛋白质持油性是指蛋白质吸附油脂的能力,将蛋白质应用于肉制品加工中可有效降低肉中油脂及汁液流失。如图9所示为在最佳酶解条件下超高压辅助酶解反应对产物持油性的影响,研究表明,蛋白质表面疏水性及其氨基酸侧链残基的非极性基团可影响蛋白质对油脂的吸附能力[36]。本实验中,蛋白质持油性随压力的升高呈先上升后下降的趋势,HPI持油性为2.52±0.09g/g,0.1-300MPa时持油性分别为3.95±0.10g/g、4.01±0.13g/g、4.35±0.08g/g、3.26±0.05g/g,可见,改性后蛋白质的持油性较改性前相比均有显著提高(P<0.05),200MPa时达到最大值。可能的原因是,HPI经酶解改性后溶解度增大,疏水基团暴露,提高了蛋白质与油脂的接触率与亲和力,因此其酶解产物的持油率有所提升,但当压力达到300MPa时,蛋白质在压力的作用下发生聚集,溶解度因此降低且表面疏水基团被蛋白质聚集体所掩盖,导致其持油能力下降,这与林素丽[37]等人研究结果一致。
3 结论
本研究在0.1-300MPa超高压下辅助复合蛋白酶对HPI进行酶解改性,以溶解度及水解度为判定指标,得到最佳改性条件为:加酶量5000U/g、改性pH8.0、改性温度55℃、改性时间50min。在此条件下酶解后的蛋白溶解性显著提升(P<0.05),当压力为200MPa时溶解性最高,随后下降。蛋白起泡性有所提升,并在200MPa时达到最大,而泡沫稳定性在100MPa处理下最高,与起泡性变化趋势并不完全一致。经酶解后HPI的乳化性随压力升高逐渐增大而后减小,当压力为200MPa时其乳化性最高,而乳化稳定性存在不同程度的下降。由持水性测定结果可知,0.1MPa处理时HPI持水性最大且高于HPI,随着压力的增加,持水性反而下降。由持油性测定结果可知,改性后蛋白质的持油性较HPI相比均有显著提高(P<0.05),200MPa时达到最大值。综上所述,当超高压压力在200MPa时对HPI酶解改性具有较好的促进作用,能够明显改善HPI的理化性质。
参考文献
[1] 王 冰 , 杨 杨 , 范洪臣 , 等 . 热 处 理 温 度 和 离 子 强 度 对 汉 麻 蛋 白 热 聚 集 行 为 的 影 响 [J]. 食 品 安 全 质 量 检 测 学 报,2022,13(16):5337-5344. WANG Bing,YANG Yang,FAN Hongchen, al. Effects of heat treatment temperature and ionic strength on thermal aggregation behavior of hemp protein[J]. Journal of Food Safety & Quality,2022,13(16):5337-5344.
[2] 石杰,宋淑敏,魏连会,等. 汉麻籽蛋白的分级提取及产物功能特性的研究[J]. 粮食与油脂,2021,34(11):132-136. SHI Jie,SONG Shumin,WEI Lianhui, et al. Study on fractionation of hemp seed protein and functional properties of the product[J]. Cereals & Oils, 2021,34(11):132-136.
[3] MALOMO S A,RONG H,ALUKO R E. Structural and functional properties of hemp seed protein products[J]. Journal of Food Science,2014,79(8):1512-1521.
[4] 庞鑫慧,苏丹,杨杨,王冰,等.汉麻蛋白改性及其表征方法的研究进展[J].食品研究与开发,2022,43(4):203-208. PANG Xinhui,SU Dan,YANG Yang,WANG Bing,et al.Research progress in hemp protein modification and its characterization methods[J]. Food Research and Development,2022,43(4):203-208.
[5] 徐瑶.超高压辅助酶解对沙棘汁品质的影响[J].农产品加工,2019(23):43-45. XU Yao. Effect of ultra high pressure enzymolysis on the quality of seabuckthorn juice[J]. Farm Products Processing,2019(23):43-45.
[6] ZHAO G,LIU Y,REN J,et al. Effect of protease pretreatment on the functional properties of protein concentrate from defatted peanut flour [J]. Journal of Food Process Engineering,2013,36(1):9-17.
[7] INE R,MARIE L,ELLEN F,et al. Air-water interfacial properties of enzymatic wheat gluten hydrolyzates determine their foaming behavior[J]. Food Hydrocolloids,2016,55:155-162.
[8] 王章存,袁路阳,张露,等.生物酶解法去除大豆蛋白抗原性研究进展[J].食品工业科技,2018,39(15):317-321. WANG Zhangcun,YUAN Luyang,ZHANG Lu,et al.Research progress of enzymatic removal of soybean protein antigenicity[J]. Science and Technology of Food Industry,2018,39(15):317-321.
[9] 庞佳坤,郑远荣,刘振民,等.超高压对乳清分离蛋白结构和抗氧化活性的影响[J].食品与发酵工业,2020,46(04):72-77. PANG Jiakun,ZHENG Yuanrong,LIU Zhenmin, et al. Effects of ultra-high pressure on structure and antioxidant activity of whey protein isolates[J]. Food and Fermentation Industries,2020,46(4):72-77.
[10] 郑环宇,孙美馨,张林,等.超高压均质处理大豆分离蛋白-磷脂复合物的理化性质研究[J].大豆科技,2019(3):14-21. ZHENG Huanyu,SUN Meixin,ZHANG Lin, et al. Physicochemical properties of soy protein isolate-phospholip?id complex treated by ultrahigh pressure homogenization[J]. Soybean Science & Technology,2019(3):14-21.
[11] 刘宁,杨柳怡,齐雅墨,等.限制性酶解-超高压处理对米渣蛋白乳化性的影响[J].陕西科技大学学报,2020,38(6):30-33+39. LIU Ning,YANG Liuyi,QI Yamo, et al.Effect of controlled enzymolysis and high hydrostatic pressure on the emulsibility of rice residue protein[J]. Journal of Shaanxi University of Science & Technology,2020,38(6):30-33+39.
[12] 关海宁,徐筱君,孙薇婷,等.超高压协同酶法条件下不同分子量大豆分离蛋白水解肽乳化性及抗氧化性研究[J].食品安全 质量检测学报,2022,13(12):3780-3786. Guan Hanning,Xu Youjun,Sun Weiting, et al. Study on emulsification and antioxidant properties of soy protein isolate hydrolysatic peptides with different molecular weight by enzymatic hydrolysis under high hydrostatic pressure[J]. Journal of Food Safety & Quality,2022,13(12):3780-3786.
[13] 杨文博,张英华.蛋白质水解度的测定方法研究[J].中国调味品,2014,39(3):88-90. Yang Wenbo,Zhang Yinghua. Study on the determination methods of hydrolysis degree of protein[J].China Condiment ,2014,39(3):88-90.
[14] 齐奇,刘河涛,杨文君,等.大豆胨制备工艺条件研究[J].粮油食品科技,2015,23(1):74-78. Qi Qi,Liu Hetao,Yang Wenjun, et al. Study on the preparation of soya peptone[J].Science and Technology of Cereals,Oils and Foods,2015,23(1):74-78.
[15] AGYARE K K,ADDO K,XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J]. Food Hydrocolloids,2009,23(1):72-81.
[16] SHANSHAN JIANG,MUHAMMAD ALTAF HUSSAIN,JIANJUN CHENG, et al. Effect of heat treatment on physicochemical and emulsifying properties of polymerized whey protein concentrate and polymerized whey protein isolate [J] . LWT . 2018,98:134-140
[17] WANG W,SHEN M,LIU S,et al. Gel properties and interactions of mesona blumes polysaccharidesoy protein isolates mixed gel:The effect of salt addition[J]. Carbohydrate Polymers,2018,192:193-201.
[18] CHEN C,CHI Y,ZHAO M,et al. Influence of degree of hydrolysis on functional properties,Antioxidant and ACE Inhibitory Activities of Egg White Protein Hydrolysate[J]. Food Science and Biotechnology,2012,21(1):27-34.
[19] 乔杨波,韩丽娟,王树林,等.不同蛋白酶酶解对蚕豆蛋白生物活性的影响[J].中国油脂,2020,45(7):56-60. Qiao Yangbo,Han Lijuan,Wang Shulin, et al. Effect of different protease enzymatic hydrolysis on biological activity of broad bean protein[J]. China Oils and Fats,2020,45(7):56-60.
[20] 沈敏江,王文辉,刘丽,等. 核桃蛋白有限酶解增溶改性的工艺研究[J]. 中国粮油学报,2015,30(8):93-98. Shen Minjiang,Wang Wenhui,Liu Li,,et al. Study on the technology of limited enzymatic hydrolysis and solubilization of Walnut protein[J]. Journal of the Chinese Cereals and Oils Association, 2015,30(8):93-98.
[21] 李明月,杜钰,姚晓玲,等.超高压处理对蛋白质功能特性的影响[J].食品科技,2018,43(1):50-54. Li Mingyue,Du Yu,Yao Xiaoling, et al. Effects of ultrahigh pressure processing on protein functional properties[J].Food Science and Technology,2018,43(1):50-54.
[22] 魏连会,董艳,石杰,等.汉麻籽抗氧化肽的制备与氨基酸序列分析[J].中国油脂,2022,47(4):36-40. Wei Lianhui,Dong Yan,Shi Jie, et al. Preparation and amino acid sequence analysis of antioxidant peptides from hemp seeds[J]. China Oils and Fats,2022,47(4):36-40.
[23] 贾聪,华欲飞,陈业明,等.pH 和阿拉伯胶对大豆分离蛋白/大豆蛋白酶解产物乳化性质的影响[J].食品与发酵工 业,2017,43(5):25-29. Jia Cong,Hua Yufei Chen Yeming, et al.. Effect of pH and acacia on emulsifying properties of soybean protein isolate/Soybean protease hydrolysate[J]. Food and Fermentation Industries,2017,43(5):25-29.
[24] 陈林,吴克刚,柴向华,等.物理预处理改善食品蛋白酶解特性的研究进展[J].食品与发酵工业,2013,39(10):181-186. Chen Lin,Wu Kegang,Chai Xianghua, et al. Progress in improving proteolytic properties of food by physical pretreatment[J]. Food and Fermentation Industries,2013,39(10):181-186.
[25] 于栋,高洋,何新蕾.酶法制备黑豆粕粉多肽的工艺研究[J].中国酿造,2021,40(4):143-147. Yu Dong,Gao Yang,He Xinlei. Preparation of polypeptides from black bean meal by enzymatic method[J]. China Brewing,2021,40(4):143-147.
[26] 张晶. 均质及酶解对大米蛋白功能特性的影响及机理的初探[D]. 合肥:安徽农业大学粮食、油脂及植物蛋白工程硕士 学位论文,2016:45-49. Zhang Jing. The effects of homogeneity and enzymatic hydrolysis on functional properties of rice protein and preliminary study on its mechanism[D].He Fei: Anhui Agricultural University 、 Master's thesis in Grain, Oil and Vegetable Protein Engineering,2016:45-49.
[27] 陈日春,郑宝东.鲢鱼鱼鳞胶原蛋白抗氧化活性肽提纯及结构鉴定研究进展[J].食品安全质量检测学报,2017,8(4): 1339-1345. Chen Richun,Zheng Baodong. Research progress on purification and structure identification of antioxidant activity peptides of collagen in silver carp fish[J]. Journal of Food Safety & Quality,2017,8(4):1339-1345.
[28] 易佳,刘昆仑.超微联合超声波优化提取米糠蛋白及其对米糠蛋白溶解性的影响[J].食品研究与开发,2022,43(19):117-123. YI Jia,LIU Kunlun. Optimization of extraction process of rice bran protein by ultrafine grinding combined with ultrasound and effect of extraction on protein solubility[J]. Food Research and Development,2022,43(19):117-123.
[29] 张思雨,程建军,孙玉雪,等.热处理对乳清蛋白原料起泡性、理化特性的影响及关系研究[J/OL].食品与发酵工 业:1-10[2022-12-22]. Zhang Siyu,Cheng Jianjun,Sun Yuxue, et al.. Effect of heat treatment on foaming properties of whey protein ingredients and its relationship with physicochemical and structural[J/OL]. Food and Fermentation Industries:1-10[2022-12-22].
[30] RODRIGUEZ PATINO J M,MINONES CONDE J,LINARES H M,et al. Interfacial and foaming properties of enzyme-induced hydrolysis of sunflower protein isolate[J]. Food Hydrocolloids,2007,21(5-6):782-793.
[31] ROBITAILLE G,AYERS C. Effect of K-casein glycosylation on heat stability of milk[J]. Food Research International,1995,28(1):17-21.
[32] Sara E Molina Ortiz,Jorge R Wagner. Hydrolysates of native and modified soy protein isolates: structural characteristics, solubility and foaming properties[J]. Food Research International,2002,35(6):511-518.
[33] 崔宪,刘容旭,姜帆,等.植物乳杆菌发酵对大豆分离蛋白功能性质影响研究[J].食品工业科技,2016,37(3):177-180+186. CUI Xian,LIU Rongxu,JIANG Fan, et al.Effect of fermentation by lactobacillus plantrum on functional properties of soybean protein[J]. Science and Technology of Food Industry, 2016,37(3):177-180+186.
[34] 管弋铦,何苗,熊双丽.超高压处理对大米蛋白功能特性及结构的影响[J].食品工业科技,2016,37(20):104-109. GUAN Yixian,HE Miao,XIONG Shuangli. Effects of ultra high pressure treatment on functional properties and structure of rice proteins[J]. Science and Technology of Food Industry,2016,37(20):104-109.
[35] 胡小军,李春兰,王标诗,等.超高压处理对虾滑预制菜品质特性的影响[J/OL].食品工业科技:1-11[2023-02-09]. Hu Xiaojun,Li Chunlan,Wang Biaoshi, et al. Effect of ultra-high pressure on the quality properties of shrimp slips prepared dishes[J/OL]. Science and Technology of Food Industry, 1-11[2023-02-09].
[36] RESENDIZ-VAZQUEZ J.A,ULLOA J.A,URÍAS-SILVAS J.E,et al. Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus)seed protein isolate[J]. Ultrasonics-Sonochemistry,2017,37:436-444.
[37] 林素丽. 超高压处理对米糠蛋白功能及结构特性的影响研究[D].浙江大学,2017:20-80. Lin Suli. Effects of high pressure treatment on functional and structural properties of rice bran protein[D].Zhejiang University,2017:20-80.
文献摘自:刘容旭,李春雨,王语聪,谢智鑫,谢宜桐,李双鹏,刘丹怡,韩建春.超高压辅助酶解法改性汉麻分离蛋白及其理化性质的研究[J/OL].食品工业科技:1-16[2023-04-08].DOI:10.13386/j.issn1002-0306.2023010016.