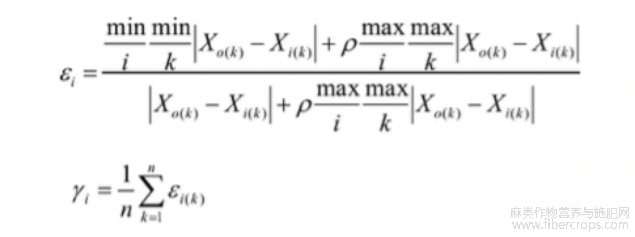摘 要:【目的】研究水杨酸(SA)引发对盐胁迫下红麻生长及生理响应,并揭示SA引发对红麻中逆境相关基因的诱导模式,为红麻耐盐性研究提供理论依据。【方法】以2个不同耐盐性红麻品种(盐抗性材料为CP018,盐感性材料为CP047)为研究对象,将种子引发处理后进行水培试验,分析SA引发对红麻种子萌发及150mmol·L-1NaCl胁迫下幼苗农艺性状及生理方面的影响,并通过qRT-PCR技术分析SA引发逆境相关基因的表达模式。【结果】盐抗性品种CP018经过0.2mmol·L-1SA引发后,能显著提升种子发芽率、发芽势和发芽指数,分别提高34.78%、31.30%和58.07%;盐感性材料CP047也有一定的提高,分别提高7.50%、10.56%和6.23%,但是未达到显著水平。在盐胁迫条件下,经SA引发(S1)与未引发(N1)相比,株高抑制率在盐抗性和盐感性品种中分别显著降低4.07%(CP018)和3.91%(CP047),干重抑制率在2个品种中分别显著降低15.50%(CP018)和15.68%(CP047);鲜重抑制率在盐感性品种CP047中显著降低4.46%,但在盐抗性品种CP018中未达到显著水平。根系扫描分析表明,根长抑制率在盐抗性和盐感性材料中分别显著下降10.74%(CP018)和10.77%(CP047);根表面积抑制率在盐抗性和盐感性品种中分别下降5.09%(CP018)和2.95%(CP047),仅在盐抗性品种CP018中达到显著水平;而根系活力抑制率在盐感性品种CP047中降低46.21%,在盐抗性品种CP018中降低6.56%,仅在盐感性品种CP047中达到显著水平。灰色关联度分析发现根系活力是对影响植株干重最重要的因素。SA引发能降低盐胁迫下红麻叶片的MDA含量,提高POD和SOD酶活性。对12个逆境相关基因的表达量分析结果表明,ACCD、APX2、SOS1、ARR2、PAL、ERF.C3、CHIT和TIFY11表达水平在SA引发处理下均显著上调,而ERF9、ERS1、MYC2和XTH22在2个材料中的表达模式存在差异,其中,XTH22在CP047中显著上调,在盐抗性品种CP018中无显著变化,ERS1和MYC2在盐抗性品种CP018中显著上调,在盐感性品种CP047中却显著下降,而ERF9在2个品种中的趋势则与此相反。【结论】适宜浓度的SA引发可以显著缓解红麻在盐胁迫下的生长,且对不同红麻种质资源的影响程度和方式存在差异,SA可能通过影响生理过程如抗氧化酶系统,并通过诱导特异基因的表达调节红麻植株对非生物胁迫的响应。
关键词:红麻(Hibiscus cannabinus L.);种子引发;水杨酸;抗氧化酶活;盐胁迫
0引言
【研究意义】红麻(Hiniscus cannabinus L.)是锦葵科木槿属重要的纤维作物,具有快速生长、耐盐碱、抗涝、抗旱、纤维产量高和质量好等优良特性[1],是改善盐碱地和研究作物对非生物胁迫反应的理想材料[2]。提高红麻的耐盐性对提高红麻产量和合理利用盐碱地,具有重要的社会经济生态效应。【前人研究进展】世界范围内的农业生产力受到各种环境压力的不利影响,如土壤盐碱化是限制作物种植面积,以及作物产量和品质的重要因素[3]。中国的盐碱地面积约为3.6×107hm2,其中,具有农业利用潜力的盐碱地面积达1.3×107hm2,约占总耕地面积的10%[4]。土壤溶液中盐分的积累会引起植物代谢紊乱、离子失衡、渗透胁迫、有毒离子积累、氧化损伤,最终导致作物对水分和养分的吸收减少[5]。过量的活性氧(reactive oxygen species,ROS)积累会导致代谢功能的改变,不可避免地会引起植物蛋白质氧化、膜质过氧化、酶抑制以及DNA和RNA损伤等[6]。与此同时,植物已经进化出各种适应机制以抵抗胁迫环境[7]。植物可以通过产生超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)等抗氧化酶来清除过量的ROS[8]。种子引发是一项通过缓控种子吸水和逐步回干的处理技术[9]。种子引发受多种因素调控,关键因素有引发剂种类[10]、引发时间[11]、引发温度[11]和引发浓度[12]等。具体的引发技术通过调控温度和水势,使种子停留在吸胀吸水的第二阶段,在胚根突破种皮前完成细胞器、细胞膜和DNA的修复,使生物酶得到活化,促进细胞分裂和细胞扩大,提高出苗率[13]。很多学者通过外源物质种子引发的方法来缓解植株的逆境胁迫[14]。水杨酸(salicylic acid,SA)作为一种内源性生理调节剂,广泛存在于各类植物体内[15]。研究表明,水杨酸可以参与调节植物(生长发育、气孔调节、酶生物合成、膜保护和植物开花等)多种生理生化活动[16]。SA引发可提高植株的抗氧化酶活性,且在玉米[17]、小麦[18]、豌豆[19]等植物上已得到证实。已有研究发现50mg·L-1的SA可以提高小麦在盐胁迫下的发芽势、苗高和鲜重[20],0.2mmol·L-1SA引发24h对棉花种子发芽率提高效果最好[21];王铁兵等[22]采用0.1mmol·L-1SA处理老化的玉米种子,发现SA引发能促进幼苗生长,修复老化膜损伤;有研究表明,10-6和10-5mol·L-1的SA引发处理可增加拟南芥在盐胁迫下的SOD、GST和GPOX活性,降低H2O2和MDA积累,At GSTU19和At GSTU24的表达均有所增强,该研究者认为SA引发可以通过调节一些关键的ROS和抗氧化物酶来减少盐胁迫引起的氧化损伤,而酶活性的改变可能源自一些关键解毒基因(如GST)的转录调控[23]。【本研究切入点】红麻作为盐碱地修复的重要作物,目前,通过种子引发提高红麻植株耐盐性的研究仍鲜见报道。【拟解决的关键问题】本研究以未经引发作为对照,通过对SA对不同耐盐性红麻种子的萌发及幼苗在盐胁迫下的形态与生理指标的测定与分析,探究SA对红麻耐盐性的影响,以期为种子引发提高红麻耐盐机理的研究提供理论参考。
1材料与方法
1.1试验材料
供试品种:采用广西大学农学院植物遗传育种实验室陈鹏课题组前期鉴定的2个具有不同盐胁迫耐受能力的品种,闽红964(盐抗性品种CP018)和7804(盐感性品种CP047)。取当年新收获的种子晾干备用。水杨酸(SA)和氯化钠分别购自天津博迪化工有限公司和天津市致远化学试剂有限公司。试验于2021年3—9月在广西大学农学院综合楼实验室以及温室大棚进行。
1.2试验设计
引发处理:挑选籽粒饱满的红麻种子,用1.5%次氯酸钠消毒10min,蒸馏水冲洗3次;分别将0.2mmol·L-1SA浸种和未浸种(对照)的种子置于16℃培养箱中黑暗培养24h。浸种后的种子用蒸馏水冲洗3次,并自然风干,选择露白一致的种子均匀平铺在发芽盒中,置于培养箱(白天26℃14h/黑夜25℃10h)中培养,60粒/盒,3个重复,每天定量添加蒸馏水,观察其生长情况,测定种子萌发期间的发芽率、发芽势和发芽指数。
幼苗培育:用蒸馏水将发芽4d后的幼苗根系冲洗干净,挑选长势一致的幼苗移植到1/4Hoagland营养液的育苗盘中,3个生物学重复,培育至两叶一心时,用150mmol·L-1(预试验确定)浓度的NaCl对其进行处理,以不加NaCl的1/4Hoagland营养液作为对照。试验共设置8个处理(表1),每个处理3个生物学重复。每2d更换一次处理液,处理8d后开始取样进行测定。
表1 不同处理组合的设置

1.3测定项目与方法
1.3.1发芽情况的统计
种子萌发相关指标发芽率、发芽势和发芽指数的计算公式如下:
发芽率(germination rate,GR,%)=(4d内发芽数/供试种子数)×100%;
发芽势(germination potential,GP,%)=(2d内发芽数/供试种子数)×100%;
发芽指数(germination index,GI,%)=∑(Gt/Dt),其中,Gt为第t天的新增发芽数,Dt为相应发芽的天数。
1.3.2农艺性状的测定
将红麻幼苗的根系用去离子水清洗干净后吸干表面水分,用直尺测量幼苗的株高,天平称量整株鲜重。采用EPSON 11000XL扫描仪对红麻幼苗根系进行扫描,利用WinRHIZO2013根系分析系统获取根表面积和根长。将植株整株置于烘箱105℃杀青30 min,80℃烘干至恒重,天平称量干重。
1.3.3生理指标的测定
采用抑制NBT光还原比色法、愈创木酚法和过氧化氢紫外线法分别测定超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性;采用硫代巴比妥酸法(2-thiobarbituric acid,TBA)测量丙二醛(malondialdehyde,MDA)含量,采用氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)法测定根系活力。
1.3.4qRT-PCR分析
运用改进的异硫氰酸胍法提取总RNA[2],用1%琼脂糖凝胶电泳检测RNA质量,紫外可见分光光度计(NanoDrop,2000)检测RNA浓度。然后逆转录合成cDNA(南京诺唯赞,货号:R232-01),采用SYBR qPCR Master Mix(南京诺唯赞)试剂进行qRT-PCR分析,PCR反应体系为10µL qPCR Master Mix、0.4µL正向引物和反向引物(表2)、1µL模板和8.2µL去离子水。3次生物学重复。以18SrRNA(18S)作为内参基因,采用2-ΔΔCT方法[24]计算相对表达量水平。
表2 实时荧光定量PCR引物序列

1.4灰色关联度分析及数据处理
参照李桂荣等[25]方法进行灰色关联度分析,植株干重为参考数列Xo,5个性状参数设为比较数列Xi,参数Xi与Xo的关联系数和各因素的关联度分别为:
式中,εi(k)为Xi对Xo在k点的关联系数,ρ为灰色关联的分辨系数,(ρ在(0,1)内取值,ρ越小,关联系数间差异越大,区分能力就越强),ρ通常取0.5;
 为两级最小差绝对值;
为两级最小差绝对值;
 为两级最大差的绝对值;
为两级最大差的绝对值;
根据关联度γ的大小确定比较数列与参考数列的关联程度,关联度越大,说明两序列间的相关水平越高,即该比较序列对参考序列的影响越明显(本研究以抑制率作为原始数据进行分析)。
采用单因素试验统计分析方法(least significant difference,LSD),对不同处理的试验数据进行差异显著性检测(显著性水平为0.05)。用GraphPad Prism7.00软件对试验数据进行统计制表。
2结果
2.1种子引发对红麻种子萌发的影响
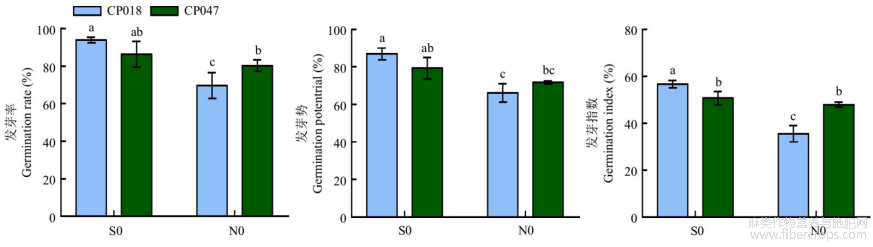
从图1可知,在红麻品种CP018中,与未引发处理(N0)相比,SA引发处理(S0)显著提高了种子的发芽率、发芽势和发芽指数,分别提高34.78%、31.30%和58.07%。在CP047中,SA引发处理(S0)提高了种子的发芽率、发芽势和发芽指数,分别提高7.50%、10.56%和6.23%,但并没有达到显著性。表明SA对于不同品种引发效果存在差异。
2.2种子引发对NaCl胁迫下红麻农艺性状及干物质积累的影响
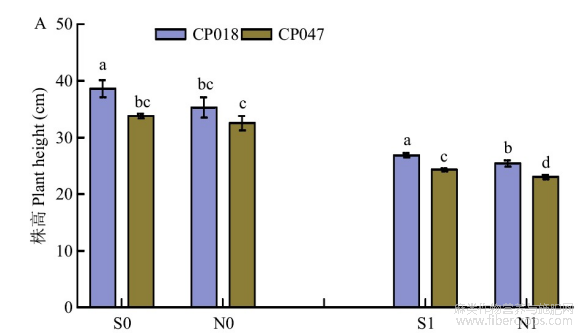
由图2-A和2-B可看出盐胁迫使各处理的红麻幼苗植株高度降低,且未经引发处理的叶片有稍微卷曲,由图3-A可看出,2个品种的株高在盐胁迫下都受到显著抑制。未经引发盐胁迫处理(N1)时,2个品种的盐胁迫株高抑制率分别为28.02%(CP018)和29.20%(CP047),经SA引发盐处理(S1)的2个品种株高抑制率分别为23.95%(CP018)和25.29%(CP047),与N1相比,抑制率降低4.07%(CP018)和3.91%(CP047),且都达到了显著差异。说明SA种子引发可以缓解盐胁迫,从而显著提高红麻幼苗在盐胁迫下的株高。
由图3-B可看出,2个品种的幼苗鲜重在引发条件下都有所提高。未经引发盐胁迫处理(N1)的幼苗鲜重在盐胁迫下抑制率分别为45.22%(CP018)和49.86%(CP047),而SA引发处理(S1)的幼苗鲜重抑制率为43.36%(CP018)和45.40%(CP047),与N1相比,下降1.86%(CP018)和4.46%(CP047),在CP047中达到显著差异,而在CP018中未达到显著差异。说明水杨酸能一定程度地减轻红麻盐胁迫下受到的伤害,提高红麻幼苗的鲜重。
由图3-C可看出,2个红麻品种在引发条件下植株的干重都有所提高。盐胁迫下(N1)幼苗的干物质积累量抑制率为42.91%(CP018)和43.19%(CP047)。引发后的幼苗在盐胁迫下(S1)干物质积累的抑制率都有所下降,分别为27.41%(CP018)和27.51%(CP047),与N1相比,显著下降15.50%(CP018)和15.68%(CP047)。说明水杨酸有助于提高红麻盐胁迫下的干物质积累。
图1 SA种子引发对红麻种子萌发的影响
图2 红麻SA种子引发后在盐胁迫下的苗期形态
图3 红麻SA种子引发后在盐胁迫下的农艺性状
2.3种子引发对NaCl胁迫下红麻根系的影响
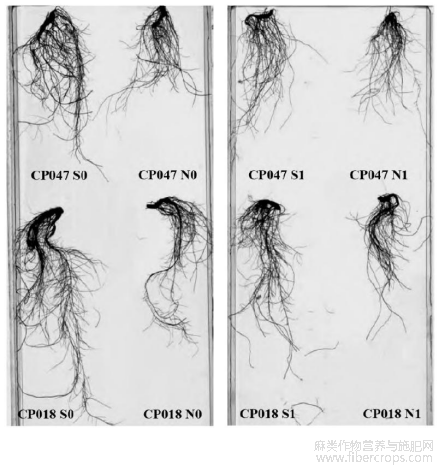
由图4可看出,在盐胁迫条件下,根长都受到了不同程度的抑制。与未经引发处理相比,SA引发条件下红麻的根长有所提高(图5)。2个品种在未经引发的盐胁迫N1下根长抑制率分别为28.62%(CP018)和31.78%(CP047),而S1处理下2个品种的根长抑制率降低为17.88%(CP018)和21.01%(CP047),与未引发(N1)相比,分别下降10.74%(CP018)和10.77%(CP047),达到显著差异水平。
引发条件处理可以提高红麻根表面积,且可以缓解盐胁迫对根表面积的抑制。2个品种在未经引发(N1)处理下的根表面积抑制率分别为17.76%(CP018)和18.42%(CP047),SA引发(S1)条件下根表面积抑制率降低为12.67%(CP018)和15.47%(CP047),与N1相比,分别降低5.09%(CP018)和2.95%(CP047),在品种CP018中达到了显著差异,而在CP047中未表现出显著的差异。
由图6可以看出,种子引发可以提高根系活力,且可以缓解盐胁迫对红麻幼苗根系活力的抑制。未经引发(N1)的红麻幼苗在盐胁迫下的根系活力抑制率为24.26%(CP018)和73.65%(CP047)。SA引发条件下(S1)的根系活力抑制率降低为17.70%(CP018)和27.44%(CP047),相对于N1分别下降6.56%(CP018)和46.21%(CP047),CP047中具有显著差异,在CP018中未表现出显著的差异,说明SA引发对供试红麻2个品种的幼苗在盐胁迫下根系活力具有明显的促进作用,且盐感性品种中促进作用更加显著。
图4 SA种子引发后NaCl胁迫下红麻根系扫描

图5 SA种子引发后NaCl胁迫下红麻根系分析

图6 SA引发对NaCl胁迫下红麻根系活力的影响
2.4各农艺指标间灰色关联度分析
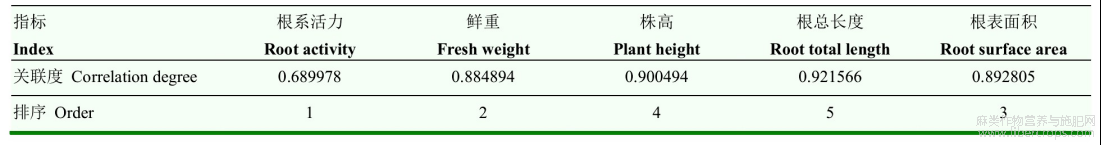
根据各指标的抑制率进行种子引发各指标灰色关联度分析,其顺序依次为根系活力>鲜重>根表面积>株高>根总长度(表3),说明根系活力、鲜重、根表面积对植株干重(生物量)的影响较大,其中,根系活力与干重的灰色关联度最高,表明根系活力可以作为衡量SA种子引发对NaCl胁迫下红麻幼苗阶段缓解效应的指示指标。
表3 SA种子引发对NaCl胁迫下红麻种子各指标的灰色关联度分析
2.5SA引发对Na Cl胁迫下红麻抗氧化酶活性的影响
未经引发盐胁迫(N1)显著增加了红麻幼苗叶片中的MDA含量,分别增加205.95%(CP018)和106.48%(CP047),但SA引发可以降低这种趋势。与N1相比,CP047品种在S1处理下的MDA含量显著降低20.01%,CP018中的MDA含量在S1处理下降低10.54%,但与N1相比未达到显著性(图7-A)。
与未经盐胁迫处理(S0和N0)相比,盐胁迫下SOD活性在各处理中均有所下降,但与未经引发N1相比,SA引发处理的SOD活性有所提高,S1处理条件下SOD活性分别提高12.14%(CP018)和40.68%(CP047),在CP047中达到显著水平(图7-B)。
本研究中,POD活性(图7-C)在盐胁迫下显著增加,表明盐胁迫促使红麻叶片产生POD消除过量的过氧化氢,2个品种中SA引发(S1)与N1之间有显著差异,与N1相比,POD活性在2个品种中分别显著提高44.37%(CP018)和47.2%(CP047)。
与对照未施加盐胁迫(S0和N0)相比,在盐胁迫下,未经引发(N1)的叶片CAT活性(图7-D)呈上升趋势,与N1相比,经过SA引发后(S1)的2个品种叶片CAT活性却有所下降。
综上所述,SA引发可以显著降低盐胁迫下红麻幼苗的MDA含量,显著增加幼苗的SOD和POD活性,从而缓解过量ROS对红麻幼苗的伤害。而这种作用在CP047中比较显著,说明SA引发对盐胁迫下红麻盐感性品种的抗氧化酶活缓解作用具有显著影响。

图7 SA种子引发对NaCl胁迫下红麻叶片MDA含量及抗氧化酶活性的影响
2.6逆境响应相关基因q RT-PCR分析
为分析种子引发对相关基因在盐胁迫下表达的影响,挑选12个逆境响应相关的基因分别在2个品种中进行了qRT-PCR分析(图8)。乙烯响应基因ERF9、ERF.C3和乙烯受体ERS1都是参与乙烯信号转导的重要调控因子,ERF9和ERF.C3在CP018品种中S1处理下分别显著上调0.45和4.05倍,在CP047中ERF.C3显著上调90.84倍,ERF9在CP047中却下调0.25倍;ERS1与ERF9在2个品种中呈相反的趋势,ERS1在CP047中显著上调4.61倍,在CP018中下调0.70倍。几丁质酶CHIT和苯丙氨酸解氨酶PAL在2个品种S1处理下的表达趋势一致,CP018中分别上调1.25和1.04倍,CP047分别上调1.74和1.81倍,抗坏血酸过氧化物酶APX2和1-氨基环丙烷-1-羧酸(ACC)脱氨酶基因ACCD在2个品种中趋势一致,分别显著上调3.07和3.22倍(CP018)、1.62和2.78倍(CP047),且都达到了显著差异水平;木葡聚糖内糖基转移/水解酶XTH22在CP018品种的S1处理下显著上调21.66倍,在CP047中无显著变化。TIFY11在2个品种中的S1处理下分别显著上调5.98(CP018)和4.18倍(CP047),MYC2在CP047中显著上调3.47倍,在CP018品种中显著下调0.75倍。细胞分裂素反应调节因子ARR2和Na+/H+逆向转运蛋白SOS1在2个品种中S1处理下的趋势也是一致的,分别显著上调1.59和1.16倍(CP018)、1.57和1.02倍(CP047)。

图8 逆境相关基因的qRT-PCR分析
3讨论
3.1SA引发影响了红麻种子的发芽以及苗期对盐胁迫的耐受性
种子引发是许多植物种类如粮食作物、某些蔬菜、花卉作物种子等的常用播前处理技术[26],其原理是通过控制种子的吸水作用至一定水平,允许种子在细胞膜、细胞器、DNA修复、准备发芽等过程的酶活化代谢作用进行,但防止胚根的伸出[14],进而提高种子的萌发和抗逆能力。杨小环等[27]通过研究发现引发处理可不同程度地促进盐胁迫下高粱种子萌发,减轻幼苗的盐害作用,促进幼苗生长。本研究发现,SA引发相对于未引发显著提高了CP018品种红麻种子萌发的发芽率、发芽势、发芽指数。经过SA引发的红麻幼苗在盐胁迫下的株高、干物质积累和根长的抑制率在2个品种中均达到显著降低水平,根表面积抑制率在CP018中显著降低,鲜重抑制率在CP047中显著降低,且对指标间的灰色关联度进行分析发现,根系活力、鲜重和根表面积指标与植株干重的关联度最大,这表明根系活力对于红麻种子经SA引发后在盐胁迫下生物量积累的影响最大,这与何奇江等[28]结果相似。而由于根系活力和根表面积的关联度大于易于观测的株高指标,推测是由于SA对地下部分的影响高于地上部分的影响。
植物的耐盐性评价是各种指标对遭受盐胁迫时的综合反应结果,而外源物质缓解盐害的评价亦需要多方面的验证。本研究中,SA引发显著提高了红麻种子的发芽率、发芽势和发芽指数,在2个品种中分别显著提高的株高、鲜重、干重、根长、根表面积和根系活力能有效反映出SA引发对盐胁迫的缓解作用。其中,根系活力与植株干重的灰色关联度最高,是最能反映SA引发对盐胁迫缓解效果的指标,这与王立红等[29]结果也是一致的。
3.2SA引发改变了红麻盐胁迫下的抗氧化酶活
植物在逆境条件下会导致ROS过度积累而引起脂质过氧化,MDA是膜质过氧化的主要副产物,通常被作为植物细胞受损程度的指示物[30]。本研究中,未经引发时盐胁迫下红麻叶片MDA含量上升,而经过SA引发处理的叶片MDA含量在盐胁迫下有所下降,在CP047中与未经引发处理的N1具有显著差异。SOD可将植物组织中的O2-转化为H2O2和O2,POD是一类氧化还原酶,它可以催化H2O2氧化胺类和酚类化合物,具有消除过量H2O2,保护细胞的作用[8],本研究中,SOD活性和POD活性在SA引发下都有提高,POD活性在2个品种中均显著上调,SOD在CP047品种中显著上调,说明SA可能通过提高盐胁迫下红麻抗氧化等能力,从而缓解过量ROS对幼苗的伤害。
结合2个品种在SA引发后的发芽情况、盐胁迫下的农艺性状与生理等指标,推测在CP018品种中,0.2 mmol·L-1SA主要作用于前期发芽时期,种子发芽率、发芽势和发芽指数的显著提高说明SA对红麻种子发芽情况有显著的影响,到了苗期盐胁迫下的株高、根长、根表面积、干物质积累量和POD活性达到了显著水平,但鲜重、根系活力、MDA含量和SOD活性的抑制率并没有显著降低,推测0.2 mmol·L-1SA可能并不是CP018苗期时所需的最佳浓度;而CP047品种的发芽率、发芽势和发芽指数没有达到显著水平,苗期根长、株高、干物质积累量、鲜重、MDA含量和SOD活性的抑制率等大部分指标达到了显著水平,推测0.2 mmol·L-1SA在苗期对CP047品种有显著的影响,但对种子萌发时期并不是最佳浓度。
3.3SA引发诱导相关基因的表达参与红麻盐胁迫响应
近年来,一些研究表明,外源SA可能通过影响相关基因的表达进而调控植株在盐胁迫下的响应[19,23]。本研究发现APX2、ACCD、TIFY11在2个品种的SA引发条件下表达量显著升高。抗坏血酸过氧化物酶APX参与响应植物的盐胁迫过程[31],ACC脱氨酶基因ACCD的重要作用之一是可以抑制植物体内乙烯的生物合成[32],也有研究认为ACC脱氨酶主要参与植物根毛的伸长生长[33]。TIFY转录因子是植物特有的,可能参与植物应对盐害的过程[34]。这些基因在2个品种中SA引发下均显著上调表达,表明SA引发可能通过影响这些基因的表达进而调控红麻对盐胁迫的响应。近年来,木葡聚糖内糖基转移/水解酶XTH22已被证明在调节植物高盐胁迫方面发挥重要作用[35],也有研究表明外源SA可缓解高温对XTHs基因的抑制作用[36],本研究中,XTH22在CP018品种中S1处理下表达量显著升高,说明外源SA可能缓解了盐胁迫对CP018中XTH22的抑制。MYC2和ERF.C3被证明共同参与JA介导的转录调控过程,ERF.C3在此途径作为MYC2下游基因,植物遭受到外界刺激后激活JA信号,启动并级联放大此信号,从而产生有效的防御机制[37],本研究中这两个基因在CP047中SA处理时均显著上调,推测这两个基因可能在CP047品种中参与到JA信号传递过程以促进植株积极应对外界刺激。乙烯转录因子基因ERF9可能参与负向调节植物对低氧胁迫的响应[38,39],在施加外源激素Me JA、ABA和SA时ERF9的表达在不同组织中不尽相同[40],推测ERF9的诱导表达具有时效性,且不同物种,甚至同一物种不同组织之间的表达也是有差异的,乙烯转录因子基因ERS1也参与到乙烯信号转导途径,本研究中ERF9和ERS1在2个品种中的表达水平是不一致的,说明SA引发可能对这两个品种的ERF9和ERS1具有不同的影响。细胞分裂素反应调节因子ARR2可能通过作用于TGA3/NPR1依赖的SA信号通路促进植物产生防御机制[41],Na+/H+逆向转运蛋白基因SOS参与植物抵御盐害[42],苯丙氨酸解氨酶PAL和几丁质酶CHIT在植物应对逆境方面具有重要作用[43,44],这些基因在2个品种中SA作用的盐胁迫下均显著上调,推测外源SA可能参与到盐胁迫下红麻植株中SA信号通路、盐离子运输途径以及次级代谢途径等进而影响植株的耐盐性。
4结论
SA能显著缓解盐胁迫对红麻幼苗生长的影响,可能是由于SA引发可以提高SOD、POD等抗氧化酶活性,从而减轻过量活性氧对幼苗的伤害。SA引发导致一些抗逆基因差异表达,进而调控红麻盐胁迫的响应过程。
参考文献
[9]BRADFORD K J. Manipulation of seed water relations via osmotic priming to improve germination under stress conditions. HortScience,1986, 21(5):1105-1112.
[15]RASKIN I. Role of salicylic acid in plants. Annual Review of Plant Biology, 1992, 43:439-463.
[20]AFZAL I, BASRA S M A, FAROOQ M, NAWAZ A. Alleviation of salinity stress in spring wheat by hormonal priming with ABA,salicylic acid and ascorbic acid. International Journal of Agriculture and Biology, 2006, 8(1):23-28.
文章摘自:胡亚丽,聂靖芝,吴霞,潘姣,曹珊,岳娇,罗登杰,王财金,李增强,张辉,吴启境,陈鹏.水杨酸引发对红麻幼苗耐盐性的影响[J].中国农业科学,2022,55(14):2696-2708.