摘 要:以脱脂亚麻籽粕为原料,采用酶法联合超声波提取其中的亚麻籽胶。以亚麻籽胶得率为指标,筛选提取亚麻籽胶的最适酶制剂,在单因素试验基础上,采用正交试验对酶添加量、提取温度、提取时间、料液比、超声功率进行优化,并对提取的亚麻籽胶中单糖组成及含量进行测定,对其结构进行红外光谱表征。结果表明:最佳酶制剂为果胶酶;亚麻籽胶最佳提取工艺条件为酶添加量1.25%、提取温度40℃、提取时间30min、料液比(脱脂亚麻籽粕与水的质量体积比)1∶30、超声功率400W,在此条件下亚麻籽胶得率为33.41%;亚麻籽胶中单糖的组成及含量分别为甘露糖0.97%、鼠李糖14.05%、葡萄糖醛酸0.16%、半乳糖醛酸22.17%、葡萄糖3.76%、半乳糖17.44%、木糖23.53%、阿拉伯糖10.30%、岩藻糖7.62%。
关键词:亚麻籽胶;亚麻籽粕;酶法;超声波
亚麻(Linum ustitatissimum L.)又称胡麻,是我国最古老的作物之一。亚麻籽是亚麻的种子,主要是由种皮、胚乳和子叶三部分组成,富含多种营养成分,如脂肪、蛋白质、亚麻籽胶、膳食纤维和木酚素等,具有调节机体脂质代谢、降低血糖血脂水平、改善心脑血管疾病及预防癌症等作用[1,2,3,4]。亚麻籽饼(粕)是亚麻籽经过机械压榨或溶剂浸提后的副产物,含有亚麻籽蛋白、亚麻籽胶、木酚素等功能性成分[5,6]。亚麻籽胶又称富兰克胶,由酸性多糖和中性多糖组成,以酸性多糖为主,酸性多糖由鼠李糖、岩藻糖、半乳糖醛酸组成,中性多糖主要由阿拉伯糖、木糖、半乳糖组成[7,8]。在食品工业中亚麻籽胶可以替代果胶、琼脂、阿拉伯胶、海藻胶等用作增稠剂、粘合剂、稳定剂、乳化剂和发泡剂,被广泛用于乳制品、肉制品、面制品、冰激凌和果冻制品中[9,10,11,12,13,14]。我国亚麻籽饼(粕)资源丰富,但大部分被作为动物饲料,或直接作为废弃物处理,造成资源浪费[15]。因此,开展亚麻籽胶的提取研究,对于亚麻籽饼(粕)的合理利用具有重要意义。
亚麻籽胶的提取大多选用亚麻籽壳作为原料,提取方法主要有干法和湿法两种。干法提取亚麻籽胶工艺简单、设备投资少,但胶产品中水不溶物含量高、胶纯度低、黏度较低、质量较差,使用领域有限。湿法提取亚麻籽胶质量好、附加值较高,应用领域广泛,缺点是工艺相对复杂、设备投资较大、生产成本较高[16,17,18,19]。
目前,以水为溶剂,利用搅拌[20]、微波[21]、超声波[22]、加无机盐[23]等方法辅助提取亚麻籽胶的研究较多,但这些方法都具有提取时间长、效率低等缺点。酶具有高效性、专一性等特点,并且作用条件比较温和[24],利用酶对细胞壁的破坏作用,可以促进亚麻籽胶的释放,提高提取效率,缩短提取时间。本试验以脱脂亚麻籽粕为原料,选用α-淀粉酶、纤维素酶、植酸酶、果胶酶,在各自最适条件下进行酶解,以亚麻籽胶得率为指标,筛选最适合提取亚麻籽胶的酶制剂;在单因素试验基础上,采用正交试验优化酶法联合超声波提取亚麻籽胶的工艺条件,并对制得的亚麻籽胶中单糖组成及含量进行测定,采用红外光谱对其结构进行分析,为亚麻籽胶的进一步开发提供研究基础。
1材料与方法
1.1试验材料
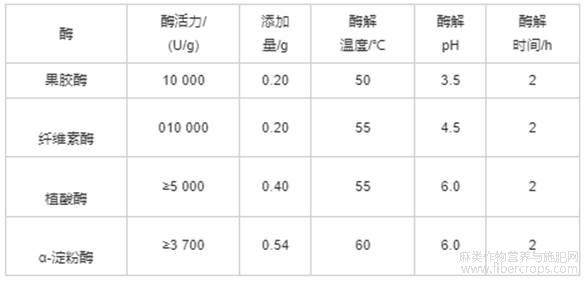
脱脂亚麻籽粕,康保明光粮油有限公司,外观整齐,无霉变;果胶酶(10000U/g)、亚麻籽胶,浙江一诺生物科技有限公司;纤维素酶(10000U/g),成都艾科达化学试剂有限公司;植酸酶(5000U/g),上海赫鹏新生物科技有限公司;α-淀粉酶(≥3700U/g),北京奥博星生物技术有限责任公司;柠檬酸(分析纯)、无水乙醇(分析纯),天津新技术产业园区科茂化学试剂有限公司。
Heraeus Multifuge X1R高速冷冻离心机、iD5ART红外光谱仪,赛默飞世尔(中国)科技有限公司;ZEISS Gemini SEM500发射扫描电子显微镜、Aztec50x能谱仪,英国牛津仪器;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;IKA rH basic2磁力加热搅拌器,艾卡(广州)仪器设备有限公司;DFD-700恒温水浴锅,上海树立仪器仪表有限公司。
1.2试验方法
1.2.1亚麻籽胶的提取
首先将脱脂亚麻籽粕粉碎、过0.425mm(40目)筛后,取10g亚麻籽粕粉于250mL圆底烧瓶中,按一定料液比(脱脂亚麻籽粕与水的质量体积比)加入水,用柠檬酸调节pH,酶处理与超声波辅助提取同时在可控温的超声波清洗器中进行,控制搅拌速度为300r/min,完成后,沸水浴灭酶5min。随后,离心至固液分离后减压浓缩上清液至原体积的50%~60%,冷却后边加无水乙醇边搅拌,至一定醇沉浓度(75%),4℃下静置1h,离心分离沉淀,经冷冻干燥制得亚麻籽胶。
1.2.2亚麻籽胶得率的计算及相关指标分析
亚麻籽胶得率为亚麻籽胶粉质量占亚麻籽粕质量的比例。
单糖组分测定:委托青岛科创质量检测有限公司测定亚麻籽胶单糖组成及含量。
红外光谱分析:分别取酶法联合超声波提取的亚麻籽胶及商品亚麻籽胶样品1~2mg,溴化钾150mg左右,研磨后压片,于红外光谱仪上进行分析,扫描次数16。
1.2.3数据处理
使用SPSS23.0软件进行方差分析(ANOVA)。
2结果与分析
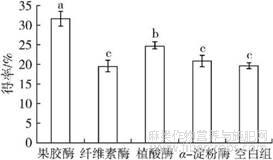
2.1最佳酶制剂的筛选(见图1)
选用α-淀粉酶、纤维素酶、植酸酶、果胶酶按1.2.1方法(无超声)提取亚麻籽胶,料液比1∶25,使酶活力达到2000U,在各自最适pH及温度条件下酶解2h(4种酶的最适条件见表1)。以亚麻籽胶得率为指标,筛选出最适合酶解脱脂亚麻籽粕的酶。不同酶制剂对亚麻籽胶得率的影响见图1。
表1 各种酶的反应条件
图1 酶制剂对亚麻籽胶得率的影响
注:图中不同小写字母表示差异显著
由图1可知,亚麻籽胶得率从高到低依次为果胶酶(31.47%)>植酸酶(24.57%)>α-淀粉酶(20.60%)>空白组(19.40%)>纤维素酶(19.27%)。果胶酶水解底物为果胶物质,亚麻籽胶是多糖混合物,多糖主要以酸性多糖为主,酸性多糖由于分子体积小,类似于果胶物质。亚麻籽粕经过果胶酶处理后,促进了亚麻籽胶的释放。除此之外,果胶酶还具有一定的澄清作用,用果胶酶提取后的溶液较其他3种酶提取后的溶液更为清澈。因此,选择果胶酶作为提取酶制剂。
2.2单因素试验
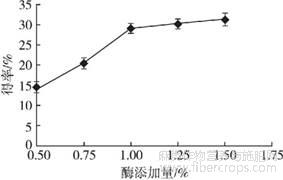
2.2.1酶添加量对亚麻籽胶得率的影响
控制提取温度40℃、提取时间20min、料液比1∶25、超声功率400W,设置酶添加量分别为0.50%、0.75%、1.00%、1.25%、1.50%,探讨酶添加量对亚麻籽胶得率的影响,结果见图2。
图2 酶添加量对亚麻籽胶得率的影响
由图2可知,随着酶添加量的增加,亚麻籽胶得率不断增加,在酶添加量为1.50%时亚麻籽胶得率达到最大值,但在酶添加量超过1.00%之后增加果胶酶添加量对亚麻籽胶得率影响甚微。因此,最适酶添加量为1.00%。
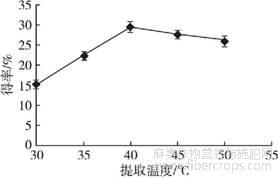
2.2.2提取温度对亚麻籽胶得率的影响
控制酶添加量1.00%、提取时间20min、料液比1∶25、超声功率400W,设置提取温度分别为30、35、40、45、50℃,探讨提取温度对亚麻籽胶得率的影响,结果见图3。
由图3可知,当提取温度低于40℃时,亚麻籽胶得率随着提取温度的升高呈明显上升趋势。在提取温度为40℃时得率达到最大值,为29.40%,当提取温度高于40℃后,得率缓慢降低。因此,最适提取温度为40℃。
图3 提取温度对亚麻籽胶得率的影响
2.2.3提取时间对亚麻籽胶得率的影响
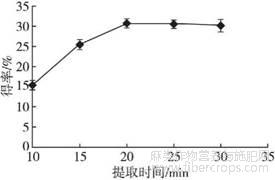
控制酶添加量1.00%、提取温度40℃、料液比1∶25、超声功率400W,设置提取时间分别为10、15、20、25、30min,探讨提取时间对亚麻籽胶得率的影响,结果见图4。
图4 提取时间对亚麻籽胶得率的影响
由图4可知,亚麻籽胶得率随着提取时间的延长而增加,在20min后得率趋于平缓。前期由于提取时间较短,亚麻籽胶没有完全溶出;随着提取时间的延长,亚麻籽胶逐渐溶出,在20min时基本完全溶出。因此,最适提取时间为20min。
2.2.4料液比对亚麻籽胶得率的影响
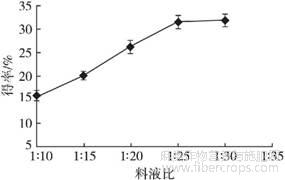
控制酶添加量1.00%、提取温度40℃、提取时间20min、超声功率400W,设置料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30,探讨料液比对亚麻籽胶得率的影响,结果见图5。
图5 料液比对亚麻籽胶得率的影响
由图5可知,料液比低于1∶25时,亚麻籽胶得率随着料液比的增加而显著提高。当料液比大于1∶25时,得率升高的趋势变缓,可能是由于料液比为1∶25时亚麻籽胶基本完全溶出。因此,最适料液比为1∶25。
2.2.5超声功率对亚麻籽胶得率的影响
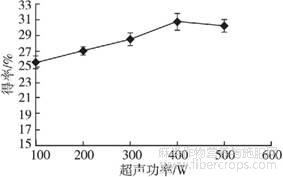
控制酶添加量1.00%、提取时间20 min、提取温度40℃、料液比1∶25,设置超声功率分别为100、200、300、400、500W,探讨超声功率对亚麻籽胶得率的影响,结果见图6。
图6 超声功率对亚麻籽胶得率的影响
由图6可知,随着超声功率的增大,亚麻籽胶得率呈缓慢上升趋势,当超声功率超过400W后,得率出现轻微下降趋势,可能因为超声功率过高对亚麻籽胶中的多糖物质有破坏作用。因此,最适超声功率为400W。
2.3正交试验
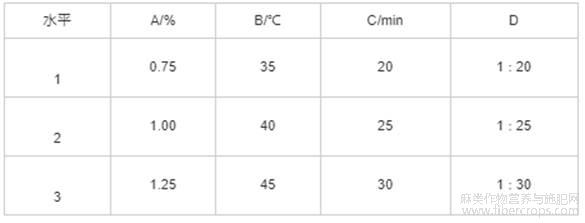
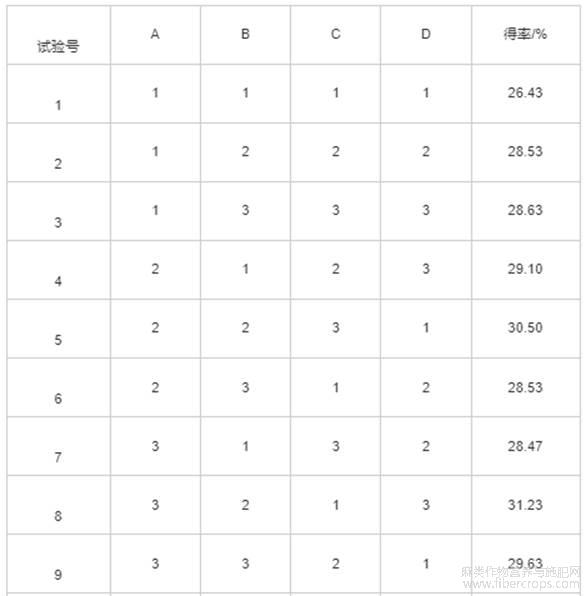
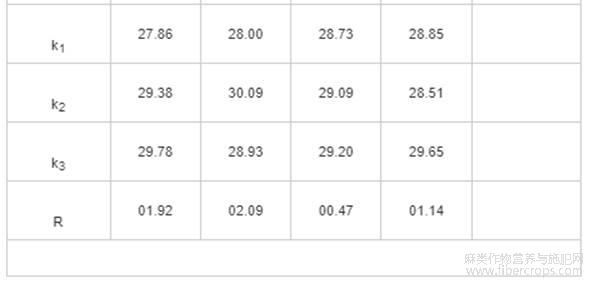
选择果胶酶为最佳酶制剂,根据单因素试验结果,固定超声功率为400W,以酶添加量(A)、提取温度(B)、提取时间(C)、料液比(D)为因素,以亚麻籽胶得率为指标,设计L9(34)正交试验,正交试验因素水平见表2,正交试验设计与结果见表3,方差分析见表4。
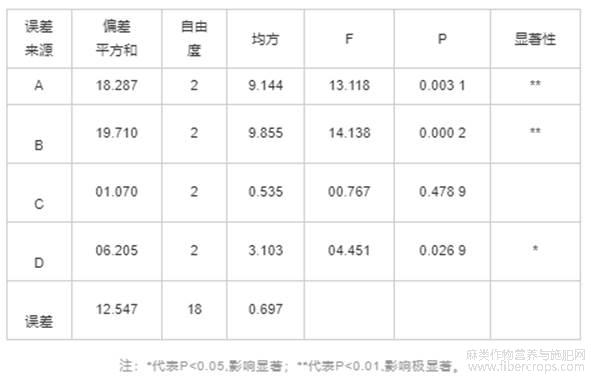
由表3可知,影响亚麻籽胶得率的因素主次顺序依次为B>A>D>C,即提取温度的影响最大,最优组合为A3B2C3D3。由表4可知,酶添加量和提取温度对亚麻籽胶得率有极显著影响(P<0.01),料液比对亚麻籽胶得率有显著影响(P<0.05)。4个因素对得率影响的大小顺序B>A>D>C,与表3中的极差分析结果一致。由于试验得到的最优组合A3B2C3D3未出现在正交试验的9组方案中,因此对最优组合和正交试验方案中亚麻籽胶得率最高的A3B2C1D3组合进行验证试验。
表2 正交试验因素水平
表3 正交试验设计与结果
表4 方差分析
通过验证试验得到组合A3B2C3D3的亚麻籽胶得率为33.41%,大于组合A3B2C1D3的亚麻籽胶得率(31.09%)。因此,选择A3B2C3D3为酶法联合超声波提取亚麻籽胶的最佳工艺,即酶添加量1.25%、提取温度40℃、提取时间30min、料液比1∶30、超声功率400W。在最佳工艺条件下,亚麻籽胶得率为33.41%。
2.4亚麻籽胶中单糖含量的测定
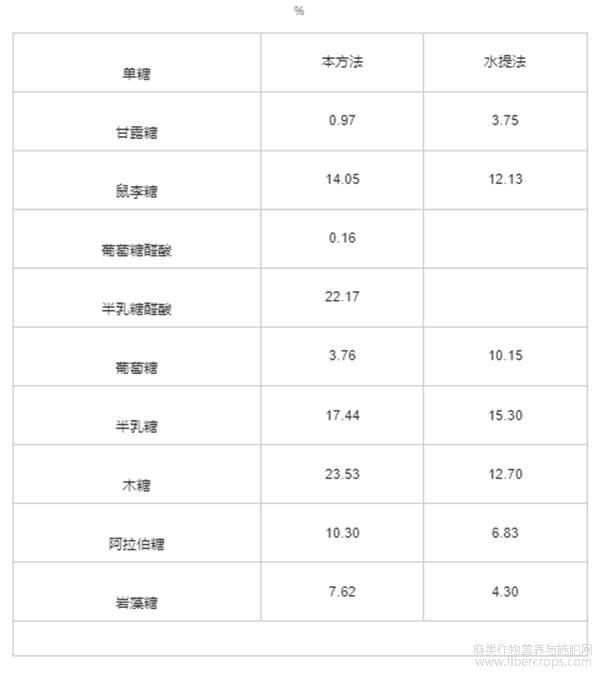
将本方法与张兰[25]水提法提取亚麻籽胶中的单糖组成及含量进行对比分析,结果如表5所示。
表5 亚麻籽胶中单糖组成及含量
由表5可知,本方法提取的亚麻籽胶中单糖种类更为丰富,如半乳糖醛酸Bushra等[26]提取的亚麻籽胶由鼠李糖、阿拉伯糖、甘露糖、葡萄糖、岩藻糖、木糖、半乳糖、氨基葡萄糖、葡萄糖醛酸和半乳糖醛酸组成。本方法中氨基葡萄糖未检出。原因一方面可能是国内检测亚麻籽胶组成时很少用氨基葡萄糖标准品,另一方面可能是提取亚麻籽胶的原料品种、种植及后期处理方式等原因造成的。
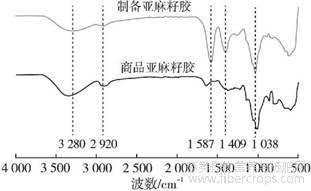
2.5红外光谱分析(见图7)
图7 不同来源亚麻籽胶的红外光谱图
由图7可知,在3280cm-1处的特征峰为羟基的伸缩振动,在2920cm-1处的特征峰为甲基、亚甲基或次甲基中C—H的伸缩振动,1409cm-1处的特征峰为C—H的变角振动,这3组峰为多糖的典型特征吸收峰,这一结果与李小凤等[27]对亚麻籽胶的红外光谱分析结果一致。在超声过程中,羰基可能参与了氢键的形成,导致其吸收峰向低波数移动,即在1587cm-1处出现特征峰,1038cm-1处的特征峰为常见的吡喃型糖环中C—O—C的伸缩振动。以上结果表明,通过酶法联合超声波提取的亚麻籽胶属于多糖类物质,且酶没有改变亚麻籽胶的结构。
3结论
筛选出提取亚麻籽胶的最优酶制剂为果胶酶,果胶酶联合超声波提取亚麻籽胶的最佳工艺条件为:果胶酶添加量1.25%,提取温度40℃,提取时间30min,料液比1∶30和超声功率400 W。在最佳工艺条件下,亚麻籽胶得率为33.41%。
亚麻籽胶中单糖的组成及含量为甘露糖0.97%、鼠李糖14.05%、葡萄糖醛酸0.16%、半乳糖醛酸22.17%、葡萄糖3.76%、半乳糖17.44%、木糖23.53%、阿拉伯糖10.30%、岩藻糖7.62%。
虽然果胶酶本身具有一定澄清作用,冷冻干燥后的亚麻籽胶粉呈乳白色,但仍没有达到商品亚麻籽胶粉纯白色的效果。在今后的试验中可对亚麻籽胶的脱色工艺进行深入研究。
参考文献
[1]左青.亚麻籽油及其关键生产技术[J].中国油脂,2017,42(8):157-160.
[2]李燕青,金军.亚麻籽中氨基酸组成及含量的研究[J].食品研究与开发,2018,39(7):169-173.
[3]谭鹤群.亚麻胶浸提与喷雾干燥工艺研究[D].北京:中国农业大学,2004.
[4]刘婷婷,石少侠,段虎平,等.亚麻籽营养成分提取及其功能和应用研究进展[J].中国油脂,2020,45(3):90-97.
[5]邹演,蔡永敏,胡炜东.亚麻籽粕制备多肽饮料的研究[J].食品工业,2017,38(11):149-151.
[6]乔海明,米君.河北省油用亚麻当前育种任务及对策[J].河北北方学院学报(自然科学版),2010,6(2):55-58.
[7]陈海华.亚麻籽胶的溶解特性[J].食品与发酵工业,2004,30(4):44-48.
[8]李群,胡晓军,许光映,等.亚麻胶提取工艺研究[J].食品科技,2013,38(7):278-282.
[9]BASIRI S,HAIDARY N,SHEKARFOROUSH S S,et al.Flaxseed mucilage:a natural stabilizer in stirred yogurt[J].Carbohydr Polym,2018,187:59-65.
[10]SOLEIMANI-RAMBOD A,ZOMORODI S,RAEISI N S,et al.The effect of xanthan gum and flaxseed mucilage as edible coatings in cheddar cheese during ripening[J/OL].Coatings,2018,8(2):80 [2021-02-04].https://doi.org/10.3390/coatings8020080.
[11]邓思杨,蒋悦,乔雨,等.亚麻籽胶与变性淀粉对速冻猪肉丸品质影响的研究[J].食品研究与开发,2018,39(11):59-64.
[12]孙晓冬,史峰山,杜平,等.亚麻籽胶在面制品中的应用[J].中国食品添加剂,2003(3):64-65,97.
[13]麦蕴诗.基于肠道菌群探讨亚麻籽胶减肥作用及其在果冻中的应用[D].广州:暨南大学,2018.
[14]胡国华,陈明亚.麻籽胶的特性及其在冰淇淋中的应用[J].饮料与速冻食品工业,2003,9(4):23-25.
[15]吴兴雨,马佳,姚玥,等.响应面法优化酶法提取亚麻蛋白工艺[J].食品工业科技,2020,41(14):166-171.
[16]LIU J,SHIM Y Y,SHJEN J H,et al.Variation of composition and functional properties of gum from six Canadian flaxseed(Linum usitatissimum L.)cultivars[J].Int J Food Sci Technol,2016,51(10):2313-2326.
[17]LIU J,SHIM Y Y,POTH A G,et al.Conlinin in flaxseed(Linum usitatissimum L.) gum and its contribution to emulsification properties[J].Food Hydrocolloid,2016,52:963-971.
[18]BOUAZIZ F,KOUBAA M,BARBA F,et al.Antioxidant properties of water-soluble gum from flaxseed hulls[J/OL].Antioxidants,2016,5(3):26[2021-02-04].https://doi.org/10.3390/antiox5030026.
[19]杨雪艳,聂开立,林风,等.亚麻籽功能成分的综合提取工艺研究[J].中国油脂,2017,42(1):116-120,124.
[20]MOCZKOWSKA M,KARP S,NIU Y,et al.Enzymatic,enzymatic-ultrasonic and alkaline extraction of soluble dietaryfibre from flaxseed:a physicochemical approach[J].Food Hydrocolloid,2019,90:105-112.
[21]徐江波.亚麻籽深加工关键技术研究[D].西宁:青海师范大学,2014.
[22]冯爱娟,叶茂.超声波辅助提取亚麻籽胶工艺条件优化[J].食品研究与开发,2016,37(10):66-69.
[23]欧阳伶俐,刘壮,姚亚亚,等.亚麻籽饼酶法脱胶工艺条件研究[J].中国油脂,2017,42(5):127-131.
[24]郭项雨,孙伟,任清.亚麻饼粕中亚麻胶的提取及其理化性质研究[J].北京工商大学学报(自然科学版),2010,28(4):31-35.
[25]张兰.亚麻粕中亚麻胶提取及其功能特性的研究[D].天津:天津科技大学,2010.
[26]BUSHRA S,PANG Z H,LIU X Q,et al.Flaxseed gum:extraction,bioactive composition,structural characterization,and its potential antioxidant activity[J/OL].J Food Biochem,2019,43(11):e13134[2021-02-04].https://doi.org/10.111/jfbc/13134.
[27]李小凤,赵倩竹,滕英来,等.亚麻籽胶微波辅助提取与热水浸提方法比较研究[J].中国粮油学报,2016,31(8):55-61.
文章摘自:姚玥,孙凯杨,孙丰梅.酶法联合超声波提取亚麻籽胶[J].中国油脂,2022,47(02):104-108+123.DOI:10.19902/j.cnki.zgyz.1003-7969.210084.