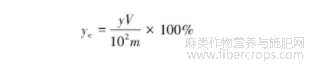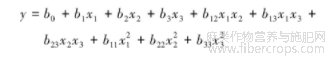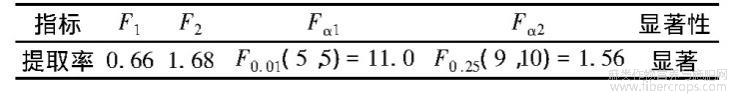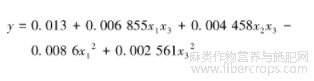摘 要:为充分开发黄麻纤维的应用价值,探究其中是否含有黄酮类化合物,采用水醇提取法制备了黄麻纤维提取液,利用紫外分光光度法测试提取液中黄酮含量,按照二次通用旋转组合设计方法对提取工艺进行优化,研究了乙醇体积分数、浴比、提取时间3个工艺因子与黄酮类化合物提取率之间的关系。对经过旋转蒸发和真空冷冻干燥后黄麻纤维提取物的化学结构、热稳定性和表面形貌进行测试与分析。结果表明:黄麻纤维提取物与芦丁标准品化学结构相似,说明其中含有黄酮类化合物,其最优提取工艺是乙醇体积分数75%,浴比1∶50,提取时间150min,该条件下黄酮的提取率为0.037%。
关键词:黄麻纤维;黄酮;响应面分析;提取工艺;水醇提取法
黄酮类化合物广泛存在于高等植物的根、茎、叶、花、果实中,是植物在长期自然选择过程中产生的一类次生代谢产物[1],其不仅在植物的生长发育中起着重要作用,还具有抗菌、抗病毒、抗肿瘤、抗氧化、抗炎镇痛、抗衰老等功效[2]。研究表明罗布麻类纤维中存在黄酮类化合物,罗布麻纤维乙醇提取液中黄酮含量为0.09%时,其对金黄色葡萄球菌和大肠杆菌具有一定的抗菌性[3],这说明黄酮类化合物是罗布麻纤维具有抗菌性的原因之一。在传统脱胶工艺中,麻类纤维中的黄酮等有价值物质会随着预处理和脱胶过程而流失,大部分变成脱胶废液,浪费了宝贵的黄酮资源。
为充分提高麻类纤维的利用价值,在脱胶之前对麻纤维进行黄酮萃取,不仅可获得黄酮,还可起到麻纤维脱胶前预处理的作用,达到一步多用的效果。麻类纤维中提取黄酮类化合物的主要方法是溶剂法,大都使用乙醇和水的混合物[4]。为提高提取效率,学者们探索了采用微波[5]、超声波[6]和酶[7]等协助溶剂萃取,也有将新型的超临界流体技术应用于黄酮萃取中[3]。黄春梅等[8]采用微波辅助法提取菜用黄麻叶中黄酮类化合物,得出当萃取温度为95℃,提取时间为30min,浴比为1∶60,微波电流为180mA时,黄酮类化合物的提取率为1.77%。杨永涛[9]针对罗布麻,采用55%乙醇在提取温度为50℃,提取时间为25min,浴比为1∶35,超声波功率为400W最佳工艺条件下,得到黄酮类化合物提取率为2.033%。陈如冰等[10]针对长蒴黄麻叶中黄酮的提取,得到较优条件为温度42℃,浴比1∶35,乙醇体积分数80%,提取时间25min,在此条件下长蒴黄麻叶中黄酮的提取率为2.577%。刘毅等[11]研究得出,提取大麻叶中黄酮的最佳工艺条件为乙醇体积分数50%,料液比1∶20,提取时间2.0h,提取温度70℃,在该最优提取条件下,大麻叶总黄酮提取量为14.28mg/g。
目前,针对经过沤麻后的黄麻纤维中是否含有黄酮类化合物以及其含量的系统性研究较少,因此,本文使用水醇提取法,按照二次通用旋转组合设计方法制备了黄麻纤维提取液,并对提取工艺进行优化,以期为黄麻纤维中黄酮类化合物的充分利用以及提高黄麻纤维附加值提供一定的参考。
1试验部分
1.1试验材料与仪器
材料:黄麻韧皮部纤维,经过沤麻处理,湘南麻业有限公司;芦丁标准品,合肥博美生物科技有限公司;无水乙醇(CH3CH2OH)、三氯化铝(AlCl3),分析纯,国药集团化学试剂有限公司;去离子水,自制。
仪器:YP1002N型电子天平,上海天美天平仪器有限公司;RE-3000型旋转蒸发器,上海亚荣生化仪器厂;Labconco2.5L型真空冷冻干燥机,美国LABCONCO公司;JSM-5600LV型扫描电子显微镜(SEM),日本JEOL公司;IE 300 X型能谱仪(EDS),英国Oxford公司;Lambda 35型紫外-可见近红外分光光度计、Spectrum Two型傅里叶变换红外光谱仪(FT-IR)、DSC-4000型差示扫描热量仪(DSC)、TGA-4000型热重分析仪(TGA),均为美国Perkin Elmer公司。
1.2黄酮类化合物提取
为探讨乙醇体积分数、浴比以及提取时间对黄麻纤维中黄酮类化合物提取效果的影响,采用二次通用旋转方法设计试验。具体操作步骤为:将配制的乙醇溶液置于圆底烧瓶中,放入精确称量的5.0g黄麻纤维,在不同试验参数下经索氏提取后得到黄麻提取液,待测;将剩余提取液旋转蒸发,经真空冷冻干燥后,得到黄麻纤维提取物,备用。
1.3黄酮总含量的测定
1)标准曲线的绘制。参照文献[3]中的方法进行绘制。将芦丁标准品于120℃下干燥至质量恒定,精确称取0.01g,溶解于60%的乙醇溶液中定容至100mL,分别取1、2、3、4、5和6mL,再加入5%的AlCl3溶液定容至100mL,配制成质量浓度分别为1、2、3、4、5和6mg/L的芦丁标准品溶液。摇匀静置15min后,用紫外-可见近红外分光光度计在波长为415nm的可见光下测定芦丁标准品溶液的吸光度。分别以芦丁标准品溶液的吸光度和质量浓度为横坐标和纵坐标,绘制芦丁标准品溶液的吸光度-质量浓度标准曲线,得到回归方程:
式中:x为吸光度;y为芦丁标准品溶液的质量浓度,mg/L。
2)黄麻提取液中黄酮含量的测定。将1mL黄酮提取液置于10mL容量瓶中定容,稀释后测定吸光度,按照标准曲线计算黄酮的质量浓度,然后代入下式计算黄酮提取率。
式中:ye为黄酮提取率,%;V为黄酮提取液的体积,mL,m为黄麻纤维质量,mg。
1.4二次通用旋转组合设计
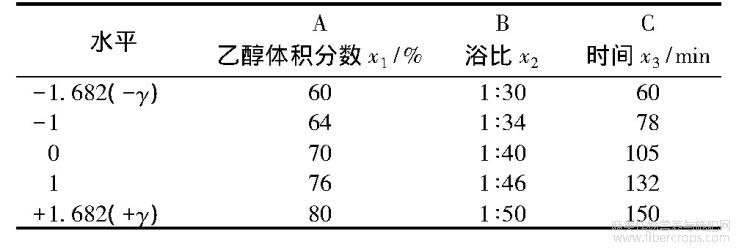
二次通用旋转组合设计方法试验次数少,计算过程简单,可部分消除回归系数间的相关性,且二次设计具有旋转性,减小了试验误差,试验结果具有较强的代表性[12],因此,本文选用二次通用旋转组合设计方法进行提取工艺优化试验。根据前期单因素试验探索结果,选用乙醇体积分数x1(%)、浴比x2、提取时间x3(min)为因子,以±γ、±1、0为水平,以黄酮提取率为指标,进行三因子的二次通用旋转组合设计,试验因子水平编码表见表1。
1.5黄麻纤维提取物的结构和性能测试
对经过旋转蒸发和真空冷冻干燥的黄麻纤维提取物进行测试,用以鉴定黄麻纤维提取物中是否含有黄酮类化合物。
1.5.1化学结构测试
采用傅里叶红外光谱仪测试充分干燥后样品的化学结构,扫描范围为4000~400cm-1,分辨率为8cm-1,扫描次数为30。
1.5.2表面形态观察及表面元素测试
采用扫描电子显微镜测试喷金后样品的表面形态,并采用配备的能谱仪对其表面元素组成进行分析,加速电压为5kV。
1.5.3热性能测试
采用差示扫描量热仪测试样品的热性能。测试样品质量为5~8mg,以10℃/min的速率升温至250℃,保温3min消除热历史,得到第1次升温曲线;再以10℃/min的降温速率降温至-60℃,得到第1次降温曲线;然后再以10℃/min的速率升温至250℃,得到第2次升温曲线。
采用热重分析仪测试样品的热稳定性。将5~8mg样品置于坩埚中,在氮气气氛中以10℃/min的速率升温,升温范围为30~700℃。
2结果与分析
2.1二次通用旋转设计试验结果分析
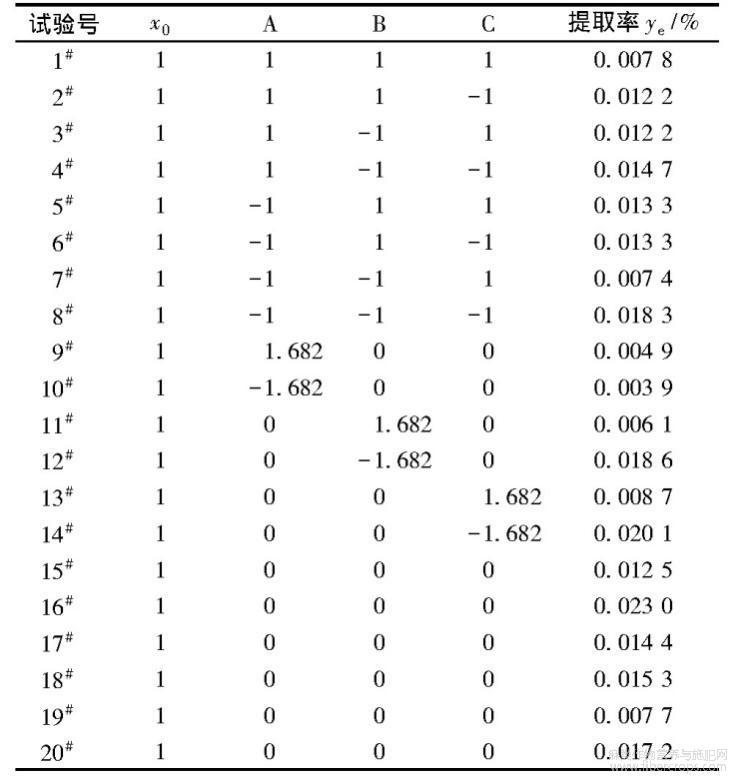
根据三因子二次通用旋转试验设计的结构矩阵表进行试验,利用紫外分光光度法测试提取液中黄酮类化合物含量,试验设计方案及提取液中黄酮类化合物提取率如表2所示。
2.2回归方程的建立及求解
2.2.1回归方程系数的求解及显著性检验
针对二次通用旋转试验方案及结果,采用Design Expert8.0(DX8)数据处理软件进行计算,建立指标与工艺参数间的回归方程。回归方程的模型为
2.2.2回归方程的显著性检验结果分析
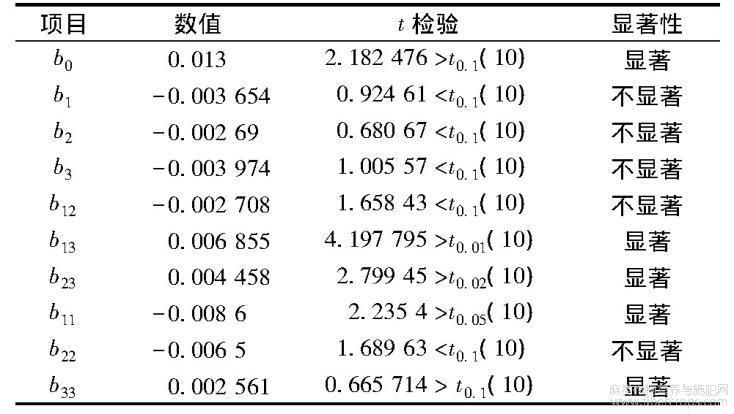
同时,对建立的回归方程的显著性进行检验,结果见表4。仅当F1<Fα1且F2>Fα2时,才可认为回归方程在某一对显著性水平下是显著的。由表4可知,回归方程的失拟值F1小于F0.01(5,5),说明回归方程模型失拟度不显著;则回归方程对响应值影响的显著性大小由回归值F2来判定,F2越大回归方程中变量影响的显著程度越高。由表4可知,回归方程的回归值F2大于F0.25(9,10),说明回归方程显著。
表2 试验设计及黄酮类化合物提取率
注:x0为常数项。
表3 回归系数求解及显著性检验结果
注:t0.001(10)=4.587;t0.01(10)=3.169;t0.1(10)=1.812。
表4 回归方程的显著性检验结果
2.2.3回归模型分析
建立有效的回归方程并绘制其等高线图。根据表3和表4的显著性检验结果,剔除不显著的系数,建立有效回归方程为
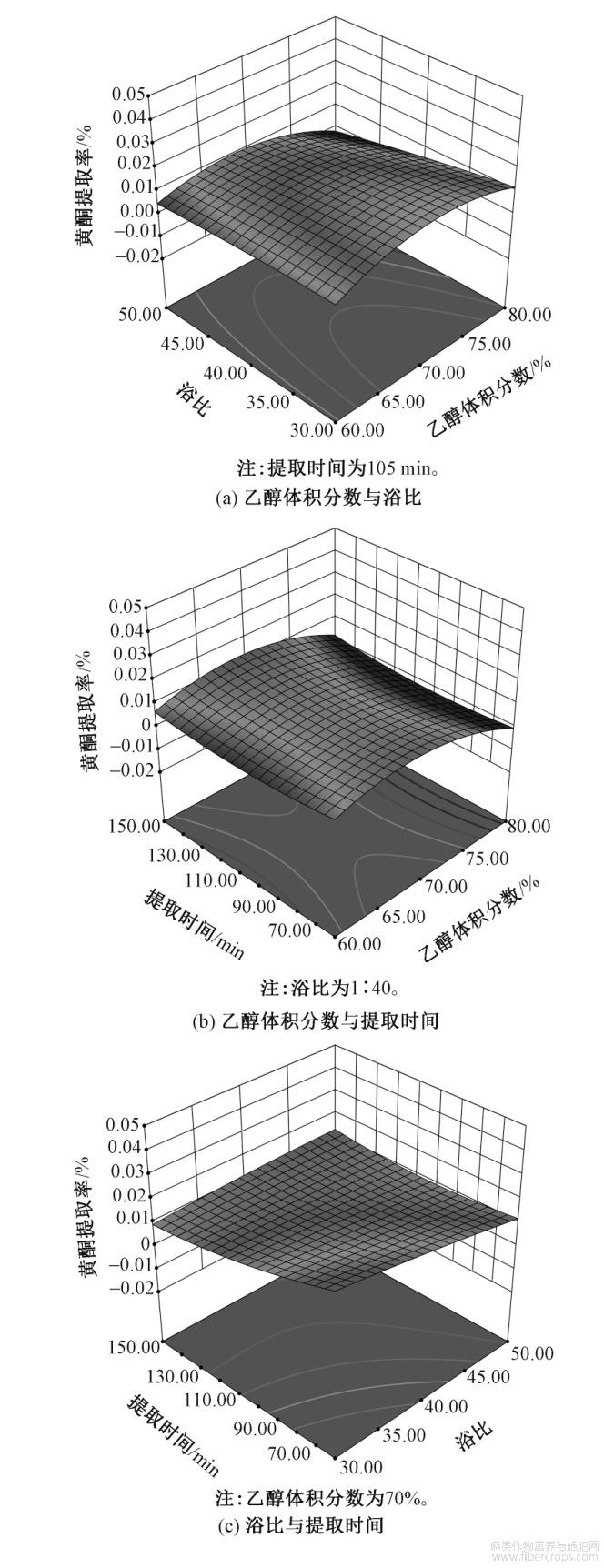
根据有效回归方程绘制等高线,观察各因子间的两两交互作用对提取率的影响如图1所示。
图1 不同工艺及其交互作用对黄酮提取率的影响
由图1(a)可知,浴比的变化对黄酮提取率的作用程度较小,乙醇体积分数对黄酮提取率的影响是先增大后减小。由图1(b)可知,乙醇体积分数对黄酮提取率的影响呈现先增大后减小的趋势;随着提取时间的延长,黄酮提取率逐渐减小且幅度较小。由图1(c)可知,浴比对黄酮提取率的影响较小,随着时间的增加,黄酮提取率逐渐减小。综合分析可知,各因素的影响关系为:x1(乙醇体积分数)>x2(提取时间)>x3(浴比)。
2.2.4优化模型的建立及求解
通过计算得到回归方程:
约束条件为:-1.682≤x1≤1.682,-1.682≤x2≤1.682,-1.682≤x3≤1.682。
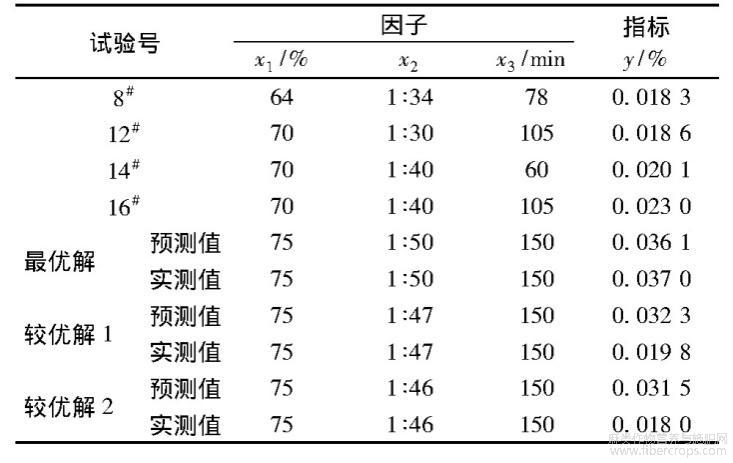
采用随机方向搜索法在Mat Lab中运算,根据随机方向搜索的特点,选择多次不同初始点进行求解,寻找全局最优值minf(x)。选择最优解(f(x)=0.036 1)、较优解1(f(x)=0.032 3)、较优解2(f(x)=0.031 5)来分别进行验证,解码结果如表5中预测值所示。
表5 二次通用旋转试验验证结果
2.3优化工艺的验证
为验证最优工艺的准确性,根据2.2.4节计算结果,对最优解、较优解1和较优解2重新进行验证提取,并从表2的通用旋转试验方案中选取4个性能较好的试验结果(试验号分别为8#、12#、14#、16#)作为对照组,验证结果见表5。可知,最优解提取率的预测值和实测值均大于其他试验结果,表明最优工艺具有可靠性和有效性。选用最优解即乙醇体积分数75%,浴比1∶50,提取时间150min为最优提取工艺,此时提取率为0.037 0%,即370mg/kg。尽管此工艺为最优工艺,但与相关文献相比,黄酮提取率还是相对较低,这可能是由于黄麻纤维中黄酮含量本身相对较少,且采用的黄麻纤维经过了一定的沤麻处理,导致黄酮含量进一步减少。
2.4黄麻纤维提取物的结构与性能分析
2.4.1黄麻纤维提取物的化学结构分析
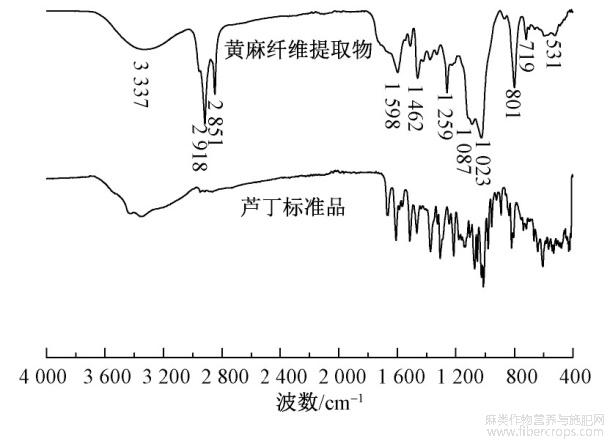
采用傅里叶变换红外光谱仪分别对黄麻纤维提取物和芦丁标准品进行测试,结果见图2。
图2 芦丁标准品和黄麻纤维提取物的红外光谱图
由图2可以看出,黄麻纤维提取物在3337cm-1处有强吸收峰,这与羟基特征吸收峰范围(3750~3000cm-1)较为一致,可推测样品化合物中可能含有羟基基团,同时此处的峰强而宽,也有可能是来自于样品内存在不同程度的氢键作用;在2918和2851cm-1处附近的吸收峰属于饱和C—H键伸缩振动峰,推测黄麻纤维提取物中含有C—H结构;1462cm-1处的吸收峰说明样品中含有—CH2基团;在1087cm-1处的吸收峰可能是C—O伸缩振动引起的,这类吸收峰代表黄酮环上有醚键C—O—C和醇类的C—O;801cm-1处是黄酮分子中苯环上的C—H面外弯曲振动峰;531cm-1处是O—H面外弯曲振动峰[9]。图中黄麻纤维提取物的红外光谱与芦丁标准品的谱图部分相似,可推测黄麻纤维提取物中可能含有芦丁(槲皮素-3-O-芸香糖苷),或者芦丁的衍生物成分[9],这与相关文献报道结果一致。
2.4.2表面形态和能谱分析
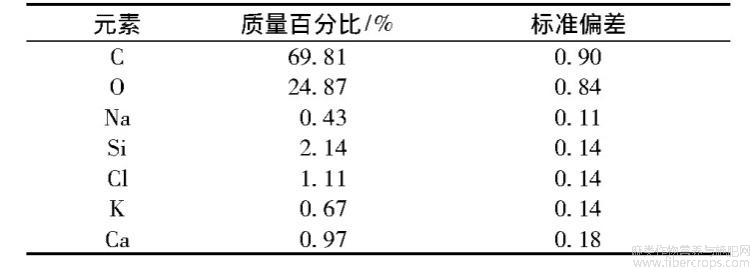
黄麻纤维提取物的表面形态和元素含量测试结果如图3和表6所示。
图3 黄麻纤维提取物的表面扫描电镜照片(×300)
表6 黄麻纤维提取物元素组成及含量
由图3可知,黄麻纤维提取物表面结构较为松散。由表6可知,黄麻纤维提取物中含有C元素(69.81%)、O元素(24.87%)、Si元素(2.14%)、Cl元素(1.11%),以及微量的Na、K和Ca元素。结果表明黄麻纤维提取物中含有较多杂质,需要对黄麻纤维提取物进行树脂吸附等后续分离提纯,才能得到较纯的黄酮类化合物。
2.4.3热稳定性分析
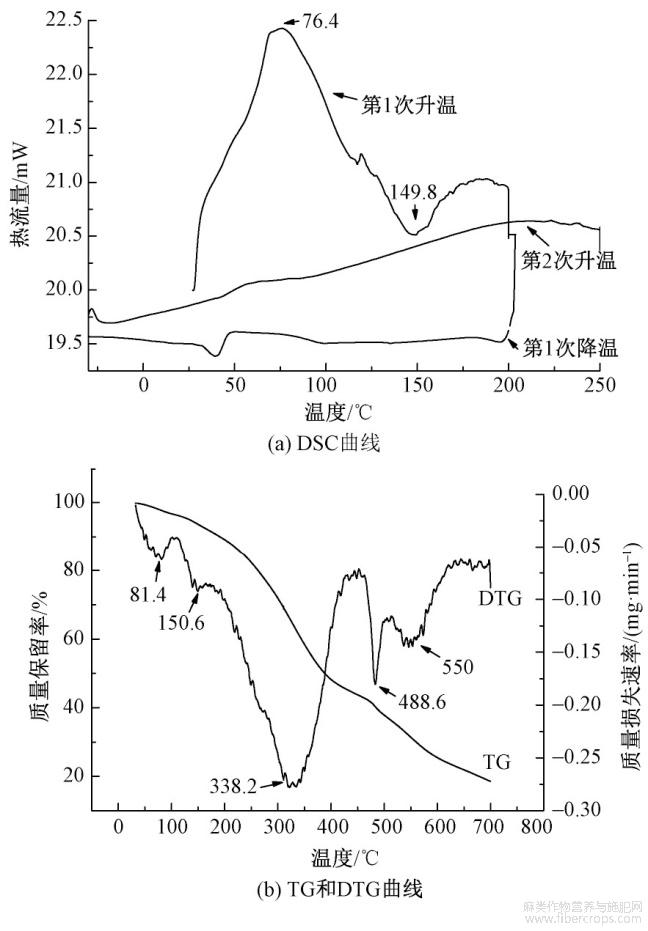
分别使用差示扫描热量仪和热重分析仪对黄麻纤维提取物进行热稳定性分析,结果见图4。
图4 黄麻纤维提取物的热性能
由图4(b)可知,黄麻纤维提取物质量损失的第1阶段发生在81.4℃附近,质量损失率为2.94%,这是黄麻纤维提取物中存在的水分在加热时蒸发而引起的,这一阶段对应图4(a)第1次升温过程中,在76.4℃时出现的1个明显的吸热峰,由于这一部分是水分蒸发引起的,属于不可逆过程,因此,在第2次升温中,该温度下DSC曲线平稳。质量损失第2个阶段是从150.6℃附近开始的,对应图4(a)中的放热峰。该阶段样品慢慢氧化分解从而质量下降,在338.2℃时质量显著降低;DTG曲线出现尖锐热分解强峰,质量损失率为31.64%。第3个质量损失阶段发生在338~500℃之间,并在488.6℃时DTG曲线出现1个较缓的质量损失峰,可能是少量样品部分挥发分解所致。第4个质量损失阶段从500℃开始,在550℃时出现1个平缓的放热峰,随后样品质量损失逐渐变缓,直到热分解反应结束。根据热稳定性测试结果,结合参考文献[13]可知,黄麻纤维提取物中含有黄酮类化合物,且黄酮的热稳定性高于黄麻脱胶时的温度(100℃左右)。
3结论
1)本文采用二次通用旋转组合设计方法,建立了黄酮提取率(y)与乙醇体积分数(x1)、浴比(x2)、提取时间(x3)间关系的回归方程为:y=0.013+0.006 855x1x3+0.004 458x2x3-0.008 6x12+0.002 561x32。
2)根据建立的有效回归方程得到优化工艺为:乙醇体积分数75%、浴比1∶50、提取时间150min,黄酮提取率可达到0.037 0%,并经试验验证表明该回归方程及其最优参数的准确性。
3)黄麻纤维提取物中含有黄酮类化合物。热稳定性测试结果表明,黄麻纤维提取物的热分解可分为4个阶段,与现有文献研究中黄酮的热分解性质基本吻合,从另一个侧面表明黄麻纤维中含有黄酮类化合物。
参考文献
文章摘自 崔启璐,李佳蔚,潘柳桂,杨飞,郁崇文.黄麻纤维中黄酮类化合物提取工艺优化及表征[J].纺织学报,2021,42(08):90-95.